Бронхиальная астма – распространенное заболевание, встречающееся у 4-10% населения. В детском возрасте процент возрастает до 10-15.
Для бронхиальной астмы разработаны особые стандарты лечения. Однако часто на начальных стадиях ее неверно диагностируют и проводят неправильную терапию.
Поэтому в случае болезни, симптомом которой является свистящий хрип, стоит всегда помнить, что это может быть астма.
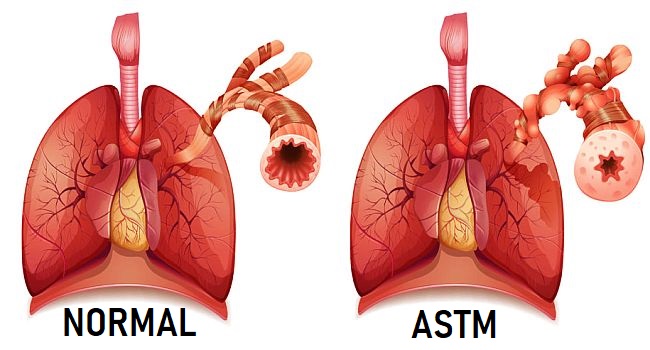
Бронхиальная астма представляет собой хроническую патологию воспалительного характера, поражающую дыхательные пути. Возникающие периодически приступы удушья являются основным клиническим проявлением заболевания.
Диагноз устанавливает врач после проведения комплексного обследования пациента. Для того чтобы не спутать бронхиальную астму с другими заболеваниями дыхательных путей, изучают снимки грудной клетки, полученные при компьютерной томографии или рентгенографии.
Стандарты лечения существуют для многих заболеваний, они представляют собой поэтапный комплекс мер, необходимый для постановки диагноза по всем необходимым критериям и эффективного лечения заболевания.
Стандарт лечения астмы включает современные методы лечения патологии, проверенные временем и улучшающие состояние больного.
Стандарты, по которым оказывается помощь больным, утверждаются Министерством здравоохранения.
В соответствии с ними проверяется медицинская документация, заполненная врачом, анализируется правильность назначенного комплекса обследований и терапии. Использование стандартов лечения астмы обусловлено несколькими причинами:
- Помощь, которая оказывается больному, в этом случае является эффективной и не приносит вреда здоровью.
- По стандартам работают все специалисты как в государственных, так и в частных лечебных учреждениях.
- В стандарты включены последние научные данные о патологии. Это позволяет более эффективно проводить лечение.
- Создается база статистических данных, единая для всех.
Степень тяжести бронхиальной астмы устанавливается при диагностике. От нее зависит выбор терапии заболевания. При диагностике учитывают интенсивность клинических симптомов астмы и результаты дополнительных исследований, а именно:
- При сборе анамнеза выясняется частота приступов и время их появления.
- Назначается анализ мочи, крови, обязательно исследование мокроты.
- Оценивается эффективность назначенной медикаментозной терапии.
- Оцениваются показатели внешнего дыхания, их отклонение от нормы.
По степени тяжести болезнь классифицируют следующим образом:
- 1-я степень — самая легкая форма болезни. Одышка, приступы и хрипы появляются не чаще одного раза в неделю. Приступы возникают после контакта с аллергенами, возможны во время простуды или при уборке дома, протирании пыли.
Также приступ может начаться от сигаретного дыма или резкого запаха. Речь пациента не нарушена, состояние в период между приступами в норме. При приступе возможна тахикардия, при выдохе слышен свистящий звук, а вдох удлиненный.
- 2-я степень: симптомы проявляются уже чаще, но приступ удушья возникает не более трех раз в неделю.
При приступе пациенту становится тяжело дышать. В легких прослушиваются сухие хрипы. При кашле иногда отделяется мокрота. Состояние пациента беспокойное. Кожа бледнеет, а в области носогубного треугольника она приобретает синеватый оттенок. Выдох бывает затрудненным, с громким свистом.
- 3-я степень: удушье может возникать у астматика ежедневно. Необходима постоянная поддерживающая терапия и медицинское наблюдение.
Наблюдается систематическое нарушение дыхания. У больного появляется холодный пот, его охватывает страх и паника. Свист во время дыхания отчетливо слышен даже с расстояния. Повышается артериальное давление.
- 4-я степень: обострения случаются несколько раз в день, часто симптомы удушья беспокоят ночью. Физическая активность пациента ограничена, так как нагрузка часто провоцирует приступ. Нарушается сон больного. Необходим ежедневный прием препаратов.
- 5-я степень: тяжелое течение астмы, слабо поддающееся коррекции. Назначаются большие дозировки сильнодействующих препаратов. Речь пациента прерывистая. Физическая активность сильно ограничена. Возможен летальный исход при приступе.
Диагностика состоит из нескольких этапов, каждый из которых связан с предыдущим.
- Сбор анамнеза и жалоб. Чаще всего пациент жалуется на одышку, затрудненный выдох, кашель, периодические приступы удушья. Важным критерием является изменение симптоматики при использовании бронхолитиков. Также выясняются факторы риска: наследственность, аллергические реакции и т. д.
- Объективный осмотр. Врач фиксирует одышку у пациента, симптомы возбуждения при приступе, хрипы при аускультации.
- Функциональные тесты. Наиболее простым методом является пикфлоуметрия. Тестирование позволяет врачу оценить тяжесть состояния. Пикфлоуметр должен иметь дома каждый астматик для ежедневного контроля.
- Выявление аллергенов с помощью различных методик. Применяют скарификационные пробы, возможно проведение провокационных тестов.
- Для дифференциальной диагностики назначаются дополнительные методы обследования: рентгенографию органов грудной клетки, ЭКГ, общий анализ крови, исследование мокроты.
Особенно тщательно нужно сопоставлять симптомы и результаты анализов у детей и пожилых людей, так как симптоматика часто отличается от стандартной.
Все средства, которые используются при лечении бронхиальной астмы, указаны в стандарте медицинской помощи.
Главным показателем эффективности лечения является достижение полного контроля над БА.
Принцип лечения заключается в следующем: терапия будет зависеть от степени нарушения функций бронхиального дерева. Количество препаратов и их дозировка с каждой ступенью увеличиваются.
Препараты подбираются с учетом сопутствующих патологий, индивидуальной непереносимости. Каждая ступень предполагает выбор между той или иной группой препаратов.
Если назначенные лекарства не приносят эффекта, осуществляется переход на новый уровень. Все этапы прописаны в стандарте лечения бронхиальной астмы.
- 1-я ступень. Перед тренировками, занятиями спортом, другой физической нагрузкой принимаются ингаляционные препараты, такие как бета2-агонисты, недокромил натрия. Иногда используют теофиллины короткого действия. Однако от их использования часто появляются побочные эффекты, поэтому их применение нежелательно.
- 2-я ступень. Лекарства те же, что и на 1-й ступени, но прием длительный и ежедневный. Используются теофиллины длительного действия. Иногда для лечения применяются ингаляционные гормональные препараты в дозировке до 800 мкг/день.
- 3-я ступень. Пациенту назначаются кортикостероиды в виде аэрозолей в дозировке 800-2000 мкг/день. Помимо них используют бронходилататоры длительного действия в качестве поддерживающей терапии, для уменьшения частоты ночных приступов удушья. В момент приступа применяются бета2-агонисты короткого действия.
- 4-я ступень Астма не поддается контролю, можно только улучшить состояние больного, уменьшить число приступов. Используют ингаляционные гормоны в больших дозах (800-2000 мкг), при тяжелых обострениях кортикостероиды принимают перорально. Бета2-агонисты быстрого действия применяют при приступе у взрослых, но не более 4 раз в сутки.
Обострения БА происходят из-за неправильно подобранной терапии или несоблюдения больным рекомендаций врача. Еще одна возможная причина – длительный контакт с аллергенами.
Часто подобные состояния требуют неотложной медицинской помощи. Нарастает одышка, свистящие хрипы слышны на расстоянии.
При приступе применяются следующие группы препаратов:
- ингаляционные бета2-агонисты: сальбутамол, фенотерол;
- глюкокортикоиды в виде ингаляций;
- ГКС в пероральной форме при тяжелых проявлениях астмы;
- антихолинергические средства – используются при состоянии удушья, угрожающем[М27] жизни больного;
- увлажненный кислород в тех случаях, когда у астматика есть признаки гипоксемии.
Для начала необходимо устранить воздействие аллергена на дыхательные пути ребенка. Терапия астмы у детей (как и у других категорий больных) состоит из базисной терапии и препаратов для купирования приступа.
У детей возникают сложности с применением ингалятора, предпочтительнее использовать спейсер, который является промежуточной емкостью для аэрозоля. Для ингаляций также используют небулайзер.
Для базисной терапии назначают антигистаминные средства и стабилизаторы клеточных мембран. В тяжелых случаях применяют гормональную терапию.
Немедикаментозная терапия бронхиальной астмы по стандартам лечения включает применение ЛФК, массажа, физиопроцедур и санаторно-курортное лечение.
Методы лечения подбираются индивидуально для каждого пациента. Одним из современных методов лечения астмы является аллерген-специфическая иммунотерапия, целью которой является снижение чувствительности организма к определенному аллергену.
Все меры профилактики делятся на те, что направлены на предупреждение развития заболевания и те, что могут замедлить прогрессирование болезни.
Меры первичной профилактики в обязательном порядке должны принимать курильщики, люди с наследственной предрасположенностью к астме и те, кто работает во вредных условиях. Они должны соблюдать все правила гигиены, своевременно лечить заболевания дыхательной системы, исключить контакт с аллергенами и вести здоровый образ жизни.
Профилактика приступов у астматиков включает одновременно лечение и мероприятия по предупреждению обострений.
Исключается действие аллергена, обязателен постоянный прием препаратов, назначенных врачом в соответствии со степенью тяжести астмы. Нельзя самостоятельно отменять препарат или увеличивать дозировку, так как это может привести к нарастанию симптомов.
Медицинская сестра в соответствии с назначением врача должна обучить пациента ежедневно контролировать параметры внешнего дыхания, используя пикфлоуметр в домашних условиях.
Если это возможно, то каждый день нужно выделять время для небольших физических нагрузок.
Астма – это патология, которую при правильном подходе к лечению в соответствии с современными стандартами можно полностью контролировать. Лечение бронхиальной астмы должен назначать специалист.
При этом учитывается степень тяжести заболевания, индивидуальные особенности пациента. В лечении важно наблюдать за реакцией организма на назначаемые препараты.
При обострениях очень важно вовремя принять меры, при необходимости госпитализировать пациента для предотвращения развития осложнений и астматического статуса.
источник
Современные методы лечения бронхиальной астмы
Стандарты лечения бронхиальной астмы
Протоколы лечения бронхиальной астмы
Профиль: терапевтический.
Этап: поликлинический.
Цель этапа: купирование приступов удушья, обострения болезни.
Длительность лечения: 7-10 дней.
Коды МКБ:
J45- Астма
J45.0- Астма с преобладанием аллергического компонента
J45.1- Неаллергическая астма
J45.8 — Смешанная астма
J45.9 — Астма неуточненная
J46 — Астматический статус.
Определение: Бронхиальная астма (БА) — хроническое заболевание дыхательных путей, основным патогенетическим механизмом которого является гиперреактивность бронхов, обусловленная воспалением, а основным клиническим проявлением — приступы удушья (преимущественно экспираторного характера) вследствие бронхоспазма, гиперсекреции и отека слизистой оболочки бронхов. Приступы удушья, а также характерные для БА кашель, чувство «заложенности» в груди, эпизоды свистящих дистанционных хрипов возникают преимущественно в ночные или утренние часы и сопровождаются частично или полностью обратимой (спонтанно или вследствие лечения) бронхиальной обструкцией.
Классификация:
Классификация астмы основывается на совместной оценке симптомов клинической картины и показателей функции легких:
1. По этиологии: атопическая (экзогенная); неатопическая (эндогенная); смешанная.
2. По тяжести заболевания различают:
— ступень I (легкая интермиттирующая): количество симптомов днем
80% нормы, разброс показателей ПСВ менее 20%.
— ступень II (легкая персистирующая); количество симптомов днем > 1 раза в неделю, но 2 раз в месяц; ОФВ1 или ПСВ > 80% нормы, разброс показателей ПСВ 20%-30%.
— ступень III (персистирующая, средней тяжести); симптомы ежедневно, приступы нарушают активность; ночные симптомы > 1 раза в неделю; ОФВ1 или ПСВ — 60- 80% нормы, разброс показателей ПСВ > 30%.
— ступень IV (тяжелая персистирующая): симптомы постоянные, ограничена физическая
активность; ночные симптомы частые; ОФВ 1 или ПСВ 30%.
3. По фазе течения: обострение, нестабильная ремиссия, ремиссия, стабильная ремиссия (более 2 лет).
Факторы риска: аллергены клещей, домашней пыли (такие мелкие, что невидимы невооруженным глазом), курение табака (курит ли сам пациент или он вдыхает дым, когда курят другие), аллергены животных, покрытых шерстью, аллергены тараканов, пыльца и плесневые грибы вне помещений, плесневые грибы внутри помещений, физическая активность, лекарства.
Критерии диагностики: В анамнезе любое из следующих проявлений:
кашель, особенно ночью; повторяющиеся хрипы; повторяющееся затрудненное дыхание; повторяющееся чувство сдавления грудной клетки; симптомы возникают или ухудшаются ночью; симптомы становятся тяжелее при контакте с триггерами; важным клиническим маркером бронхиальной астмы является исчезновение симптомов спонтанно или после применения бронходилататоров и противовоспалительных препаратов. Наличие атопических заболеваний у больного или его родственников.
Обратимое или изменяющееся снижение проходимости дыхательных путей по показаниям спирометра (ОФВ 1 или ФЖЕЛ) или пикфлоуметра (пиковая скорость выдоха — ПСВ).
При использовании пикфлоуметра можно подумать об астме, если:
— ПСВ увеличивается более чем на 15% через 15-20 минут после вдыхания быстродействующих b2-агонистов, или
— ПСВ, измеренная вечером, отличается более чем на 20% от утренних значений у пациентов, принимающих бронходилятаторы и более чем на 10% у пациентов, не принимающих бронходилятаторы, или
— ПСВ снижается более чем на 15% после 6 минут непрерывного бега или физической нагрузки.
В ОАК может быть выявлена эозинофилия.
В ОАМ возможно выявление незначительной протеинурии или нет изменений.
Для дифференциальной диагностики: рентгенография грудной клетки (отсутствие изменения легочной ткани).
Термометрия. При стойком и длительном повышении температуры тела исследование гемокультуры на бактериемию на высоте лихорадки с определением чувствительности флоры к антибиотикам.
Перечень основных диагностических мероприятий:
1. Общий анализ крови
2. Общий анализ мочи
3. Микрореакция
4. Общий анализ мокроты
5. Флюорография
6. Исследование функций внешнего дыхания Перечень дополнительных диагностических мероприятий:
1. Рентгенография органов грудной клетки
2. Консультация пульмонолога
3. Консультация стоматолога
4. Консультация отоларинголога
5. Кожные пробы
6. Провокационные пробы
7. Цитология мокроты, исследование мокроты на БК
8. Анализ чувствительности микробов к антибиотикам
9. Проведение аллергопроб
10. Исследование внешнего дыхания с бронхолитиком и/или бронхопровокатором.
Тактика лечения: Исключить контакт с причинным аллергеном, влияния неспецифических раздражителей (курения, профессиональной вредности, поллютантов, резких запахов и др.).
Купирование приступов: ингаляционные b2-агонисты быстрого действия (сальбутамол, фенотерол); b2-агонисты длительного действия с быстрым началом действия (сальметерол, формотерол); ингаляционные холинолитики (ипратропия бромид); комбинированные ЛС, включающие холинолитики и b2-агонисты; метилксантины короткого действия (аминофиллин); системные ГКС (преднизолон).
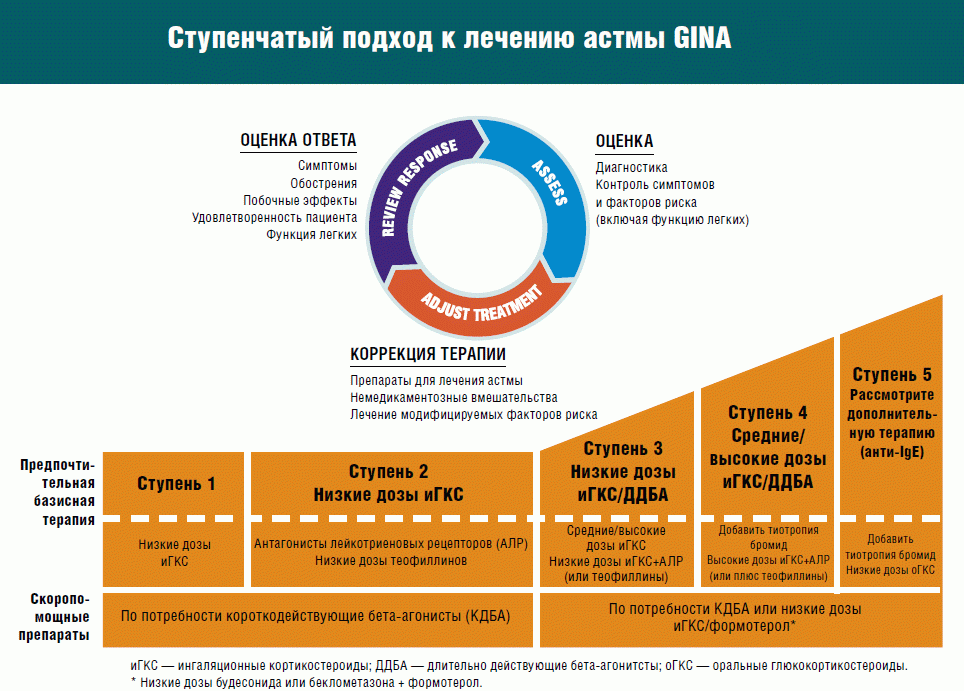
Для длительного ведения астмы рекомендуется ступенчатый подход в зависимости от степени тяжести.
Для всех уровней: дополнительно к регулярной ежедневной терапии, при необходимости должны применяться ингаляционные b2-агонисты быстрого действия, но не чаще 3-4 раз в день, фиксированная комбинация фенотерола и ипротропия бромида.
Ступень I — ежедневного приема для контроля заболевания не требуется. Рекомендуется назначать бронходилататоры короткого действия по потребности не более 1-2 раза в сутки.
Ступень II — Ингаляционный ГКС: беклометазон дипропионат 200-500 мкг в 1-2 приема, флутиказона пропионат 120 доз (100-200 мкг 2 раза в сутки), будесонид 100-250 мкг/сут.
Альтернативное лечение: назначение пролонгированных препаратов теофиллина (теотард, теопэк 200-400 мг/сутки), кромонов (ингаляции кромоглициевой кислоты 10 мг 4 раза в сутки или интал 5 мг/доза), блокаторов лейкотриеновых рецепторов (зафирлукаст 20 мг 2 раза в день). Бронходилататоры короткого действия (сальбутамол, фенотерол) по потребности не более 3-4 раз в сутки.
Ступень III — Ингаляционный ГКС: беклометазон дипропионат (800-1600 мкг в 3-4 приема) флутиказона пропионат 120 доз (400-1000 мкг 3-4 раза в сутки), Будесонид 800-1600 мкг/сут или. или ИГКС в стандартной дозе в сочетании с агонистами b2 -адренорецепторов длительного действия (сальметерол по 50 мкг 2 раза в день или формотерол по 12 мкг 2 раза в день), фиксированная комбинация фенотерола и ипротропия бромида либо с пролонгированным препаратом теофиллина. Бронходилататоры короткого действия (сальбутамол, фенотерол) по потребности, но не более 3-4 раз в сутки. Альтернативное лечение: назначение пролонгированных препаратов теофиллина (200-700 мг/сутки), кромонов (ингаляции кромоглициевой кислоты 20 мг 4-8 раз в сутки или интал 5 мг/доза), блокаторов лейкотриеновых рецепторов (зафирлукаст 20 мг 2 раза в день).
Ступень IV — Ингаляционный ГКС: беклометазон дипропионат 100 мкг — 10 доз (более 1000 мкг) в сутки флутиказона пропионат по 100-200 мкг 3-4 раза в сутки, будесонид более 800 мкг/сут, или эквивалент плюс ингаляционный b2-агонист длительного действия (сальметерол, формотерол), фиксированная комбинация фенотерола и ипротропия бромида; плюс один или более из следующих препаратов, если это необходимо: теофиллин замедленного высвобождения, антилейкотриеновый препарат, пероральный b2_агонист длительного действия, пероральный ГКС.
При наличии гнойной мокроты, высоком лейкоцитозе, ускоренном СОЭ назначают курс антибактериальной терапии учетом антибиотикограмм (спирамицин 3000 000 ЕД х 2 раза, 5-7 дней, амоксициллин+клавулановая кислота 625 мг х 2 раза, 7 дней, кларитромицин 250 мг х 2раза, 5-7 дней, цефтриаксон 1,0 х 1 раз, 5 дней).
Больным с вязкой мокротой назначают муколитики (амброксол, карбоцистеин, ацетилцистеин).
Перечень основных медикаментов:
1. Бекламетазон аэрозоль 200 доз
2. Ипратропия бромид аэрозоль 100 доз
3. Кромоглициевая кислота аэрозоль дозированный 5 мг; капсула 20 мг
4. Сальбутамол аэрозоль 100 мкг/доза; капсула 2 мг, 8 мг; раствор для небулайзера 20 мл
5. Теофиллин таблетка 100 мг, 200 мг, 300 мг; капсула 100 мг; 200 мг; 300 мг; капсула ретард 350 мг
6. Фенотерол аэрозоль 200 доз
7. Амброксол таблетка 30 мг; сироп 30 мг/5 мл
8. Преднизолон, таблетка 5 мг; раствор для инъекций 30мг/1 мл
9. Буденосид 100 мг, аэрозоль
10. Ипратропия бромид 21 мкг+фенотерола гидробромид 50 мкг.
Перечень дополнительных медикаментов:
1. Флютиказон аэрозоль 60 доз, 120 доз (или их комбинация: салметерол, флютиказона пропионат, 25/50 мкг; 25/250 мкг)
2. Кларитромицин 500 мг, табл.
3. Спирамицин 3 млн. ЕД, табл.
4. Аминофиллин раствор для инъекций 2,4% в ампуле 5 мл, 10 мл
5. Салметерол аэрозоль для ингаляции 25 мкг/доза
6. Амоксициллин+клавулановая кислота 625 мг
7. Азитромицин 500 мг.
Критерии перевода на следующий этап лечения: неэффективность бронхолитической терапии, некупируемые приступы удушья в течение 6-8 часов, нарастание дыхательной недостаточности, «немое легкое».
источник
27–28 марта в Виннице состоялась IX научно-практическая конференция «Актуальные проблемы терапии», участниками которой стали представители лечебно-профилактических учреждений Украины. Работу конференции возглавил заведующий кафедрой пропедевтики внутренних заболеваний Винницкого государственного медицинского университета им. Н.И. Пирогова, доктор медицинских наук, профессор Юрий Мостовой, с докладами выступили ведущие ученые нашей страны в области терапии, кардиологии и пульмонологии. Среди них — главный пульмонолог и главный фтизиатр МЗ Украины, директор Института фтизиатрии и пульмонологии им. Ф.Г. Яновского АМН Украины, академик АМН Украины, доктор медицинских наук, профессор Юрий Фещенко, заведующий отделом симптоматических гипертензий Института кардиологии им. Н.Д. Стражеско АМН Украины, доктор медицинских наук, профессор Юрий Сиренко, заместитель директора по научной работе Института кардиологии им. Н.Д. Стражеско АМН Украины, доктор медицинских наук, профессор Михаил Лутай, член-корреспондент АМН Украины, доктор медицинских наук, профессор Екатерина Амосова и др. Генеральным спонсором форума выступила компания «GlaxoSmithKline».
Докладчики осветили вопросы диагностики и лечения артериальной гипертензии, ишемической болезни сердца, хронической сердечной недостаточности, пневмонии и т.д. Однако главным событием стала презентация недавно зарегистрированного в Украине нового комбинированного препарата, предназначенного для эффективного контроля бронхиальной астмы, — СЕРЕТИДА (салметерол + флутиказон). Этот препарат уже прочно вошел в мировую клиническую практику как «золотой стандарт» в лечении бронхиальной астмы. Клиническая эффективность и преимущество СЕРЕТИДА перед другими ингаляционными лекарственными средствами, применяемыми в фармакотерапии бронхиальной астмы, обоснованы с позиций доказательной медицины (Barnes P.J. Scientific rationale for inhaled combination therapy with long-acting
b 2-agonists and corticosteroids // Eur. Respir. J. — 2002. — Vol. 19. — P. 182 – 191).
ЧТО ТАКОЕ БРОНХИАЛЬНАЯ АСТМА?
В президиуме научно-практической конференции «Актуальные проблемы терапии» (слева – направо): заведующий кафедрой пропедевтики внутренних заболеваний Винницкого государственного медицинского университета им. Н.И. Пирогова, доктор медицинских наук, профессор Юрий Мостовой, главный пульмонолог и главный фтизиатр МЗ Украины, директор Института фтизиатрии и пульмонологии им. Ф.Г. Яновского АМН Украины, академик АМН Украины, доктор медицинских наук, профессор Юрий Фещенко, кандидат медицинских наук, доцент кафедры внутренних болезней № 1 Донецкого государственного медицинского университета Надежда Моногарова, продакт-менеджер представительства компании «GlaxoSmithKline» в Украине, кандидат медицинских наук Борис Венгеров.
Бронхиальная астма (БА) — распространенное заболевание, которое приводит к существенному ухудшению качества жизни. В настоящее время в Украине имеет место гиподиагностика данного заболевания, в связи с чем проблема дальнейшего совершенствования выявления БА становится особенно актуальной. 30 декабря 1999 г. Министерством здравоохранения Украины был издан приказ № 311 «Про затвердження інструкцій щодо надання фтизіопульмонологічної допомоги хворим», в основе которого лежит Соглашение (Консенсус) ведущих пульмонологов нашей страны о едином подходе к классификации, определению, диагностике и лечению БА, хронического обструктивного бронхита, пневмонии и туберкулеза. Консенсус был принят на II съезде фтизиатров и пульмонологов Украины, который состоялся в октябре 1998 г. в Киеве. В Приказе № 311 Министерства здравоохранения Украины дано определение, согласно которому БА — это хроническое воспалительное заболевание дыхательных путей, характеризующееся обратимой бронхообструкцией и гиперреактивностью бронхов, проявляющейся повышенной чувствительностью к воздействию различных раздражающих стимулов.
Ю. Фещенко отметил, что определение БА, утвержденное Минздравом Украины, принципиально не отличается от такового, содержащегося в международном Консенсусе по БА. Исходя из определения БА, можно сделать вывод: без купирования воспалительного процесса в бронхах невозможно добиться улучшения клинической картины заболевания, а именно уменьшения гиперреактивности бронхов и бронхообструкции. Поскольку в основе БА лежит специфическая воспалительная реакция с участием эозинофильных гранулоцитов и тучных клеток, фармакотерапевтическая тактика должна включать адекватное воздействие и на специфический воспалительный процесс, и на бронхообструкцию как во время приступов, так и в период между ними.
Необходимо отметить, что воспалительный процесс при БА существенно отличается от такового при хронических обструктивных заболеваниях легких (ХОЗЛ). Если при БА в воспалительный процесс вовлечены эозинофильные гранулоциты и тучные клетки, то при ХОЗЛ — главным образом нейтрофильные гранулоциты. Поэтому подход к лечению БА и ХОЗЛ существенно отличаются. Правда, приступы затрудненного дыхания при указанных заболеваниях сходны, в связи с чем нередко возникает необходимость дифференциальной диагностики этих заболеваний. В случае сочетания БА и ХОЗЛ диагностика еще более усложняется.
К сожалению, в Украине эпидемиологические исследования заболеваемости БА не проводятся. Данные, полученные в ходе исследования, проводившегося в 1982 г., являются последними достоверными сведениями о распространенности и заболеваемости неспецифическими заболеваниями легких, включая БА. Ю. Фещенко подчеркнул, что с 1982 г. за истекший период изменились представление о патогенезе, классификация, подходы к диагностике и лечению этого заболевания, и было неправильным экстраполировать полученные в 1982 г. данные на 2002 г. В настоящее время заболеваемость БА в Украине оценивается практически исключительно по количеству обращения пациентов в лечебно-профилактические учреждения. Однако такую методологию оценки заболеваемости БА вряд ли можно признать объективной, так как в этом случае важную роль играют субъективные факторы (не все пациенты обращаются к врачу по поводу данного заболевания, нередки случаи гиподиагностики БА, не все врачи правильно составляют отчет о вновь выявленном заболевании и т.д.). В нашей стране заболеваемость БА в общей структуре населения составляет 0,3–0,5%, что не соответствует действительности, тогда как в экономически развитых странах этот показатель на порядок выше — 3,7–12%. Хотя, безусловно, существуют определенные географические и популяционные отличия.
Ю. Фещенко сообщил о результатах исследований, которые были проведены по заданию ряда зарубежных фармацевтических компаний. Ученым удалось оценить реальную ситуацию с заболеваемостью БА в Украине. В ходе исследования (2000) было опрошено около 4,5 тыс. семей. У каждого 25-го опрошенного была диагностирована БА. Следовательно, заболеваемость БА составляет не 0,3–0,5% согласно официальным статистическим данным, а 4%. Эта цифра более соответствует действительности. Возможно, при более глубоком исследовании окажется, что заболеваемость БА в Украине составляет около 6,5–7%. Для сравнения: практически у каждого 8-го жителя Польши, нашего ближайшего соседа, выявлена БА; значительная распространенность БА отмечается в Словении, Венгрии и некоторых других странах.
Стоимость лечения БА является важным социальным фактором. Так, в Швеции на лечение одного больного ежегодно выделяют 1315 долл. США (всех больных — 348 млн долл. США); в США — 640 долл. США (6,4 млрд долл. США); в Великобритании — 520 долл. США (1,79 млрд долл. США); в Австралии — 326 долл. США (500 млн долл. США). В Украине расходы в связи с 1 госпитализацией одного больного БА (средняя продолжительность — 14 дней) составляют около 700 грн. Как отметил Ю. Фещенко, для Украины это довольно значительные средства, однако, используются они нерационально. В подавляющем большинстве случаев госпитализации в связи с обострением БА можно было бы избежать, если бы пациенту была назначена рациональная схема фармакотерапии в период между приступами заболевания. Более целесообразно было бы вложить указанные средства в приобретение современных препаратов для лечения БА в период между приступами заболевания. Это позволило бы существенно улучшить контроль клинического течения БА, сохранить трудоспособность и обеспечить надлежащее качество жизни больного, а также избежать госпитализации.
КАК СЕЙЧАС ЛЕЧАТ БРОНХИАЛЬНУЮ АСТМУ В НАШЕЙ СТРАНЕ?
Как сообщил Ю. Фещенко, 62% больных БА находятся под наблюдением врачей общей практики (участковых терапевтов и педиатров), около 16% — под наблюдением врачей-пульмонологов, 12% — врачей-аллергологов. Возникает вопрос: как осуществляется контроль БА у пациентов? Какое лечение в настоящее время получают пациенты с этим тяжелым недугом?
Прежде чем ответить на эти вопросы, необходимо принять во внимание следующее. В Украине отмечена высокая частота госпитализации по поводу обострения БА. Почти каждого 3-го больного в течение года госпитализируют в терапевтическое или пульмонологическое отделение стационара. В Европе это самый высокий показатель госпитализации по поводу обострения БА. Причиной этого является нерациональное лечение пациентов с данным заболеванием и, следовательно, недостаточный контроль БА. В странах Центральной Европы госпитализация больных по поводу обострения БА является казуистикой.
Ю. Фещенко особо подчеркнул, что БА в период обострения хорошо поддается рациональной фармакотерапии, проводимой в амбулаторных условиях. Показанием к госпитализации может быть лишь наличие серьезного сопутствующего заболевания — сахарного диабета, почечной недостаточности, пептической язвы желудка и двенадцатиперстной кишки и т.п. Таким образом, высокий процент госпитализации пациентов с БА в Украине свидетельствует о том, что им уделяется недостаточное внимание со стороны врачей, а также о том, что больным назначают неэффективные схемы лечения, включающие в подавляющем большинстве случаев симптоматические средства. Между тем рациональное использование эффективных патогенетических лекарственных средств (ингаляционных кортикостероидов) наряду с симптоматическими в 99% случаев позволяет избежать госпитализации.
Недостаточное понимание патогенеза БА и неосведомленность в результатах масштабных рандомизированных клинических исследований приводят к необоснованным заявлениям о том, что использование ингаляционных кортикостероидов при БА не оказывает желаемого эффекта. Однако истинная причина не в том, что ингаляционные кортикостероиды являются неэффективными, а в том, что нерациональное использование создает мнимое впечатление об их неэффективности. Между тем ведущие специалисты в области диагностики и лечения БА относят ингаляционные кортикостероиды к базисным препаратам для лечения этого заболевания.
КАК НЕОБХОДИМО ЛЕЧИТЬ БРОНХИАЛЬНУЮ АСТМУ
Согласно Консенсусу, принятому на II съезде фтизиатров и пульмонологов Украины, а также аналогичным официальным документам Европейского респираторного общества и Американской торакальной ассоциации, только при интермиттирующем течении БА в период обострения заболевание сопровождается воспалительной реакцией со стороны бронхов, которая в период между приступами может отсутствовать. Для персистирующей БА (с легким, средней тяжести и тяжелым течением) в период между обострениями заболевания характерно постоянное наличие воспалительной реакции со стороны бронхов. В общей структуре течения БА интермиттирующее течение отмечено в 28%, легкое персистирующее в 25%, средней тяжести в 31%, тяжелое в 16% случаев. Поэтому необходим индивидуальный подход к диагностике и лечению больных БА.
Как лечить пациентов с БА? В упомянутом выше Приказе Министерства здравоохранения № 311 от 30 декабря 1999 г. приводится современная схема лечения больных БА в зависимости от стадии и течения заболевания. При интермиттирующем течении заболевания рекомендуется применение в основном b 2-агонистов короткого действия. К этой группе препаратов относится хорошо зарекомендовавший себя в клинической практике Вентолин (сальбутамол). При второй стадии заболевания (персистирующая легкая) в целях проведения противовоспалительной терапии рекомендуется раннее назначение ингаляционных кортикостероидов. Как подчеркнул Ю. Фещенко, альтернативы проведению ингаляционной корикостероидной терапии на сегодняшний день не существует.
ИНГАЛЯЦИОННЫЕ КОРТИКОСТЕРОИДЫ
Мнение о том, что кортикостероидные препараты необходимо применять лишь на поздних стадиях заболевания и в невысоких дозах является несостоятельным. Ингаляционные кортикостероиды обладают выраженным противовоспалительным эффектом. Благодаря низкой биодоступности современных ингаляционных кортикостероидов они практически не оказывают системного действия. Начинать терапию ингаляционными кортикостероидами необходимо с максимально высоких индивидуально-подобранных доз, а затем в зависимости от клинического течения заболевания снижать дозу до поддерживающей.
В перерыве участники форума обсуждают пути внедрения СЕРЕТИДА в отечественную клиническую практику
В клинике острых состояний при БА используют системные кортикостероиды в форме таблеток и раствора для инъекций. В некоторых случаях наиболее рационально начинать фармакотерапию с назначения инъекционных форм кортикостероидов, а затем в течение короткого периода перейти на использование ингаляционных препаратов. Необходимо учесть, что при использовании ингаляционных кортикостероидов клинический эффект не проявляется мгновенно. Для достижения клинического эффекта необходимо 4–7, а иногда 10 дней. При этом препараты воздействуют на воспалительный очаг локально, не абсорбируясь в кровь. С помощью кортикостероидов в течение короткого времени можно устранить обострение, значительно ослабить выраженность хронического воспалительного процесса.
Ингаляционные кортикостероиды являются препаратами высокой степени безопасности. У лиц, принимавших ингаляционные кортикостероиды, практически не отмечено развития кушингоидного синдрома. В течение 18 лет лишь у нескольких женщин, принимавших ингаляционные кортикостероиды, зафиксировано развитие остеопороза. Между тем остается недоказанным, что именно ингаляционные кортикостероиды являются причиной развития остеопороза.
Назначение кортикостероидов больным БА еще 20 лет назад звучало как приговор. Сегодня же, основываясь на принципах доказательной медицины, подтверждена высокая эффективность ингаляционных кортикостероидов на всех стадиях персистирующей БА.
В Украине для лечения БА в 57% случаев используют симптоматические препараты и только в 4% случаев — противовоспалительные. Хотя справедливости ради нужно отметить, что в последнее время наметилась положительная тенденция к более широкому назначению ингаляционных кортикостероидов. К тому же фармацевтический рынок страны насыщен ингаляционными кортикостероидами.
Исходя из вышеизложенного, нет причин не назначить больным с персистирующей БА ингаляционные кортикостероиды. В этом отношении представляет интерес опыт Литвы, где распространенность БА, а также количество средств, выделяемых государством для лечения этого заболевания, приблизительно соответствуют таковым в Украине. Однако в Литве основными лекарственными средствами, применяемыми для лечения БА, являются ингаляционные кортикостероиды, в то время как в Украине — b 2-агонисты короткого действия.
Следует полагать, что высокий показатель смертности вследствие БА, который сегодня в Украине составляет 3 на 100 тыс. населения, в значительной степени обусловлен неоправданной фармакотерапевтической тактикой лечения этого заболевания.
b 2—АГОНИСТЫ ПРОЛОНГИРОВАННОГО ДЕЙСТВИЯ
В последние годы разработаны b 2-агонисты пролонгированного действия, одним из представителей которых является Серевент (салметерол). Как отметил Ю. Фещенко, в настоящее время этот препарат используют недостаточно. Некоторые сетуют на его высокую стоимость. Между тем общепризнанным является тот факт, что высокоэффективное, безопасное и качественное лекарственное средство, выпускаемое в удобной для применения лекарственной форме, хотя и стоит недешево, однако характеризуется высокой комплаентностью. Украина, вероятно, является одной из немногих европейских стран, которые для лечения БА все еще используют орципреналин (неселективный агонист b -адренорецепторов). Однако этот метод уже давно устарел. Необходимо помнить о том, что в результате передозировки орципреналина может наступить внезапная смерть вследствие остановки сердца. Этот факт стал причиной запрета на применение орципреналина в клинической практике в экономически развитых странах.
КОМБИНИРОВАННАЯ ТЕРАПИЯ БРОНХИАЛЬНОЙ АСТМЫ. ПОЧЕМУ СЕРЕТИД?
Как отметила главный аллерголог Донецкой области Ольга Федорченко, основными базисными препаратами для лечения БА являются кортикостероиды. Поскольку БА сопровождается сужением просвета бронхов вследствие их гиперреактивности и воспаления, рациональное лечение заболевания должно включать применение b 2-агонистов пролонгированного действия и ингаляционных кортикостероидов. Учитывая, что наилучшие клинические результаты были получены при совместном применении Фликсотида (флутиказон) и пролонгированного агониста блокаторов b 2-адренорецепторов — Серевента (салметерол), было высказано предложение соединить эти два действующих вещества в одном препарате. В результате был создан препарат СЕРЕТИД, который оказался более эффективным по сравнению с известными препаратами, предназначенными для ингаляционного применения при БА (Barnes P.J. Scientific rationale for inhaled combination therapy with long-acting b 2-agonists and corticosteroids // Eur. Respir. J. — 2002. — Vol. 19.— P. 182 – 191).
ДОКАЗАТЕЛЬСТВА СИНЕРГИЗМА ФЛУТИКАЗОНА И САЛМЕТЕРОЛА
В основе высокой клинической эффективности СЕРЕТИДА лежит взаимодействие кортикостероида и b 2-агониста на клеточном уровне за счет общих механизмов сигнальной трансдукции. b 2-Агонисты расслабляют гладкую мускулатуру дыхательных путей, препятствуют освобождению медиаторов воспаления из тучных клеток, экссудации плазмы крови и угнетают активацию сенсорных нервных окончаний, кортикостероиды подавляют провоспалительную активность Т-лимфоцитов, эозинофильных гранулоцитов, макрофагов и дендритных клеток, в результате чего уменьшаются выраженность воспалительного процесса и гиперреактивность бронхов. Для достижения оптимального контроля БА необходимо сочетать применение b 2-агонистов пролонгированного действия и ингаляционных кортикостероидов.
«Все, чего человечество стремилось достичь в лечении бронхиальной астмы, оно уже достигло. Поставленную перед учеными задачу создать лекарственные средства, эффективность которых можно было бы сравнить с таковой системных кортикостероидов, а риск побочных реакций которых был бы минимальным, в настоящее время можно считать выполненной. Появление ингаляционных кортикостероидов можно расценить как качественный скачок в медицине. Теперь перед учеными стоит новая задача: попытаться отделить на молекулярном уровне терапевтический эффект препарата от побочного. Решение этой задачи будет следующим принципиальным шагом вперед».
P.J. Barnes, профессор, руководитель отдела респираторной медицины Королевского колледжа (Великобритания), «The Financial Express» от 12 марта 2000 г.
Флутиказон, проникая через клеточную мембрану в неизмененном виде, соединяется со специальным глюкокортикоидным рецептором, который находится в цитоплазме клетки, превращая его из неактивной формы в активную. Комплекс флутиказон — рецептор проникает в ядро клетки и связывается с соответствующими участками ДНК (GRE, — Glucocortico >b 2-адренорецептора. Это обусловлено тем, что промотор данного гена содержит участки GRE, поэтому b 2-агонисты стимулируют транскрипцию информационной РНК b 2-адренорецептора. В итоге на поверхности мембраны клетки увеличивается количество упомянутых выше рецепторов и чувствительность клетки к воздействию салметерола повышается. Это имеет исключительно важное значение при подборе эффективной схемы терапии БА, так как в процессе длительного применения b 2-агонистов наступает десенситизация (снижение чувствительности) b 2-адренорецепторов с последующим снижением клинической эффективности вышеупомянутых лекарственных средств. Применение ингаляционных кортикостероидов способствует образованию новых b 2-адренорецепторов, в результате чего клиническая эффективность комбинированного приема салметерола и флутиказона с течением времени по крайней мере не уменьшается.
Кроме того, необходимо принять во внимание, что бронходилатирующий эффект b 2-агониста осуществляется через вторичный мессенджер — циклический аденозинмонофосфат (цАМФ), который образуется в результате взаимодействия комплекса b 2-агонист — b 2-адренорецептор с G-белком и АТФ. При воспалительном процессе происходит избыточное образование фермента G-протеин-рецепторной киназы (GRK-2), который вызывает отсоединение G-белка от лигандрецепторного комплекса. Образование цАМФ уменьшается, что проявляется снижением клинической эффективности b 2-агониста. Флутиказон, устраняя воспалительный процесс, обеспечивает снижение активности фермента GRK-2. Комплекс b 2-агонист — b 2-адренорецептор — G-белок оказывается более стойким, что обеспечивает надлежащий клинический эффект салметерола.
Салметерол наряду с бронхолитическим действием может усиливать действие кортикостероидов — повышать плотность кортикостероидных рецепторов в ядре, а также увеличивать сродство флутиказона к рецепторным участкам ДНК, что способствует усилению транскрипции генов, отвечающих за синтез противовоспалительных соединений.
Салметерол усиливает способность флутиказона подавлять индуцированное аллергеном образование интерлейкинов в периферических мононуклеарах, оказывающих провоспалительное действие. Кроме того, угнетается образование молекул межклеточной адгезии (ICAM-1) в фибробластах, которые играют важную роль в воспалительном процессе. Таким образом, одновременное применение флутиказона и салметерола оказывает синергическое противовоспалительное и бронхолитическое влияние при БА.
ДОКАЗАТЕЛЬНАЯ МЕДИЦИНА
Ольга Федорченко отметила, что почти половина больных БА, которые получают плацебо, выбывают из клинического исследования уже на 14-й день. Среди пациентов, которые принимали салметерол, число выбывших было меньше. В случае, когда флутиказон назначают в суточной дозе 250 мг, определенный процент больных БА все же выбывает из исследования вследствие резистентности к проводимому лечению. Только при использовании СЕРЕТИДA, практически все больные участвовали в клиническом исследовании вплоть до его завершения (продолжительность исследования — 84 дня).
Важным преимуществом СЕРЕТИДА является высокая комплаентность. Препарат принимают 1–2 раза в сутки. При этом терапевтический эффект развивается с 1-го дня и со временем не уменьшается. Применение СЕРЕТИДА позволяет назначать ингаляционные кортикостероиды в более низкой дозе. При необходимости концентрация флутиказона в одной дозе может варьировать от 100 до 500 мкг. Следует отметить, что СЕРЕТИД более эффективно, чем будезонид, устраняет симптомы воспаления в бронхах, а также способствует улучшению некоторых спирометрических показателей (например, FEV1). Кроме того, клиническая эффективность СЕРЕТИДА превышала таковую отдельно взятых флутиказона и салметерола.
Применяя СЕРЕТИД, в более чем 25% случаев удавалось добиться полного контроля симптомов БА уже в течение 5–12 нед. Используя Фликсотид, такого успеха можно добиться приблизительно в 10% случаев, а Серевент — еще у меньшего количества больных.
В настоящее время СЕРЕТИД признан «золотым стандартом» в терапии БА. Его применение обеспечивает снижение общей стоимости лечения, так как оптимальный контроль за течением БА устанавливается в более сжатые сроки по сравнению с другими препаратами. Кроме того, отпадает необходимость назначать ингаляционные кортикостероиды в высоких дозах, в результате чего также снижается общая стоимость курсовой терапии, что немаловажно при лечении детей с БА. При надлежащем использовании СЕРЕТИДА практически не возникает потребности в госпитализации. Высокая степень безопасности позволяет избежать отрицательного влияния на состояние здоровья пациента, а также дополнительных затрат, связанных с устранением побочных реакций.
В настоящее время активно развиваются новые технологии создания лекарственных средств с использованием передовых достижений фармакогеномики, фармакопротеомики и биотехнологии. Вместе с тем представляется маловероятным, что в недалеком будущем появятся более эффективные, чем b 2-агонисты и ингаляционные кортикостероиды, препараты. Для большинства инновационных молекул характерен более узкий спектр действия по сравнению с вышеупомянутыми классами лекарственных препаратов. Поэтому они воздействуют на меньшее количество звеньев патологического процесса при БА, а следовательно, менее эффективны. Антилейкотриеновые средства, например, блокируют только один из многих провоспалительных медиаторов, вследствие чего его применение при БА является неэффективным. Моноклональные антитела к провоспалительным интерлейкинам, которые входят в состав препарата меполизумаба, эффективно снижают содержание эозинофильных гранулоцитов в дыхательных путях, однако не влияют на другие звенья воспалительного процесса, что также не позволяет его применять для лечения данного заболевания. Этот ряд можно было бы продолжить. К тому же инновационные препараты, созданные с помощью биотехнологических методов, являются дорогостоящими. Конечно, это не исключает возможности разработки новых эффективных препаратов для лечения БА в более отдаленной перспективе. Тем не менее, как считает P.J. Вarnes (2002), поступление на фармацевтический рынок альтернативного ингаляционным кортикостероидам лекарственного средства в ближайшие 10–15 лет не предвидится.
Учитывая тот факт, что на разработку инновационного препарата и его запуск на фармацевтический рынок уходит в среднем, 15 лет, вряд ли следует ожидать в ближайшем будущем появления более нового эффективного средства для лечения БА. Радует то, что на украинском фармацевтическом рынке уже появился препарат СЕРЕТИД — «золотой стандарт» в лечении и осуществлении оптимального контроля течения данного заболевания. Научно-практическая конференция в Виннице показала, что врачи готовы использовать СЕРЕТИД в клинической практике, назначая их своим пациентам.
Виктор Маргитич
Фото Евгения Кривши
1. Chapman K.R. Seretide for obstructive lung disease // Expert. Opin. Pharmacother. — 2002. — Vol. 3 (3). — P. 341-350.
2. Abbott M.B., Levin R.H. What’s new: newly approved drugs for children // Pediatr. Rev. — 2001 — Vol. 22 (10). — P. 357-359.
3. Nelson H.S. Advair (Seretide): combination treatment with fluticasone propionate / salmeterol in the treatment of asthma // J. Allergy Clin. Immunol. — 2001. — Vol. 107 (2). — P. 398-416.
4. Palmqvist M., Arvidsson P., Beckman O., Peterson S., Lotvall J. Onset of bronchodilation of budesonide / formoterol vs. salmeterol / fluticasone in single inhalers // Pulm. Pharmacol. Ther. — 2001. — Vol. 14 (1). — P. 29-34.
источник
Бронхиальная астма (БА) – это хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы.

БА относится к числу наиболее распространенных заболеваний человека (5-8% случаев в общей популяции). На сегодня в мире от этого заболевания страдают около 300 млн человек, причем у подавляющего большинства пациентов оно не контролируется.
Распространенность БА чрезвычайно варьирует между странами и регионами, составляя, по данным опросника обследования респираторного здоровья Европейского Сообщества (European Community Respiratory Health Survey – EСRHS, Приложение), в различных популяциях от 2 до 25,5% [3, 15, 29]. Данный показатель зависит от ряда факторов: интенсивности экспозиции аллергенов, загрязнения окружающей среды, изменения рациона, иммунной реактивности и генетических особенностей человека.
Статистика свидетельствует, что во многих странах мира сохраняется тенденция к росту заболеваемости, инвалидности и смертности, обусловленных БА [4]. Так, в Великобритании за последние 20 лет смертность от БА увеличилась в 7 раз, в странах Европы и Северной Америки – в 2-3 раза, в России (Санкт-Петербург) в 80-90-е гг. ХХ в. – в 2 раза [10]. В США ежегодно от БА погибают более 5 000 человек, и летальность продолжает расти. Повысилась также частота обращений за экстренной медицинской помощью: с 58,8 на 10 000 населения США в 1992 г. до 70,7 на 10 000 в 1995 г. Прямые и непрямые расходы на оказание помощи больным с обострением астмы в США составляют 2 млрд долларов в год [31].
По официальным данным, распространенность БА в России составляет менее 1%, тогда как в ряде исследований, выполненных в соответствии с рекомендациями Европейского общества пульмонологов, этот показатель составляет 5% среди взрослого населения и более 7% среди детей, что в абсолютных цифрах составляет около 7 млн больных [5].
Официальная статистика в Украине отражает приблизительно каждого 20-го больного БА. Считается, что в Украине БА болеют 5% населения, т. е. 2,3 млн человек. С учетом современных стандартов и цен на соответствующие лекарственные средства, минимальная годовая стоимость жизненно важных препаратов, которые пациенты должны принимать, составляет 2 400 грн. на одного больного или 12 700 млн грн. на всех больных БА [16].
Патогенез БА. Согласно современной концепции, в основе патогенеза БА, вне зависимости от степени тяжести заболевания, лежит хронический специфический воспалительный процесс в стенке бронхов, приводящий к спазму, отеку слизистой оболочки, гиперсекреции слизи и бронхиальной обструкции в ответ на воздействие различных триггеров. Для воспаления при БА характерно увеличение в слизистой оболочке и просвете бронхиального дерева количества активированных эозинофилов, тучных клеток, макрофагов, лимфоцитов и нейтрофилов, а также дендритных клеток и тромбоцитов. Таким образом, формирование хронического воспалительного процесса в дыхательных путях при БА происходит с участием различных клеток, которые выделяют большое количество биологически активных веществ, вызывающих развитие и персистенцию воспаления.
Признаки воспаления бронхов сохраняются даже в бессимптомный период заболевания. Воспаление приводит к гиперреактивности бронхов, т. е. к уменьшению их просвета вследствие неадекватного мощного спазма в ответ на воздействие триггеров. Острый бронхоспазм, отек стенки бронха и обтурация слизью вызывают развитие обструкции (обычно полностью обратимой). Клинически эти изменения проявляются повторяющимися эпизодами – приступами обструкции бронхов в виде одышки, чувства стеснения в груди, кашля, свистящих хрипов в легких, нередко слышных на расстоянии [8, 14].
Таким образом, патогенетически БА – двухкомпонентное заболевание, обусловленное воспалением дыхательных путей (отек, повреждение эпителия, инфильтрация, утолщение базальной мембраны) и дисфункцией дыхательных мышц (бронхоконстрикция, гиперреактивность бронхов).
Результатом острого и хронического аллергического воспаления в дыхательных путях являются структурные и функциональные нарушения, характерные для БА. Структурные изменения в дыхательных путях, называемые ремоделированием, – это гетерогенный процесс, приводящий к изменениям в соединительной ткани и нарушению структуры дыхательных путей вследствие динамического процесса дифференциации, миграции, развития и созревания структурных клеток.
Ремоделирование характеризуется увеличением массы гладких мышц, застоем в сосудистом русле и гипертрофией слизистых желез, что приводит к утолщению стенки и уменьшению диаметра просвета бронхов, а также повышением секреции слизи и воспалительного экссудата. Увеличение массы гладких мышц при астме происходит за счет гипертрофии и гиперплазии мышечных волокон либо дифференциации этих мышц. Другим важным компонентом утолщения стенок является застой в сосудах, который также приводит к уменьшению диаметра бронхов. Появление избыточной секреции слизи – результат не только гипертрофии слизистых желез, но и гиперплазии бокаловидных клеток. Повышенная продукция слизи вместе с воспалительным экссудатом формирует клейкие вязкие пробки, которые блокируют просвет бронхов.
Важно отметить, что при БА в легких одновременно определяются очаги острого и хронического воспаления, которые неравномерно распределены по бронхиальному дереву, включая самые мелкие бронхи (менее 2 мм в диаметре) и паренхиму.
Медикаментозная терапия БА. Современный уровень изучения патогенеза данного заболевания обусловил значительные изменения в подходах к медикаментозной терапии. Основной акцент делается на проведении противовоспалительной терапии.
Цели, которые должен ставить перед собой врач при лечении больного БА:
- достижение и поддержание контроля над симптомами заболевания;
- предотвращение обострений, потребности в оказании неотложной медицинской помощи и госпитализации;
- поддержание показателей функции внешнего дыхания на уровне, максимально близком к нормальному;
- устранение ограничений в физической активности пациентов, включая занятия физкультурой и спортом;
- сведение к минимуму побочных эффектов и нежелательных явлений от применения лекарственных средств при наименьшем эффективном объеме терапии;
- предотвращение формирования необратимой бронхиальной обструкции;
- предотвращение смертности от БА [4].
Лечение БА включает симптоматическую терапию для оказания экстренной помощи и профилактическое, или базисное, лечение, контролирующее течение БА.
Для экстренной помощи используются ингаляционные бронхолитики короткого действия (β2-агонисты и М-холинолитики), теофиллин (эуфиллин), системные глюкокортикостероиды (СГКС).
В настоящее время основой экстренной бронхолитической терапии являются β2-агонисты короткого действия, поскольку они позволяют быстро уменьшить бронхоспазм и выиграть время до того момента, когда начнут действовать противовоспалительные препараты [1, 30].
Важнейшим свойством β2-агонистов считается их селективность в отношении β2-адренорецепторов. Наибольшей селективностью обладают сальбутамол, фенотерол, тербуталин. Селективные β2-агонисты оказывают меньшее влияние на кардиальные β2-адренорецепторы, в результате чего устраняется риск возникновения побочных эффектов (тахикардии, аритмии, тремора, гипоксемии, гипокалиемии).
Хотя β2-агонисты являются высокоселективными препаратами и их эффективность в основном связана со стимуляцией β2-рецепторов бронхов, повышение дозы может приводить к нежелательным эффектам со стороны других органов и систем, где также локализуются β2-рецепторы (ишемии миокарда, тахикардии и другим нарушениям ритма вплоть до трепетания предсердий, удлинению интервала QТ на ЭКГ, что, в свою очередь, предрасполагает к развитию сердечной аритмии, тремору) [13]. Тремор чаще отмечается у больных пожилого и старческого возраста. Более редкими и менее выраженными осложнениями являются гипокалиемия, гипоксемия и раздражительность [14]. Пациентам с сахарным диабетом рекомендуется проводить дополнительный контроль гликемии. Указанные нежелательные эффекты встречаются достаточно редко, но могут появиться при передозировке β2-агонистов короткого и длительного действия [9]. Нежелательное действие сальбутамола и фенотерола обычно максимально выражено после 20-40 вдохов (по 100 мг) через дозированный ингалятор [19].
Поскольку бронхолитический эффект от применения β2-агонистов короткого действия наступает быстро, они являются препаратами экстренной помощи для устранения симптомов заболевания. Их рекомендуется использовать для купирования острых приступов БА, а также для профилактики астмы физического усилия и эпизодической атопической (аллергической) БА. Применяют их по одной ингаляции 1-4 раза в сутки. В случае тяжелого удушья больной может использовать до 5-7 доз сальбутамола с минимальным риском осложнений.
Также β2-агонисты короткого действия применяют для купирования или предупреждения эпизодов затрудненного дыхания, удушья или пароксизмального кашля у лиц пожилого возраста. При возникновении нежелательных эффектов (стимуляции сердечно-сосудистой системы, тремора скелетных мышц и т. д.) можно изменить их дозировку за счет комбинации с антихолинергическими препаратами, которые считаются альтернативными бронхолитиками для купирования приступов удушья у лиц пожилого возраста.
Метилксантины (теофиллин, эуфиллин) менее эффективны, чем ингаляционные β2-агонисты, и играют вспомогательную роль в купировании приступов БА. Их применяют либо парентерально (внутривенно вводят 5-10 мл 2,4% раствора эуфиллина), либо перорально (200-300 мг), но этот способ менее эффективен [14].
В связи с наличием выраженных побочных эффектов (аритмогенного, гастроинтестинального и др.) теофиллины, особенно пролонгированные, имеют ограниченное применение у пациентов пожилого возраста. Их назначение целесообразно в качестве вспомогательного средства при неэффективности проводимой терапии, непереносимости β2-агонистов, а также больным, предпочитающим прием препаратов внутрь (при отсутствии гастроэзофагеальной рефлюксной болезни) [13].
Поскольку БА – это хроническое воспалительное заболевание дыхательных путей, непременной составляющей лечения являются противовоспалительные препараты, которые используются для длительного контроля БА.
В настоящее время к препаратам первой линии для профилактической терапии БА у больных любого возраста (уровень доказательности А) относятся ингаляционные глюкокортикостероиды (ИГКС) (беклометазона дипропионат, флунизолид, флютиказона пропионат, триамциналона ацетонид, мометазона фуроат), которые рекомендуются практически всем больным БА, в том числе и с легкой степенью тяжести течения заболевания.
ИГКС считаются самыми мощными противовоспалительными средствами благодаря наличию широкого спектра действия как на клеточные, так и на гуморальные механизмы развития аллергического (иммунного) воспаления [13].
ИГКС – препараты выбора для больных с персистирующей БА любой степени тяжести.
Рекомендации международных и национальных консенсусов по лечению БА содержат схемы лечения с включением ИГКС в качестве профилактической базисной терапии в дозах, которые зависят от тяжести заболевания [26]. Применение ИГКС следует начинать как можно раньше после установления диагноза БА и определения степени ее тяжести, соответственно подбирая дозы.
Существующие ИГКС несколько различаются по силе действия и биодоступности после ингаляционного введения, однако при использовании в эквивалентных дозах их эффективность приблизительно одинакова (табл. 1).
ИГКС рекомендуется назначать всем больным БА, которые принимают β2-агонисты короткого действия более одного раза в день. Больным с впервые выявленной БА или при ухудшении состояния для достижения клинического эффекта назначают среднюю терапевтическую дозу ИГКС (800-1 000 мкг/сут) обычно в 2 приема (утром и вечером), затем ее снижают, не ранее чем через 3 мес, до минимальной поддерживающей. При недостаточной эффективности средней терапевтической дозы ИГКС она может быть повышена до 2 000-2 500 мкг/сут для взрослых и до 1 000 мкг/сут для детей [14, 18].
Кромоны (стабилизаторы мембраны тучных клеток) – кромогликат натрия и недокромил – ингаляционные противовоспалительные препараты нестероидной структуры, которые можно применять в лечении больных с легкой персистирующей БА, а также с целью профилактики – для предупреждения бронхоспазма при физической нагрузке, вдыхании холодного воздуха, возможном контакте с аллергеном [14].
Антилейкотриеновые препараты (антагонисты лейкотриеновых рецепторов) принимаются внутрь (зафирлукаст, монтелукаст). Они показаны в основном больным с аспириновой БА, а также для предотвращения бронхоспазма, спровоцированного аллергенами и физической нагрузкой [8, 14].
СГКС. Регулярный прием СГКС показан больным с тяжелым течением БА при неэффективности высоких доз ИГКС в сочетании с регулярным приемом бронходилататоров. Лучше назначать такие пероральные СГКС, как преднизолон или метилпреднизолон, поскольку они обладают минимальным минералокортикоидным эффектом и имеют относительно короткий период полувыведения, хотя нередко оказывают выраженное действие на поперечно-полосатые мышцы. В тех случаях, когда больному впервые назначается глюкокортикоидная терапия, используют средние терапевтические дозы преднизолона (20-40 мг/сут) в течение 7-10 дней до достижения и закрепления клинического эффекта, после чего дозу препарата можно снижать до 1/2 таблетки в 3 дня. При уменьшении дозы преднизолона до 10 мг (2 таблетки) снижение дозировки следует проводить менее активно: по 1/4 таблетки в 3 дня до полной отмены препарата или сохранения поддерживающей дозы (2,5-10 мг/сут) [14]. По возможности, при длительной терапии поддерживающую дозу следует назначать один раз в сутки – утром, ежедневно или через день [4]. При снижении дозы СГКС больным БА необходимо добавлять ИГКС в средней терапевтической дозе (800-1 000 мкг/сут).
Международные согласительные документы рекомендуют пролонгированные β2-агонисты сочетать с ИГКС, что не только позволяет избежать увеличения дозы ИГКС, но и приводит к дополнительному улучшению показателей функции внешнего дыхания, уменьшению выраженности ночных симптомов БА и количества обострений, повышению качества жизни [15].
Результаты международных многоцентровых рандомизированных клинических исследований свидетельствуют, что добавление пролонгированных β2-агонистов к ИГКС у больных с персистирующей БА любой степени тяжести более эффективно, чем повышение дозы ИГКС [4, 26]. Такая комбинация является «золотым стандартом» терапии БА [27].
В 2004 г. были опубликованы данные рандомизированного клинического исследования GOAL (The Gaining Optimal Asthma Control Study), в котором принял участие 3 421 больной с шести континентов. В течение 52 нед наблюдали за пациентами, которые в качестве базисной терапии принимали только ИГКС (флютиказона пропионат), и теми, кто получал комбинированный препарат серетид, содержащий ингаляционный глюкокортикостероид флютиказона пропионат и β2-агонист длительного действия сальметерол. Оценивалась возможность достижения наиболее эффективного контроля БА. Одной из предпосылок исследования стало то, что патогенетически БА является двухкомпонентным заболеванием, при котором происходит как воспаление дыхательных путей, сопровождающееся отеком слизистой оболочки бронхов, гиперсекрецией, дискринией, так и дисфункция гладких мышц бронхов, характеризующаяся бронхоспазмом и гиперреактивностью бронхов. Действие ИГКС направлено на ликвидацию воспаления, а β2-агониста – на устранение бронхоспазма. Проведение монотерапии препаратом любого класса не может обеспечить достаточную степень контроля над течением болезни. Результаты исследования показали, что серетид позволяет достичь полного контроля (табл. 2) у каждого второго пациента, в то время как при традиционной терапии этот показатель составляет лишь 5% (по данным AIRE).
Анализ данных исследования GOAL показал, что полный контроль – это реальная цель в лечении БА вне зависимости от тяжести заболевания. При применении серетида контроль БА достигается значительно быстрее с использованием вдвое меньшей дозы кортикостероида, чем при монотерапии.
Современным методом ликвидации тяжелого обострения БА является небулайзерная терапия, цель которой – доставка терапевтической дозы препарата в аэрозольной форме непосредственно в бронхи больного и достижение быстрого клинического эффекта (5-10 мин). Небулайзерную терапию проводят с помощью специального прибора, состоящего из небулайзера (приспособления для распыления медикаментов) и компрессора, создающего поток мелких частиц (2-5 мкм) со скоростью не менее 4-6 м/мин. Использование небулайзеров при обострении БА позволяет местно вводить высокие дозы бронхолитиков. При этом вводимое вещество практически не всасывается в кровь и не оказывает побочных действий на другие органы и системы, как это бывает при приеме таблеток или проведении инъекций.
Таким образом, с помощью небулайзерной терапии достигается высокая местная активность ингаляционных препаратов, позволяющая не только эффективно уменьшать проявление бронхоспазма, но и в значительной степени снижать частоту системных побочных эффектов лекарственных средств.
Основными показаниями к применению небулайзеров на догоспитальном этапе лечения БА являются:
- необходимость использования высоких доз препаратов;
- обеспечение целенаправленной доставки препарата в дыхательные пути;
- осложнения при применении обычных доз лекарственных средств;
- тяжесть состояния пациента (отсутствие эффективного вдоха);
- детский возраст, особенно первые годы жизни;
- предпочтение больного.
К преимуществам небулайзерной терапии относятся:
- отсутствие необходимости в координации дыхания с поступлением аэрозоля;
- возможность использования высоких доз препарата и быстрого получения фармакодинамического ответа;
- непрерывная подача мелкодисперсного лекарственного аэрозоля;
- быстрое и значительное улучшение состояния вследствие эффективного поступления в бронхи лекарственного вещества;
- техническая простота ингаляции [8].
Препараты для небулайзерной терапии выпускаются в специальных контейнерах-небулах. В Украине зарегистрирован Вентолин ТМ Небулы ТМ (1 доза препарата содержит 2,5 мг сальбутамола) и Фликсотид ТМ Небулы ТМ (1 доза препарата содержит 2,0 мг флютиказона).
Небулайзерная терапия – достойная альтернатива парентеральной терапии тяжелого обострения астмы (ТОА).
Рекомендуется следующая схема лечения: в первый час проводят три ингаляции сальбутамола (Вентолина) по 2,5 мг каждые 20 мин, затем их повторяют каждый час до значимого улучшения состояния (до достижения ПСВ – 60-75% от должного или наилучшего для больного значения) [7].
Фликсотид через небулайзер назначают после ингаляции бронхолитика 1-2 раза в сутки в течение 5-7 дней. Комбинированная терапия с применением бронхолитиков и ИГКС высокоэффективна в лечении ТОА у больных как со среднетяжелым, так и тяжелым течением БА [12].
По мнению ведущих экспертов, внедрение ИГКС в клиническую практику стало революционным событием в терапии БА [22]. Результаты проведенных исследований показали, что современные ИГКС в высоких дозах позволяют значительно снизить дозы СГКС у больных с тяжелой стероидозависимой БА [2]. Однако примерно 4-5% всех больных БА плохо «отвечают» на терапию ИГКС, и контроль БА у них достигается только при использовании СГКС. Несмотря на то что СГКС являются высокоэффективными препаратами, риск развития тяжелых осложнений, приводящих к инвалидности, очень высок, поэтому всегда надо стремиться к полной отмене или максимальному снижению дозы СГКС.
- БА, независимо от степени тяжести, является хроническим воспалительным заболеванием дыхательных путей;
- воспаление дыхательных путей вызывает их гиперреактивность, бронхиальную обструкцию и респираторные симптомы;
- обструкция бронхов при БА обусловлена нарушением тонуса гладких мышц, отеком бронхиальной стенки и секрецией слизи в просвете бронхов;
- патогенетически БА является двухкомпонентным заболеванием и обусловлена как воспалением дыхательных путей (отек, повреждение эпителия, инфильтрация клетками воспаления, утолщение базальной мембраны), так и дисфункцией дыхательных мышц (бронхоконстрикция, гиперреактивность бронхов);
- наиболее эффективными противовоспалительными препаратами, используемыми в терапии БА, являются глюкокортикостероиды. Основную роль при длительном лечении БА играют ИГКС, имеющие несравненно более безопасный клинический профиль, т. е. вызывающие значительно меньшее количество побочных реакций;
- наиболее эффективными бронхолитиками считаются ингаляционные β2-агонисты короткого действия, которые применяются по требованию, и β2-агонисты длительного действия в качестве базисной профилактической терапии;
- добавление β2-агонистов длительного действия к терапии низкими дозами ИГКС обеспечивает более эффективный контроль БА, чем монотерапия более высокими дозами ИГКС;
- комбинация β2-агонистов длительного действия и ИГКС (серетид) у больных с персистирующей БА любой степени тяжести – новый «золотой стандарт» терапии БА. Такая комбинация позволяет держать БА под полным контролем и «при правильном подходе к лечению жизнь больного БА может отличаться от жизни обычного человека всего двумя вдохами серетида»;
- больные гормонозависимой БА должны получать максимально эффективную дозу ИГКС, чтобы уменьшить дозу СГКС до минимально необходимой;
- при лечении тяжелого обострения БА достойной альтернативой системным бронхолитикам и СГКС является небулайзерная терапия (Вентолин ТМ Небулы ТМ , Фликсотид ТМ Небулы ТМ );
- лечение нужно выбирать исходя из тяжести течения БА, доступности противоастматических препаратов, особенностей системы здравоохранения и индивидуальных условий жизни пациента.
источник