Фармакология. Механизм действия. Фармакологические свойства симпатомиметических веществ обусловлены их способностью связываться с бета-адренергическими рецепторами и стимулировать внутриклеточное накопление циклического аденозинмонофосфата (цАМФ). У человека существует, по крайней мере, два типа бета-адренергических рецепторов: бета1- и бета2-адренорецепторы. Стимуляция бета1-рецепторов вызывает липолиз, стимуляцию сердечной деятельности и торможение кишечника. Стимуляция бета2-рецепторов ведет к бронходилатации, вазодилатации, стимуляции скелетной мускулатуры и снижению тонуса матки. Такое разделение важно, поскольку некоторые вещества, стимулирующие рецепторы, более избирательны по отношению к одному или другому типу рецепторов и, следовательно, имеют различные эффекты.
Симпатомиметические вещества, которые использовались раньше, такие как изопреналин, действуют одновременно на оба типа рецепторов, но вещества, созданные за последние два десятилетия для лечения астмы, имеют более избирательное действие на бета2-адренорецепторы. Разделение между бета2-адренорецепторами на уровне гладкой мускулатуры бронхов и кровеносных сосудов, мускулатуры матки и скелетной в настоящее время не может быть проведено фармакологическими методами.
Действие симпатомиметических веществ не ограничивается только простым расслаблением гладкой мускулатуры. В очень низких концентрациях они подавляют высвобождение медиаторов из тучных клеток. При ингаляционном введении больному с аллергической астмой сразу перед вдыханием аллергена они подавляют развитие немедленной бронхоконстрикции, но не предупреждают замедленную астматическую реакцию даже при введении очень высоких доз. Не совсем ясно, связано ли это отсутствие эффекта на реакцию замедленного типа с отсутствием фармакологической активности или с недостаточным количеством лекарства в бронхиальной стенке в период развития поздней реакции.
Бета2-адренергические вещества стимулируют также мукоцилиарную функцию дыхательных путей и восстанавливают нормальный бронхиальный секреторный клиренс при бронхиальной астме. Кроме того, симпатомиметики уменьшают повышенную микрососудистую проницаемость дыхательных путей и, таким образом, могут снижать отек их слизистой. Неизвестно, какой из различных видов действия симпатомиметических веществ связан с длительным терапевтическим эффектом при бронхиальной астме, но немедленный симптоматический эффект объясняют в основном их бронхорасширяющей активностью.
Проведено много исследований с целью определения соответствия наблюдений in vitro и клинической ситуации. Повторная ингаляция симпатомиметических лекарств у здоровых испытуемых снижает реактивность бета-адренорецепторов их дыхательных путей, но этот феномен не наблюдается у больных астмой. Дыхательные пути больных астмой, регулярно получающих ингаляционным путем или внутрь симпатомиметические лекарства, сохраняют реактивность к бета-адренергической стимуляции даже через недели или месяцы лечения. Чтобы доказать, что после продолжительного лечения реактивность к ингалируемым симпатомиметикам становится ниже, чем в начале лечения, необходимо еще провести тщательные клинические исследования. Клиническая значимость такой пониженной чувствительности пока остается неясной. Пониженная чувствительность, вызванная систематической терапией, должна быть дифференцирована от сниженной эффективности применения симпатомиметических веществ, которая наблюдается при обострении заболевания и особенно при острой тяжелой форме астмы.
Побочные эффекты. Побочные эффекты симпатомиметических средств связаны с их стимулирующим действием на бета-адренергические рецепторы тканей и органов помимо бронхиальных. Симпатомиметические вещества могут вызывать мышечный тремор и беспокойство путем стимуляции бета-адренергических рецепторов скелетных мышц. Они также могут вызывать тахикардию за счет стимуляции сердечных бета-рецепторов. Этот побочный эффект чаще наблюдается при назначении неселективных бета-адренергических агонистов, хотя некоторое количество бета2-рецепторов имеется также и в сердечной мышце. Бета2-адренергические вещества могут вызывать гипокалиемию, особенно когда их назначают парентерально или внутрь в высоких дозах.
В целом же, побочные эффекты ингаляционных селективных симпатомиметических веществ отсутствуют или незначительны. Существуют индивидуальные отличия в чувствительности к системным эффектам этих лекарств, поэтому изредка пациенты могут жаловаться на выраженный тремор и/или тахикардию даже после обычных доз симпатомиметиков. Побочные эффекты уменьшаются при последующем использовании, однако в отдельных случаях лечение симпатомиметическими средствами может оказаться принципиально невозможным.
Терапевтическое применение. Симпатомиметические вещества применяются как для неотложной терапии приступов, так и для лечения астмы легкой и средней степени тяжести. При лечении хронической астмы их используют в тех случаях, когда небронходилатирующие антиастматические средства оказываются недостаточными или неадекватными.
Выбор симпатомиметического средства определяется несколькими критериями — эффективностью лекарства, продолжительностью его действия, селективностью в отношении бета-адренергических рецепторов, его побочными эффектами, способом применения и стоимостью. Ингаляционные симпатомиметики короткого действия (фенотерол, сальбутамол, тербуталин) рекомендуется использовать эпизодически для купирования нетяжелых приступов удушья и затруднений дыхания. Примерные дозы этих лекарств, оказывающие равный эффект следующие:
— 400 мкг фенотерола;
— 400 мкг сальбутамола;
— 750 мкг тербуталина.
Пациенты должны быть предупреждены, что увеличение дозы симпатомиметика — неподходящий и иногда рискованный способ справиться с ухудшением течения болезни. Больным следует ограничивать использование симпатомиметиков короткого действия до 3-4 раз в сутки (6-8 ингаляций). Они должны осознавать, что, если им требуется большее количество ингаляций, следует обратиться к врачу.
Острое астматическое состояние может сопровождаться снижением реактивности к обычным дозам симпатомиметиков. Это почти наверняка обусловлено сочетанием механических и воспалительных факторов, затрудняющих доступ лекарства к месту действия. Когда эти лекарства вводят в высоких дозах ингаляционным способом или парентерально, отмечается быстрая бронходилатация. Это указывает на то, что снижение чувствительности является лишь частичным и может быть обусловлено резкой обструкцией дыхательных путей, препятствующей поступлению лекарства к ткани-мишени.
Ингаляции симпатомиметиков являются эффективным способом предупреждения астмы физического напряжения, и пациентам с подобной симптоматикой следует рекомендовать сделать две ингаляции симпатомиметика непосредственно перед физической нагрузкой.
Создание лекарственных форм сальбутамола и тербуталина с медленным высвобождением действующего начала позволило сделать внутреннее применение удобным при ночных приступах и ввести их в схемы длительного лечения астмы. Более того, длительно действующие таблетированные препараты, принятые перед сном, позволяют лучше контролировать утреннее ухудшение пик-флоу, столь часто отмечаемое у больных бронхиальной астмой.
Введение симпатомиметических средств с помощью распылителя стало стандартом неотложной помощи и последующего лечения тяжелых приступов астмы в больничных условиях. Этот способ может применяться при длительном лечении в домашних условиях больных с тяжелыми формами астмы, но непременно при тщательном медицинском наблюдении. При использовании распылителей обычно применяются значительно более высокие дозы этих лекарств по сравнению с дозирующими ингаляторами, например, 5-10 мг фенотерола, сальбутамола или тербуталина. Как правило, они хорошо переносятся и оказываются эффективными, но такие побочные эффекты, как тремор, тахикардия и потливость отмечаются чаще, чем при стандартных дозировках.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
НИИ пульмонологии Минздрава РФ, Москва
НИИ пульмонологии Минздрава РФ, Москва
Бронхиальная астма (БА) является одним из наиболее часто встречающихся заболеваний человека, по данным эпидемиологических исследований, распространенность БА достигает 5% общей популяции населения и имеется повсеместная тенденция к дальнейшему росту численности больных [1].
Летальность от БА продолжает расти, так, в США в 1979 г. число смертельных случаев от БА составило 0,9 на 100 тыс. населения, тогда как в 1989 г. эта цифра увеличилась более чем в 2 раза (1,9 на 100 тыс.) [2]. У большинства больных БА не наблюдается хронического прогрессирования заболевания, однако в ряде случаев существует опасность развития тяжелого обострения заболевания – астматического статуса (АС), который при отсутствии адекватной помощи может закончиться смертельным исходом. Многочисленные исследования, посвященные анализу летальных исходов при БА, свидетельствуют о том, что около 80 % всех смертей при БА связаны с факторами, которые потенциально можно было предотвратить [3]. Основными такими факторами являются: неспособность врача правильно оценить состояние пациента и тяжесть развившегося обострения БА; неправильное поведение больного, заключающееся в неправильной оценке своего состояния и невыполнении рекомендаций по терапии заболевания; неадекватное обучение больного; недостаточное использование при лечении БА базисных препаратов – ингаляционных глюкокортикостероидов [3]. В последние годы появилось большое число национальных согласительных документов (консенсусов) по БА, которые значительно унифицируют подходы к оценке и ведению больных астмой, в том числе и с астматическим статусом [1, 4, 5]. Кроме того, появились некоторые новые методы терапии, так, например, изменение подходов к ингаляционной терапии и вентиляционному пособию при БА позволило значительно снизить летальность.
В настоящее время существует несколько терминов, которые используются при описании тяжелого обострения БА. Традиционно под астматическим статусом (АС) понимали эпизод тяжелого обострения БА, продолжающийся более 24 ч [6]. Однако скорость развития тяжелого приступа не может служить критерием его выделения из группы астматических атак, так как в ряде случаев тяжелый приступ БА может развиваться настолько быстро, что летальный исход может наступить через нескольких часов или даже минут от начала приступа [7]. Все большее распространение, особенно в странах Европы, получает термин “тяжелое обострение астмы” (ТОА) или “острая тяжелая астма” (acute severe asthma), введенный в обиход английскими авторами в начале 80-х годов [8]. Этот термин, возможно, более правомочен, так как он подчеркивает главное отличие данного состояния – его тяжесть. Больных с угрозой остановки дыхания объединяют в группу жизнеугрожающей астмы (life threatening asthma). С другой стороны, во многих странах, в том числе США, Канаде и нашей стране, чаще всего употребляется термин астматический статус, однако в его определение вкладывается тот же смысл, что и в acute severe asthma, т.е. не длительность развития приступа, а его необычная тяжесть и резистентность к обычной бронходилатирующей терапии [9, 10]. Некоторые авторы под АС понимают эпизод острой дыхательной недостаточности вследствие обострения БА [11].
Основные средства для терапии ТОА
Основными компонентами лечения больных ТОА обычно являются бронхорасширяющие препараты, глюкокортикостероиды и кислородотерапия. В ряде случаев может потребоваться назначение дополнительных бронхорасширяющих препаратов, а в особо тяжелых ситуациях – респираторной поддержки (рис.1).
Бронхорасширяющие препараты являются краеугольным камнем терапии ТОА, так как эти препараты позволяют быстро уменьшить бронхоспазм и выиграть время до того момента, когда начнут действовать противовоспалительные препараты. В настоящее время существуют три основных класса бронхорасширяющих препаратов: b2-агонисты, антихолинергические препараты и теофиллины, при лечении БА ведущую роль играют b2-агонисты (табл. 1).
Механизмы действия b 2— агонистов
Препаратами первой линии при лечении всех форм бронхиальной астмы являются b2-агонисты. Стимуляция b2-рецепторов ведет к активации аденилатциклазы, приводящей, в свою очередь, к повышению внутриклеточного содержания циклического АМФ, активации протеинкиназ А и G, фосфорилированию некоторых внутриклеточных белков и, в конечном итоге, к расслаблению гладкой мускулатуры бронхов и повышению бронхиальной проходимости. Также доказанными механизмами бронхорасширяющего действия b2-агонистов является активация Са2+-зависимых мембранных К + -каналов и регуляция нейропередачи в дыхательных путях [12]. Кроме того, что симпатомиметики влияют на гладкую мускулатуру бронхов, большое значение у больных БА имеет их мембраностабилизирующий эффект. Так, в экспериментальных работах показано, что эти препараты препятствуют высвобождению вновь образующихся медиаторов (простагландина D2, лейкотриена C4) из гранул базофилов и тучных клеток [13].
Другими важными эффектами b2-агонистов являются стимуляция мукоцилиарного транспорта за счет увеличения частоты биения ресничек эпителия [14]; улучшение систолической функции миокарда и снижение сосудистого сопротивления в большом и малом кругах кровообращения [15]; повышение глобальной силы и выносливости дыхательной мускулатуры, уменьшение проявления утомления диафрагмы [16].
Предпочтение отдают селективным b2-агонистам, связывающимся преимущественно с b2-рецепторами, так как эти препараты обладают минимальными побочными эффектами со стороны сердечно-сосудистой системы, связанными преимущественно со стимуляцией b1-рецепторов. Однако селективность препаратов к b2-рецепторам существенно снижается при назначении больших доз, оральном и парентеральном путях введения и на фоне гипоксии [17]. Эталонными препаратами для лечения БА считаются сальбутамол и тербуталин, используются и другие симпатомиметики – метапротеренол, фенотерол.
Место b 2— агонистов в терапии ТОА
Необходимо подчеркнуть, что b2-агонисты показаны практически всем больным с тяжелым обострением БА, независимо от использования их до госпитализации и применявшихся доз.
Отсутствие эффекта от рутинной бронхорасширяющей терапии в домашних условиях чаще всего можно объяснить либо недостаточными дозами препаратов для разрешения тяжелого приступа БА, или, чаще всего, неправильной ингаляционной техникой. Объяснение прогрессирования заболевания с позиции передозировки b2-агонистов (синдром “рикошета”, синдром “запертого легкого”) в настоящее время считается неправомочным.
Широко обсуждавшийся ранее b2-блокирующий эффект метаболитов симпатомиметиков (синдром “рикошета”) не был подтвержден на практике и не имеет какого-либо клинического значения [18]. Снижение ответа на b2-агонисты пытались объяснить с точки зрения развития тахифилаксии, субсенситизации и дизрегуляции b2-рецепторов. Тахифилаксия (снижение числа рецепторов в ответ на их частую стимуляцию препаратом) встречается только при использовании некоторых b2-агонистов короткого действия (адреналин) и практически не имеет значения для современных препаратов [19].
Субсенситизация b2-рецепторов (снижение ответа на препарат) может развиться в результате повреждения рецепторов вследствие вирусной инфекции или ирритации. В данном случае рефрактерность дыхательных путей к b2-агонистам будет продолжаться до тех пор, пока не будет назначена адекватная терапия стероидами или не произойдет самопроизвольное восстановление функции рецепторов [18]. Парадоксальные реакции на b2-агонисты, т.е. бронхоспастический эффект, наблюдаются очень редко. В крупном исследовании, охватывавшем 10 тыс. взрослых больных БА, бронхоспастические реакции были отмечены в 1% всех случаев [20]. Среди возможных причин таких реакций в настоящее время обсуждаются эффекты холодного аэрозоля, высокой скорости ингалируемых частиц, действие адъювантов и растворителей [21].
Известный вазодилатирующий эффект b2-агонистов не является причиной отека слизистой бронхов и “запирания” бронхов, а, напротив, лежит в основе их противоотечного действия. Доказан противоэкссудативный эффект таких b2-агонистов, как сальбутамол [22] и тербуталин [23]. b2-Агонисты вызывают вазодилатацию сосудов посткапиллярного русла, снижая соотношение пре- и посткапиллярного сопротивлений и, таким образом, уменьшая экссудацию плазмы из сосудов в просвет дыхательных путей. По данным J. Roca и соавт., сальбутамол ингибирует вазоконстрикцию микроциркуляторного русла бронхов, вызванную фактором активации тромбоцитов (ФАТ), за счет релаксации эндотелиальных клеток и уменьшения пор между ними [24] (рис. 2).
Способы доставки b 2— агонистов при терапии ТОА
Успех терапии зависит не только от правильного выбора препарата, его дозы, но и от адекватной доставки препарата в дыхательные пути. b2-Агонисты можно вводить ингаляционно и парентерально, однако основное значение, безусловно, имеет ингаляционный путь введения (табл. 2).
Ингаляционная терапия: небулайзер
Наиболее оптимальной техникой доставки ингаляционных препаратов является использование небулайзеров. Слово “небулайзер” происходит от лат. “nebula” – туман, облачко и может быть определено как “инструмент, превращающий жидкое вещество в аэрозоль для медицинских целей” [25]. Наибольшее распространение получили струйные (компрессорные) небулайзеры, т.е. аппараты, использующие в качестве энергии, превращающей жидкость в аэрозоль, струю газа (воздух или кислород). Достоинствами ингаляционной терапии при помощи небулайзеров является возможность доставки в дыхательные пути большой дозы препарата, отсутствие необходимости в форсированных маневрах и четкой координации вдоха с высвобождением препарата. Использование небулайзера необходимо в ситуациях, когда лекарственное вещество не может быть доставлено в дыхательные пути при помощи других портативных ингаляторов, таких как дозированные ингаляторы (ДИ), в том числе со спейсерами, порошковые ингаляторы или тяжесть состояния пациента и его низкая кооперация не позволяют правильно использовать портативные ингаляторы. Исследования по оценке правильности использования ДИ у стабильных больных с обструктивными заболеваниями легких показали, что лишь 25 % всех больных способны правильно пользоваться ДИ [26]. Учитывая тяжесть состояния больных при ТОА, выраженное диспноэ, изменение дыхательного паттерна, становится ясным, почему ингаляционная терапия с помощью привычных ДИ является практически неэффективной у таких больных.
Больные ингалируют бронхолитики при помощи маски или загубника, в качестве рабочего газа используется воздух, или, что более предпочтительно при БА, кислород, средний поток 6–8 л в 1 мин. При использовании маски больной должен дышать через рот, так как нос является хорошим фильтром и может стать препятствием для доставки препаратов в дыхательные пути. Следует тщательно выбирать модель и тип небулайзера. Так, в одном из исследований при сравнении 17 типов разных струйных небулайзеров различия в выходе аэрозоля достигали 2 раз, а в скорости доставки частиц респирабельной фракции препаратов – 8 раз [27].
При терапии больных ТОА трудно рекомендовать какие-либо фиксированные дозы b2-агонистов, часто дозирование осуществляют эмпирически, в зависимости от эффективности лечения и развития побочных действий. При использовании небулайзера обычно применяются разовые дозы сальбутамола от 2,5 до 10 мг. Как правило, назначают 5 мг сальбутамола в качестве первой дозы, последующие дозы составляют по 2,5 мг. Однако необходимо помнить, что в ряде случаев при тяжелом обострении БА даже доза 5 мг может быть недостаточной и возможно назначение 10 мг [28]. Ответ на небулизированный сальбутамол наблюдается обычно в течение 10–15 мин, если же симптомы не уменьшаются, то назначают повторные ингаляции.
Наиболее часто рекомендуют следующую схему назначения сальбутамола при помощи небулайзера у больных с ТОА: в 1-й час терапии проводится три ингаляции по 2,5 мг каждые 20 мин, затем ингаляции проводят каждый час до значимого улучшения состояния, после чего возможно назначение препарата каждые 4–6 ч [11]. Разовые дозы тербуталина при использовании небулайзеров обычно в 2 раза выше, чем для сальбутамола, и составляют 5–10 мг. Использование высоких доз b2-агонистов при ТОА объясняется особенностью кривой “доза–ответ”: чем более выражена бронхиальная обструкция, тем большая доза бронхолитика требуется для достижения максимального ответа бронхов, так как отек и воспаление слизистой дыхательных путей препятствуют доставке препарата к рецепторам. Повышение кратности введения b2-агонистов связано с повышением общего обмена, высоким потреблением кислорода и уменьшением периода полужизни препаратов. Значительная разница в дозах b2-агонистов, использующихся при применении небулайзеров и портативных ингаляторов объясняется высокой потерей препаратов при небулизации: около 65% теряется во время выдоха и до 20% задерживается в “остаточном объеме” небулайзера, таким образом, 2,5 мг сальбутамола для небулизации соответствует 0,4–0,8 мг сальбутамола ДИ [29].
В настоящее время обсуждаются режимы назначения ингаляционных симпатомиметиков в 1-е сутки терапии ТОА. В недавно проведенном рандомизированном контролируемом исследовании сравнивали два режима назначения небулизированного сальбутамола “по потребности” и регулярное (каждые 4 ч) [30]. Было показано преимущество назначения препарата “по потребности”: снижались общая доза сальбутамола (29,4 мг против 62,8 мг), длительность стационарного лечения (3,7 против 4,7 дней) и частота побочных реакций.
Применение ингаляций сальбутамола при помощи небулайзеров можно использовать не только в условиях стационара или отделения интенсивной терапии, но и на самых ранних этапах оказания неотложной помощи больным ТОА: в домашних условиях, в машине скорой помощи. Исследование, проведенное в Шотландии, показало, что начальная терапия сальбутамолом в дозе 5 мг при помощи небулайзера, проводимая в машине скорой помощи у 131 больного с тяжелым обострением БА, оказалась успешной в 79% случаев, не было отмечено эффекта в 18% и ухудшение наблюдалось лишь в 3%. Среднее повышение пиковой скорости выдоха (ПСВ) составило 56% [31].
Относительно новым методом ингаляционной терапии при АС является постоянная небулизация [32, 33]. В основе метода лежит длительная, в течение нескольких часов, ингаляция раствора b2-агонистов через маску небулайзера, в камеру которого с постоянной скоростью подается препарат, в качестве “рабочего газа” используется кислород. Постоянная небулизация имеет преимущество перед традиционным интермиттирующим режимом использования небулайзера: более простое исполнение ингаляции пациентом, требуется меньший контроль со стороны медицинского персонала, отмечено меньшее число побочных эффектов [32].
Ингаляционная терапия: дозированный ингалятор со спейсером
Несмотря на то что в некоторых нормативных документах по терапии ТОА (Фармакопея США) использование b2-агонистов при помощи небулайзера считается обязательным [10], активно обсуждается вопрос о возможности назначения бронхолитиков при помощи комбинации спейсер-ДИ. Преимущество имеют спейсеры большого объема, около 750 мл, оснащенные однонаправленным клапаном вдоха (Volumatic, Nebuhaler). Достоинствами спейсеров как средства доставки лекарственных препаратов являются достаточно простая ингаляционная техника, не требующая четкой координации вдоха и высвобождения вещества, а также осаждение крупных, нереспирабельных частиц на стенках спейсера, а не в ротовой полости, как при использовании ДИ. Множественные высвобождения ДИ и длительные паузы снижают доставку препарата в дыхательные пути, поэтому правильной ингаляционной техникой при использовании спейсера является использование одиночных высвобождений препарата на фоне глубокого дыхания через мундштук или маску спейсера [34]. Необходимо помнить о том, что электростатический заряд, создающийся на стенках пластиковых спейсеров, может до 1,5 раз снижать доставку препарата в дыхательные пути, в связи с чем рекомендуется перед использованием обрабатывать спейсеры ионными детергентами.
Несколько исследований продемонстрировали, что при тяжелом обострении БА эффективность b2-агонистов при помощи комбинации спейсер-ДИ не ниже, чем при использовании небулайзера [35, 36]. Преимуществами такого подхода являются снижение общей дозы b2-агонистов примерно в 6 раз и значительный экономический эффект.
Однократная доза сальбутамола при использовании ДИ со спейсером обычно составляет 400 мкг, кратность введения может значительно варьировать. C.Rodrigo и J.Rodrigo рекомендуют назначение 400 мг через каждые 10 мин до достижения общей дозы 7200 мкг в течение первых 3 ч [36]. В работе А. Raimondi и соавт. была использована другая схема: 400 мкг сальбутамола каждые 30 мин первые 3 ч, а затем ежечасно последующие 3 ч (3600 мкг) [35]. Несмотря на показанные достоинства ингаляционной терапии при помощи ДИ со спейсером, использование небулайзеров является более простым методом, не требует обучения пациента дыхательному маневру и контролю врача за техникой ингаляции.
Ингаляционная терапия: порошковый ингалятор
В ряде работ показана возможность использования при тяжелом обострении БА в качестве средства доставки бронхолитиков порошковых ингаляторов (ингаляторов сухой пудры). Достоинством порошковых ингаляторов является возможность достижения высокой интрабронхиальной депозиции препаратов (до 17–32%), однако для осуществления правильной ингаляции требуется создание инспираторного потока не менее 30 л/мин [34].
В исследовании F. Tonnisen и соавт. сравнивали эффективность тербуталина, назначаемого в виде двух форм: ДИ со спейсером и в виде порошкового ингалятора. Препарат был назначен двум группам больных с тяжелой обструкцией дыхательных путей в одинаковой дозе: 2,5 мг дважды с интервалом 15 мин. Более выраженное улучшение функции внешнего дыхания (ФВД) было отмечено в группе больных, получавших порошковый ингалятор: через 10 мин после последней ингаляции ОФВ1 повысился на 400 мл по сравнению с 210 мл во второй группе. Кроме того, повышение ОФВ1 более 10% наблюдалось у 32 из 33 пациентов в первой группе, по сравнению с 13 из 29 больных, получавших ингаляции тербуталина при помощи ДИ со спейсером [37].
В настоящее время считается доказанным, что ингаляционные b2-агонисты более эффективны при ТОА, чем внутривенные формы этих препаратов. Преимущество ингаляционного пути введения b2-агонистов перед внутривенным было показано как минимум в двух крупных рандомизированных многоцентровых исследованиях. В двойном слепом исследовании, проведенном Шведским Обществом грудной медицины, эффекты ингаляционного и внутривенного сальбутамола сравнивали у 176 пациентов с тяжелым обострением БА. Терапия при помощи небулайзера (доза сальбутамола 0,15 мг/кг дважды в течение 60 мин или около 20 мг/ч) привела к достоверно большему приросту ПСВ, по сравнению с инфузионной терапией сальбутамолом (0,5 мкг/кг в течение 1 ч). Число побочных эффектов (снижение диастолического давления, тахикардия, тремор) оказалось выше у больных, получавших ингаляционную терапию, что можно объяснить более высокой концентрацией препарата в сыворотке крови [38].
В исследовании, проведенном S. Salmeron и соавт., эффекты двух способов введения сальбутамола сравнивали у 47 больных с ТОА, сопровождавшимся гиперкапнией. Ингаляционная терапия при помощи небулайзера (5 мг сальбутамола дважды в течение 1 ч) оказалась более эффективной, чем внутривенная терапия (0,5 мг сальбутамола в течение 1 ч). У больных, получавших ингаляционную терапию, наблюдались более значимые прирост ПСВ, снижение РаСО2, улучшение клинической картины. Сывороточные уровни препаратов не различались в обеих группах, однако частота побочных эффектов (тахикардия, гипокалиемия) в группе внутривенной терапии была несколько выше [39]. Таким образом, несмотря на выраженную обструкцию дыхательных путей, в большинстве случаев ТОА ингаляционная терапия b2-агонистами при помощи небулайзера способна обеспечить доставку аэрозоля, достаточную для бронходилатации, причем риск побочных реакций меньше, чем при внутривенном введении.
Однако у некоторых больных, не отвечающих на ингаляционные бронхолитики, внутривенные введения могут оказать значительный положительный эффект. Предпосылкой для этого факта является возможность доставки b2-агонистов системным кровотоком к более дистальным дыхательным путям, в которые ингаляционный препарат не может попасть из-за выраженной бронхообструкции и закупорки бронхов вязким густым секретом. В исследовании В. Cheong и соавт. внутривенная терапия сальбутамолом со скоростью 12 мкг/ мин в течение 4 ч оказалась более эффективной, чем повторные ингаляции сальбутамола по 5 мг трижды через 30 мин при помощи небулайзера: наблюдался средний прирост показателя ПСВ соответственно на 25 и 14 %, однако выраженность тахикардии была выше в группе внутривенной терапии [41].
Таким образом, применение инфузионных симпатомиметиков показано небольшой группе пациентов с ТОА, не отвечающих на ингаляционные препараты. Рекомендуемыми дозами b2-агонистов (сальбутамола и тербуталина) для внутривенного введения являются медленная инфузия 0,5 мг (или 4–8 мкг/кг) препарата в течение 1 ч [39]. Показана также безопасность и хорошая переносимость длительной инфузии тербуталина в дозе 0,1–0,4 мг/кг/мин в течение 5–12 ч [41].
Подкожное введение b2-агонистов показано в следующих ситуациях: развитие ТОА является составной частью системной аллергической (анафилактической) реакции; нарушено сознание больного или существует угроза остановки дыхания; отсутствует эффект от ингаляционной терапии [11, 29]. В качестве препарата для подкожного введения используется эпинефрин (адреналин) в дозе 0,3 мг, повторные инъекции проводят в зависимости от выраженности бронхолитического ответа или развития побочных реакций с интервалами 20 мин в 1-й час и в последующем через 4–6 ч. В одном из исследований на фоне подкожного введения адреналина выраженный эффект (повышение ПСВ > 120 л/мин и ОФВ > 20%) наблюдался у 60 % пациентов, рефрактерных к ранее проводимой 2-часовой ингаляционной терапии метапротеренолом [42].
Подкожное введение b-агонистов показано в следующих ситуациях:
Учитывая, что адреналин является неселективным препаратом и обладает сродством к a-, b1— и b2-рецепторам, риск развития сердечно-сосудистых осложнений (синусовая тахикардия, экстрасистолия, предсердные аритмии) при его использовании значительно повышен, поэтому его обычно рекомендуют больным не старше 40 лет и без сердечных заболеваний в анамнезе. Тербуталин также может использоваться для подкожного введения, однократная доза составляет 0,25 мг, частота введения такая же, как для адреналина. Предпочтение подкожному использованию тербуталина отдается в случаях терапии ТОА у беременных, так как в отличие от адреналина он не оказывает влияния на развитие плода и не снижает маточный кровоток [11]. Необходимо также помнить, что снижение сердечного выброса и повышение периферического сосудистого сопротивления, которые имеют место при ТОА, могут значительно нарушать абсорбцию подкожно вводимых препаратов.
Наиболее частыми осложнениями при терапии b2-агонистами является триада симптомов: тахикардия, гипоксемия и гипокалиемия. При ТОА адекватная терапия симпатомиметиками может, наоборот, привести к снижению частоты сердечного ритма, даже на фоне их внутривенного введения [38].
Кроме тахикардии b2-агонисты могут вызвать и другие сердечно-сосудистые эффекты: предсердные и желудочковые экстрасистолы, снижение диастолического и повышение систолического АД. На фоне приема b2-агонистов на ЭКГ наблюдаются изменения интервала QT, уплощение зубца Т [43]. Удлинение QT является независимым фактором риска внезапной смерти из-за злокачественных желудочковых аритмий. Известен случай развития инфаркта миокарда на фоне приема больших доз неселективного b2-агониста изопротеренола [18]. К счастью, подобные эффекты наблюдаются крайне редко. В исследовании М. Newhouse и соавт. при назначении высоких доз сальбутамола (до 1600 мкг) и фенотерола (до 3200 мкг) при помощи спейсера 257 больным с тяжелым обострением БА преходящие наджелудочковые экстрасистолы наблюдались у 13% пациентов, умеренное расширение интервала QT (15–25%) было отмечено менее чем у 5% пациентов и ни у одного больного не было выявлено выраженного расширения QT (> 25%) [44]. Следует также учитывать, что гипоксемия значительно увеличивает риск сердечно-сосудистых осложнений при введении b2-агонистов, поэтому их назначение должно сопровождаться адекватной кислородотерапией, которая, по-видимому, обладает протективным действием при использовании высоких доз симпатомиметиков во время АС [18].
Гипокалиемия, развивающаяся при терапии b2-агонистами, также вносит значительный вклад в развитие аритмогенного эффекта этих препаратов. Снижение сывороточного калия развивается не в результате повышения экскреции калия, а из-за перемещения калия из экстрацеллюлярного пространства в клеточные отделы, в основном, скелетные мышцы вследстие прямой стимуляции натриево-калиевых насосов, связанных с мембраной миоцитов [43]. Кроме оказания негативного влияния на сердечно-сосудистую систему гипокалиемия может играть важную роль в развитии слабости дыхательной мускулатуры. Обычно среднее снижение калия в сыворотке не превышает 0,25 и 0,4 ммоль/л соответственно при ингаляционном и внутривенном введении b2-агонистов [36, 39]. Фенотерол вызывает несколько большее снижение сывороточного калия по сравнению с сальбутамолом [18].
К неблагоприятным эффектам b2-агонистов также относится и нарастание гипоксемии, основным механизмом развития которой считается b2-индуцированная легочная вазодилатация, в том числе и в регионах с низким соотношением вентиляция/перфузия, что приводит к дальнейшему ухудшению соотношения V/Q и нарастанию гипоксемии [45]. Стимуляция b2-агонистами скелетных мышц и увеличение потребления кислорода мышцами является еще одним механизмом усугубления гипоксемии. Однако в отличие от больных с хронической обструктивной болезнью легких выраженность нарастания гипоксемии на фоне приема симпатомиметиков при АС небольшая (1,5–5 мм рт.ст.) и не должна являться препятствием для проведения терапии b2-агонистами при отсутствии источника кислорода.
Не вполне ясно, связано ли развитие метаболического ацидоза при ТОА с назначением b2-агонистов. В исследовании Д. Appel и соавт. было отмечено повышение молочной кислоты в сыворотке крови (2,9–9,4 мэкв/л) у 12 пациентов с ТОА, получавших подкожные введения адреналина. В то время как состояние больных улучшалось, снижался уровень молочной кислоты и соответственно уменьшалась выраженность метаболического ацидоза, в то же время терапия адреналином продолжалась [42]. Следовательно, повышение молочной кислоты в крови больше связано с тяжестью БА, чем с терапией, возможными причинами ее накопления могут быть: избыточная мышечная работа, недоутилизация лактата, стимуляция гликолиза в клетках крови.
b2-Агонисты являются препаратами первой линии терапии БА. Назначение b2-агонистов показано практически всем больным с тяжелым обострением БА, независимо от того, использовал ли больной бронхолитики до госпитализации и в каких дозах. Основное значение имеет ингаляционный путь доставки b2-агонистов (при помощи небулайзеров, спейсеров), которые более эффективны, чем парентеральные формы этих препаратов. В некоторых ситуациях, при рефрактерной астме, возможно также внутривенное и подкожное назначение симпатомимети ков. Факторами, ограничивающими использование b2-агонистов, являются их побочные эффекты (гипоксемия, гипокалиемия, аритмии, метаболический ацидоз).
1. Бронхиальная астма. Глобальная инициатива. Пульмонология 1996 (Приложение); 1–165.
2. Bailey R., Weingarten S., Lewis M., Mohsenifar Z. Impact of clinical pathways and practice guidelines on the management of acute exacerbations of bronchial asthma. Chest 1998; 113: 28–33.
3. Harrison B. Acute severe asthma in adults. Medicine (London) 1995; 26: 298–301.
4. British guidelines on asthma management: 1995 review and position statement. Thorax 1997; 52 (suppl.1): 1–21.
5. Hargreave F.E., Dolovich J., Newhouse M.T., eds. The assessment and treatment of asthma: a conference report (Rostrum). J.Allergy Clin.Immunol. 1990; 85: 1098–111.
6. Picado C. Classification of severe asthma exacerbations: a proposal. Eur.Respir.J. 1996; 9: 1775–8.
7. Strunk R.C. Death due to asthma. New insights into sudden unexpected deaths, but the focus remains on prevention. Am.Rev.Respir.Dis. 1993; 148: 550–2.
8. Grant I. Severe acute asthma or acute severe asthma. BMJ 1983; 287: 873.
9. Чучалин А.Г. Бронхиальная астма. М.: Медицина. 1985; 158.
10. USP Therapy. Asthma. The United States Pharmacopeal Convention, Inc. 1997.
11. Cobridge T.C., Hall J.B. The assessment and management of adults with status asthmaticus. Am.J.Respir.Crit.Care Med. 1996; 151: 1296–316.
12. Шмушкович Б.И. Бета-адренергическая рецепция у больных
бронхиальной астмой. Механизмы десенситизации. Бронхиальная астма. Под ред. Чучалина А.Г. М., “Агар”. 1997; 118–34.
13. Rihoux J.-P. The allergic reaction. UCB Pharmaceutical Sectior, Brussels 1993; 307.
14. Cochrane G.M. Acute severe asthma: oxygen and high dose (-agonist during transfer for all? Thorax 1995; 50: 1–2.
15. Berger H.J., Matthay R.A., Loke J., Marshall R.C., Gottschalk A., Zaret B.L. Assessment of cardiac performance with quantitative radionucleide angiocardiography: right ventricular ejection fraction with reference to findings in chronic obstructive pulmonary disease. Am. J. Cardiol. 1978; 41: 897–905.
Полный список литературы находится на нашем сайте: www.rmj.ru
Сальбутамола гемисукцинат (раствор для ингаляций) –
Сальгим (торговое название)
16. Gigliotti F., Gurrieri G., Duranti R., Gorini M., Scano G. Effects of intravenous broxaterol on respiratory drive and neuromuscular coupling in COPD patients. Eur.Respir.J. 1993; 6: 371–7.
17. Position Statement. Inhaled (2-adrenergic agonists in asthma. J.Allergy Clin.Immunol. 1993; 91: 1234–7.
18. Ziment I. The b2-agonist controversy. Chest 1995; 107(suppl.): 198–205.
19. Ziment I. Beta-adrenergic agonist toxicity: less a problem, more of a perception. Chest 1993; 103: 1591–7.
20. Ayres J.G., Benincasa C. Acute bronchoconstriction following the use of metered-dose inhalers in adult asthmatics. Thorax 1984; 49: 402–3.
21. Huchon G. Metered dose inhalers past and present: advantages and limitation. Eur.Respir.Rev. 1997; 7: 26–8.
22. Rodriguez-Roisin R. Acute severe asthma: pathophysiology and pathobiology of gas exchange abnormalities. Eur.Respir.J. 1997; 10: 1359–71.
23. Erjefalt I., Persson C.G. Pharmacologic control of plasma exudation into tracheobronchial airways. Am.Rev.Respir.Dis. 1991; 143: 1008–14.
24. Roca J., Felez M.A., Chung K.F., Barbera J.A., Rotger M., Santos C., Rodriguez-Roisin R. Salbutamol inhibits pulmonary effects of platelet activating factor in man. Am.J.Respir.Crit.Care Med. 1995; 151: 1740–4.
25. Muers M.F. Overview of nebulizer treatment. Thorax 1997; 52 (Suppl.2): 25–30.
26. Goodman D.E., Israel E., Rosenberg M., Johnston R., Weiss S.T., Drazen J.M. The influence of age, diagnosis, and gender on proper use of metered-dose inhalers. Am.J.Respir.Crit.Care Med. 1994; 1505: 1256–61.
27. Loffert D.T., Ikle D., Nelson H.S. A comparison of commercial jet nebulisers. Chest 1994; 106: 1788–93.
28. Douglas J.G., Rafferty P., Fergusson R.J., Prescott R.J., Crompton G.K., Grant I.W.B. Nebulized salbutamol without oxygen in acute severe asthma: how effective and how safe? Thorax 1985; 40: 180–3.
29. Cockcroft D.W. Management of acute severe asthma. Ann.Allerg.Asthma.Immunol. 1995; 75: 83–9.
30. Bradding P., Rushby I., Scullion J., Morgan M.D.L. As-required versus regular nebulized salbutamol for the treatment of acute severe asthma. Eur.Respir.J. 1999; 13: 290–4.
31. Fergusson R.J., Stewart C.M., Wathen C.G., Moffat R., Crompton G.K. Effectiveness of nebulised salbutamol administered in ambulances to patients with severe acute asthma. Thorax 1995; 50: 81–2.
32. Colacone A., Wolkove N., Stern E., Afilalo M., Rosenthal T.M., Kreisman H. Continuous nebulization of albuterol (salbutamol) in acute asthma. Chest 1990; 97: 693–7.
33. Moler F.W., Johnson C.E., Van Laanen C., Palmisano J.M., Nasr S.Z., Akingbola O. Continuous versus intermittent nebulized terbutaline: plasma levels and effects. Am.J. Respir.Crit.Care Med. 1995; 151: 602–6.
34. Pedersen S. Inhalers and nebulizers: which to choose and why. Respir.Med. 1996; 90: 69–77.
35. Raimondi A., Schottlender J., Lombardi D., Molfino N.A. Treatment of acute severe asthma with inhaled albuterol delivered via jet nebulizer, metered dose inhaled with spacer, or dry powder. Chest 1997; 112: 24–8.
36. Rodrigo C., Rodrigo G. High-dose MDI salbutamol treatment of asthma in the ED. Am.J.Emerg.Med. 1995; 13: 21–6.
37. Tonnesen F., Laursen L.C., Evald T., Stahl E., Ibsen T.B. Bronchodilating effect of terbutaline powder in acute severe bronchial obstruction. Chest 1994; 105: 697–700.
38. Swedish Society of Chest Medicine. High-dose inhaled versus intravenous salbutamol combined with theophylline in severe acute asthma. Eur.Respir.J. 1990; 3: 163–70.
39. Salmeron S., Brochard L., Mal H., Tenaillon A., Henry-Amar M., Renon D., Duroux P., Simonneau G. Nebulized versus intravenous albuterol in hypercapnic acute asthma. A multicenter, double-blind, randomized study. Am.J.Respir.Crit.Care med. 1994; 149: 1466–70.
40. Cheong B., Reynolds S.R., Rajan G., Ward M.J. Intravenous beta-agonist in severe acute asthma. B.M.J. 1988; 297: 448–50.
41. O’Connell M.B., Iber I. Continuous intravenous terbutaline infusions for adult patients with status asthmaticus. Ann.Allergy 1990; 64: 213–8.
42. Appel D., Karpel J.P., Sherman M. Epinephrine improves expiratory airflow rates in patients with asthma who do not respond to inhaled metaproterenol sulfate. J. Allergy Clin. Immunol. 1989; 84: 90–8.
43. Tveskov C., Djurhuus M.S., Klitgaard N.A.H., Egstrup K. Potassium and magnesium distribution, ECG changes, and ventricular ectopic beats during b2-adrenergic stimulation with terbutaline in healthy subjects. Chest 1994; 106: 1654–9.
44. Newhouse M., Chapman K., McCallum A., Abboud R., Bowie D., Holder R., Pare P., Mesic-Fuchs H., Molfino N. Cardiovascular safety of high doses of inhaled fenoterol and albuterol in acute severe asthma. Chest 1996; 110: 595–603.
источник
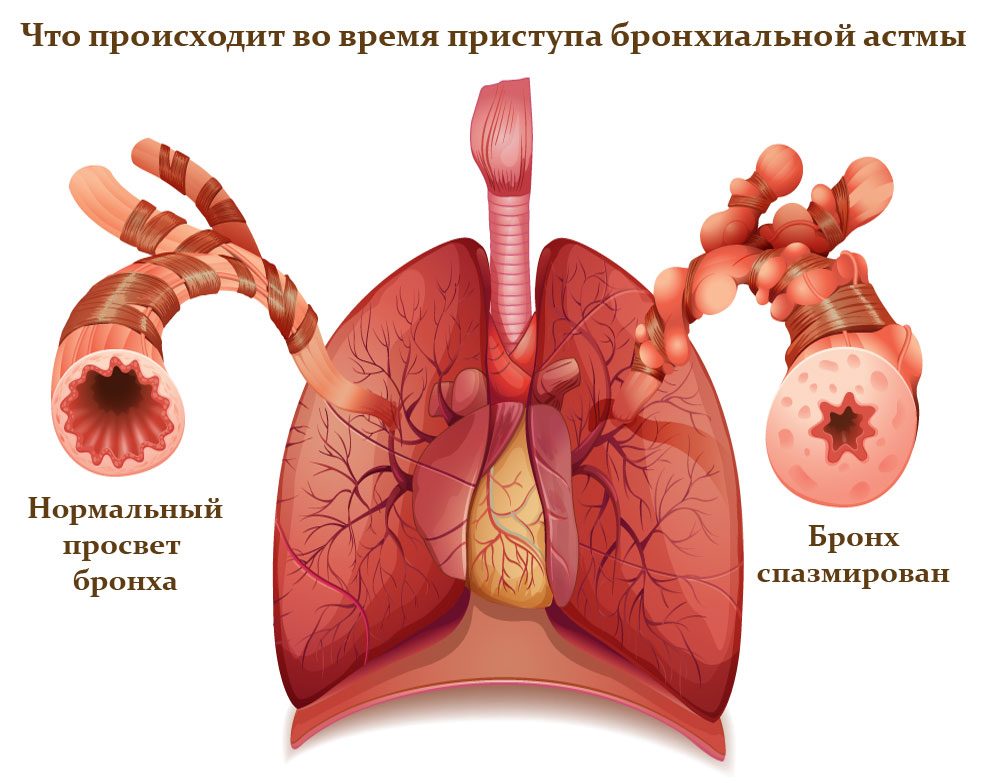
Симпатомиметики – группа лекарственных средств, которые используются для лечения бронхиальной астмы.
Они используются в экстренном порядке, при необходимости купировать спазмы в дыхательных путях, но также применяются и в базисной терапии для уменьшения астматических проявлений и в профилактических целях.
Во время приступа бронхиальной астмы происходит спазм гладкой мускулатуры в бронхах. За это отвечают β2-адренорецепторы, находящиеся в клетках мышечного слоя.
Симпатомиметики — препараты, которые, воздействуя на эти рецепторы, позволяют расширить бронхи и увеличить проходимость. Они выпускаются в виде баллончиков с аэрозолем для использования дозированными порциями, таблеток, растворов для инъекций.
Другое название этого класса лекарственных средств — адреномиметики непрямого действия. Для их воздействия имеется 2 мишени: β1-адренорецепторы и β2-адренорецепторы.
Если симптатомиметик воздействует на оба вида рецепторов, его называют неселективным. При избирательном действии на β2-рецепторы он является селективным. В свою очередь, этот тип делится на препараты длительного и короткого действия.
В настоящее время реже используются при лечении БА. Причиной стала высокая смертность из-за множественных побочных эффектов со стороны сердечно-сосудистой системы — тахикардии, гипертензии, нарушений ритма сердца. Это обусловлено тем, что большинство β1-рецепторов располагается в сердце. К ним относятся:
Они способствуют расширению бронхов, купируют приступ в течение 2-3 минут.
Нежелательные побочные явления чаще возникают при больших дозировках.
Используются для предотвращения и профилактики приступов астмы. Действие их длится в течение 12 часов. Эти средства назначаются в комбинации с другими препаратами: глюкокортикостероидами, стабилизаторами тучных клеток, лейкотриеновыми антагонистами.
Применяются в виде аэрозоля, для ингаляционной терапии, таблетированная форма показана при невозможности правильного использования ингалятора (дети). Средства длительного действия:
- формотерола фумарат;
- салметерола ксинафоат.
В базисную терапию эти препараты включают в целях уменьшения дозировки глюкокортикоидов или если не достигнут желаемый эффект от их применения.
β2-агонисты являются золотым стандартом лечения астмы, они показаны для купирования приступа бронхоспазма. При их применении эффект бронходилатации наступает через 5 минут, длится в течение 5-6 часов, поэтому принимать их в качестве профилактики смысла не имеет.
За сутки рекомендуется использование не более 4-5 раз, если превысить это количество, рецепторы прекращают реагировать, и результата от терапии нет. Наиболее часто назначаемые:
Дозу и кратность применения подбирают по индивидуальной схеме.
Симпатомиметики пролонгированного действия. Эффект длительного действия обусловлен тем, что молекулы лекарственного средства имеют высокую липофильность. Эта особенность позволяет им проникнуть в клетку мышцы и накапливаться там.
При необходимости активное вещество высвобождается и взаимодействует с рецепторами бронхов, вызывая расслабление мышц.
Долговременное воздействие препарата позволяет усилить контроль над ночными приступами астматического кашля. Улучшить функциональность дыхательной системы помогает бронхопротективный эффект.
Симпатомиметики короткого действия. Для оказания первой помощи во время удушья при бронхиальной астме необходимы средства, которые действуют мгновенно. Препараты имеют 2 механизма действия:
- Они не пропускают ионы кальция в клетку, вызывая расслабление гладкой мускулатуры. При этом затормаживается процесс высвобождения гистамина, лейкотриенов, которые обуславливают развитие аллергической реакции.
- Нормализуют выделение секрета в бронхах и улучшают выведение слизи из дыхательных путей. Способны предупреждать заболевания и состояния, вызванные гистамин-индуцированным спазмом: физическая нагрузка, приступ при вдыхании холодного воздуха.
Цель использования селективных симпатомиметиков в терапии бронхиальной астмы состоит в том, чтобы снять спазм мускулатуры бронхов, улучшить их проходимость и избежать побочных эффектов.
Формотерол — средство пролонгированного действия, используется для предотвращения приступов удушья. Выпускается в ингаляторе по 0,1 мг в дозе, применяется 2 раза в день, или 0,2 мг — назначается 3 раза в день. Действие его начинается через 5 минут, как и у лекарств с коротким действием. Эту особенность препарата пытались применить для снятия острых приступов, однако участились случаи смертности от бронхиальной астмы. Поэтому «по требованию» использовать не рекомендуют.
Сальметерол — бронхолитик, обладающий противовоспалительным эффектом. Снижает гиперреактивность бронхов, снижает их ответ на аллергены. Назначается в дозе 50 мкг 2 раза в сутки. Эффект появляется через 40 минут. Препарат разрешен к применению для детей старше 4 лет. В исследованиях было отмечено, что при изолированном приеме сальметерола участилось количество обострений и госпитализаций в год.
В связи с этим в протоколы лечения БА внесли корректировки о применении пролонгированных препаратов совместно с ингаляционными глюкокортикоидами. Так были созданы комбинированные средства. Это позволило уменьшить побочные эффекты со стороны обеих групп, уменьшить количество обострений бронхиальной астмы, усилить результат при лечении плохо контролируемой БА.
Сальбутамол — препарат выбора для устранения астматического приступа, используется преимущественно в виде ингаляции. Мелких бронхов достигает около 20% активного вещества. Максимальный эффект достигается через 20 минут после применения. В таблетированной форме он оказывает пролонгированный эффект и применяется для профилактики ночных обострений. Сопутствующие вирусные инфекции дыхательных путей могут снизить терапевтический эффект сальбутамола.
Фенотерол — является полным агонистом β2-адренорецепторов. Если превысить разовую или суточную дозу, симптомы повторяются через короткое время, возникает порочный круг. Это требует еще более частого применения средства.
Тербуталин — может усиливать эффективность других адреномиметиков. Противоаллергическое и бронхолитическое действие наступает через 30 минут. Применяется ингаляционно, подкожно и в таблетках.
Левалбутерол — относительно новый препарат, используемый для снятия обструкции дыхательных путей при астме. Предназначен для ингаляций при помощи небулайзера: детям старше 6 лет назначается по 0,63 мг 3 раза/сутки, взрослым — 1,25 мг 3 раза/сутки.
Изопреналин — бронхорасширяющий эффект достигается в течение 1-2 минут и сохраняется 3-4 часа. Назначается в ингаляционной форме с концентрацией 0,5% или 1%, по 0,2 мл на одну дозу. Таблетки с содержанием 0,005 мг активного вещества назначаются 3 раза в день.
Орципренолин — в отличие от изопреналина, действует на β2-рецепторы более избирательно, проявляется меньше побочных эффектов. Возможно его внутривенное применение по 0,5-1 мг при затянувшемся приступе бронхиальной астмы.
Большая часть β2-адренорецепторов находится в бронхах. У больных астмой их больше, чем у здоровых людей. Однако адренорецепторы есть и в других органах.
Этим обусловлено проявления различных побочных эффектов. В левом желудочке и правом предсердии, находится около 40% от общего количества рецепторов. При увеличении дозировки и нерациональном применении симпатомиметиков возникают нарушения в работе сердца:
- тахикардия;
- трепетание предсердий;
- ишемия миокарда;
- cердечная недостаточность;
- кардиомиопатия;
- аритмия, в том числе мерцательная;
- экстрасистолия;
- фибрилляция желудочков.
При действии на сосудистые рецепторы возможно их расширение и резкое снижение диастолического артериального давления.
Стимуляция рецепторов скелетных мышц вызывает тремор, мышечную слабость.
При системном применении симпатомиметиков (подкожно, внутривенно) возникают метаболические нарушения, которые проявляются увеличением содержания в крови глюкозы, инсулина, свободных жирных кислот.
Побочные эффекты со стороны нервной системы:
- головокружение;
- расстройство сна;
- кратковременные судорожные состояния;
- мигрень;
- расстройство вкусовых ощущений.
- тошнота;
- рвота;
- снижение аппетита;
- сухость слизистых оболочек полости рта.
Побочные действия в респираторных путях: адреномиметики редко могут вызывать усиление бронхоспазма после введения (фенотерол, сальбутамол), кашель, воспаление носоглотки.
Побочные эффекты дозозависимы и в большинстве случаев при умеренном использовании не проявляются. Однако риски возрастают во время оказания экстренной помощи, когда в течение нескольких часов дозировка превышается в 10 раз.
Возможность применения симпатомиметиков ограничивается рядом противопоказаний:
- Беременность и кормление грудью — официальных исследований с участием беременных не проводилось. Ограничение использования при патологических состояниях плода и матери: многоплодная беременность, внутриутробная инфекция, аномалии развития сердца, эклампсия, маточные кровотечения, отслойка плаценты. Назначение рассматривается индивидуально, если риск для матери превышает риск для плода.
- Патология сердца и сосудов — в связи с возможным влиянием и усугублением течения болезни не рекомендуются лекарственные средства из группы симпатомиметиков при атеросклерозе сосудов, тахиаритмии, стенокардии, неконтролируемой артериальной гипертензии, коронарной недостаточности, пороках сердца, легочной гипертензии.
- Прочие: феохромоцитома, доброкачественная гиперплазия предстательной железы, непереносимость или повышенная чувствительность к препарату, гипертиреоз, выраженные нарушения со стороны печени.
- Некоторые симпатомиметики абсолютно противопоказаны при возникновении астматическго статуса: орципреналин, левалбутерол, так как течение заболевания может осложниться их токсическим воздействием на сердце.
Корректное применение симпатомиметиков значительно улучшает качество жизни больных, помогает в жизнеугрожающих состояниях. Отсутствие эффекта при лечении бронхиальной астмы чаще всего объясняется недостаточной дозировкой или неправильным использованием ингалятора.
Необоснованное частое применение приводит к потере чувствительности к препарату, отсутствию ответа. Побочные явления могут привести к инвалидизации или смерти больного.
источник
Автор: Синицкий В.А. · Опубликовано 2018/01/13 · Обновлено 2018/01/14
Адреномиметики при бронхиальной астме разделяют на селективные (активируют исключительно бета-2 рецепторы) и неселективные (активируют бета-1 и бета-2 рецепторы). Активация бета-2 адренорецепторов способствует расслаблению гладкой мускулатуры бронхов и приводит к их расширению.
Адреномиметики при бронхиальной астме должны стимулировать именно бронхиальные бета-2-адренорецепторы, что приводит к активации аденилатциклазы и повышению уровня циклического аденозинмонофосфата (ц-АМФ) в гладкой мускулатуре бронхов. Помимо этого, адреномиметики слегка препятствуют высвобождению медиаторов бронхоспазма из тучных клеток. Что немаловажно при лечении бронхиальной астмы. Читайте подробнее на нашем сайте про другие адреномиметики.
Селективные адреномиметики в больших дозах помимо активации бета-2 рецепторов в бронхах, могут также активировать бета-1 рецепторы в сердце и альфа-адренорецепторы в сосудах. Основные побочные эффекты адреномиметиков, такие как повышение АД, тахикардия, связаны именно с этими рецепторами. Поэтому предпочтительнее принимать селективные, нежели неселективные адреномиметики при бронхиальной астме (о которых будем говорить ниже). Так как селективные возбуждают их только в больших дозах, а неселективные – в любых.
Селективные адреномиметики при бронхиальной астме назначаются в дозированных аэрозольных ингаляторах.
Небулайзеры применяются только у тех пациентов, которые не могут правильно использовать ингалятор (у детей)
Частицы адреномиметиков, которые вдыхаются через небулайзер в 3-4 раза больше, чем аэрозольные, поэтому дозы этих препаратов в небулайзерах, соответственно, в 3-4 раза в больше. Селективные адреномиметики при бронхиальной астме подразделяются на препараты длительного и короткого действия.
Основными препаратами, которые относятся к селективным адреномиметикам длительного действия (12 часов и более), являются:
Препараты характерны высокой липофильностью, что способствует их накоплению в мембранах гладкомышечных клеток. Благодаря этому обеспечивается длительность действия. Эту группу лекарственных средств чаще всего применяют при бронхиальной астме. А именно:
- в комбинациях с ингаляционными глюкокортикоидами, когда последние оказывают недостаточный эффект (например при появлении ночных приступов астмы);
- в комбинациях с глюкокортикоидами с целью снизить их дозу и этим избежать побочных эффектов;
- для профилактики приступов астмы физического усилия.
Такие ограничения в применении препаратов данной группы обоснованы повышением риска смерти от бронхиальной астмы. Селективные адреномиметики длительного действия нельзя резко отменять и использовать для монотерапии бронхиальной астмы, а также для купирования ее приступов.
Кленбутерол является препаратом допинга для спортсменов, так как обладает анаболическим эффектом.
Основные представители селективных адреномиметиков короткого действия (эффект длится 3-4 часа):
- тербуталин,
- фенотерол (беротек),
- сальбутамол (альбутерол),
- левалбутерол,
- битолтерол,
- метапротеренол (алупент),
- пирбутерол.
Препараты этой группы оказывают сильный, быстрый (в течение 5 минут) и кратковременный (3-4 часа) эффект. Селективные адреномиметики короткого действия являются самыми эффективными препаратами для купирования приступа бронхиальной астмы. Адреномиметики при бронхиальной астме применяются в форме аэрозоля, для того чтобы избежать системных побочных эффектов. При применении подкожно тербуталин может заменить эпинефрин (который относится к неселективным адреномиметикам, о нем читайте ниже) для купирования тяжелых приступов бронхиальной астмы.
Применение данной подгруппы для профилактики приступов бронхиальной астмы не рекомендовано, так как:
- они действуют кратковременно,
- при длительном применении может развиваться устойчивость к их бронхолитическому действию,
- повышается риск развития побочных эффектов.
К неселективным адреномиметикам при бронхиальной астме (активируют бета-1 и бета-2 рецепторы) относятся:
- изопреналин (изопротеренол, изадрин),
- эпинефрин (адреналин),
- эфедрин.
Препараты данной группы в настоящее время при лечении бронхиальной астмы применяются редко, так как чрезмерно сильно стимулируют сердечно-сосудистую систему посредством активации альфа и/или бета-1 адренорецепторов. Неселективные адреномиметики при бронхиальной астме оказывают следующие наиболее частые побочные эффекты:
- тахиаритмии,
- тремор,
- чувство тревоги,
- сердцебиение.
Врач общей практики. Автор 11 научных публикаций, нескольких внедрений в учебный и лечебный процессы. Призер республиканской научно-практической конференции молодых ученых.
источник