Несмотря на многие сходные проявления, сердечная астма и бронхиальная астма имеют отличительные признаки, позволяющие дифференцировать их друг от друга. Это важно для проведения правильной диагностики и назначения лечения, так как эти состояния в корне отличаются происхождением и требуют разных методов воздействия.
Оба вида проявляются приступами удушья, но вызываются они совершенно разными причинами. Сердечную форму нельзя считать самостоятельным заболеванием, так как она является следствием наличия у больного нескольких проблем с сердечно-сосудистой системой, приводящих к развитию сердечной недостаточности.
Бронхиальная астма – это отдельное заболевание, чаще всего аллергической природы, поражающее легкие и бронхи, но никак не связанное с сердечной деятельностью. В этом состоит основное отличие бронхиальной астмы от сердечной астмы. Для назначения лечения важно различать эти два состояния, так как воздействовать на них нужно различными методами и препаратами.
Грамотная диф. диагностика бронхиальной астмы и сердечной астмы помогает распознать картину заболевания и начать его лечение на самых ранних стадиях, задолго до развития осложнений.
Приступ сильного удушья, который возникает при различных кардиологических проблемах, принято называть сердечной астмой. Это состояние нужно вовремя распознавать, так как оно может сопровождать такое опасное для жизни больного заболевание, как инфаркт миокарда. Также приступ может развиться при разных типах пороков сердца, кардиосклерозе и других заболеваниях, сопровождающихся сердечной недостаточностью.
Сердечная форма астмы возникает как проявление недостаточности левого желудочка, вызванной застоем крови в малом круге кровообращения и отеком легких. Приступ развивается внезапно, начинаясь с одышки и переходя в сильный, надсадный кашель сухого типа, ощущением недостатка воздуха, страхом смерти и другими симптомами.
Больному нужна срочная помощь, добиться купирования приступа можно приемом нитроглицерина и других нитратов, а также иных препаратов по назначению врача. Так как причиной такого состояния может быть инфаркт, больному нужно вызвать скорую помощь и госпитализировать его.
Особенность бронхиальной астмы состоит в том, что это заболевание имеет воспалительную природу, поражает дыхательные пути и клеточные элементы. В основном эта болезнь имеет аллергическое или иммунологическое происхождение, сопровождается сильнейшими приступами удушья с характерными признаками.

При обследовании при подозрении на наличие такой астмы проводится бронхоальвеолярный лаваж. Это диагностический смыв нейтральным раствором легких и бронхов, исследование которого позволяет установить точную причину заболевания.
Отличие сердечной астмы от бронхиальной заключается в различной природе заболеваний и проявляется разными признаками:
-
Сердечная астма является следствием сердечной недостаточности, возникает при ишемической болезни, пороках, инфаркте миокарда, артериальной гипертензии. Развивается в основном в среднем и пожилом возрасте, сопровождается акроцианозом, то есть посинением максимально удаленных от сердца участков тела, отеками, при этом у больного холодные руки и ноги. При приступе больной предпочитает находиться в сидячем положении, ему не хватает воздуха, он издает влажные хрипы, словно внутри лопаются пузыри, у него выделяется обильная пенистая мокрота, которая указывает на ухудшение состояния. Если вовремя не принять меры, у пациента может развиться отек легких. Купировать приступ помогают нитраты, например, Нитроглицерин.
- Бронхиальная астма обычно начинается в раннем возрасте, может быть наследственным заболеванием, вызываться экологическими и профессиональными факторами. Она проявляется спазмом бронхов, при котором человек не может выдохнуть воздух. Состояние сопровождается свистящими хрипами, разлитым цианозом из-за нехватки кислорода, наличием малого количества прозрачной, стекловидной мокроты. Ее появление свидетельствует о завершении приступа. При нем больной старается находиться сидя или опираться на руки, его конечности остаются теплыми. Прием Нитроглицерина не улучшает состояния больного.Характерными отличиями при разных типах астмы является отхождение мокроты и тип удушья. При сердечной астме появление мокроты означает ухудшение состояния, а при бронхиальной – наоборот, завершение приступа с облегчением состояния больного. При сердечной форме больной никак не может вдохнуть воздух, а при бронхиальной – его выдохнуть.
Различия между заболеваниями очень важны, так как для лечения используются совершенно разные препараты и способы.
Дифференциальная диагностика сердечной и бронхиальной астмы предусматривает использование различных методов обследования. При подозрении на бронхиальное происхождение приступов применяются следующие способы обследования:
-
Спирометрия. Она позволяет оценить уровень обструкции и ее обратимости. При методике исследуется объем усиленного выдоха за секунду и форсированная жизненная емкость легких.
- Пикфлоуметрия помогает вычислить пиковую скорость выдоха, которая является на только способом диагностики, но и методом определения правильности назначенного лечения.
Кроме этих способов, больного опрашивают, узнают, имелись ли случаи заболевания в роду, осматривают, прослушивая легкие, отдают на анализ мокроту, сдают кровь, а также проводят различные аллергологические пробы.
Для выявления сердечной формы и ее дифференциации от других заболеваний со сходными признаками (астматического бронхита, стеноза гортани, уремической одышки, медиастинального синдрома, истерического припадка) применяются следующие методики:
- осмотр пациента;
- сбор анамнеза;
- ЭКГ;
- рентгенография области грудной клетки.
При сердечной астме присутствуют шумы при дыхании, но они все равно отличаются от звуков при бронхиальных проявлениях, позволяют уловить глухие тона сердца и разграничить проявления разных состояний.
После получения полноценных данных и выявления картины заболевания врач может поставить точный диагноз и начать правильное, целевое лечение. Так как сердечные приступы несут непосредственную опасность жизни пациента и могут быть проявлением инфаркта миокарда, при котором уровень выживаемости больных зависит от скорости госпитализации, человеку нужно обязательно вызывать «скорую помощь» для предотвращения ухудшения состояния.
Бронхиальная астма имеет хроническое течение и требует постоянного применения выписанных врачом препаратов, прохождения специализированного лечения для снижения частоты и тяжести приступов.
источник
В последние годы внимание исследователей всё больше привлекает проблема мульти- и коморбидности. Вероятность развития сочетанных заболеваний при увеличении продолжительности жизни повышается, что можно объяснить, как возрастными изменениями, так и отрицательными воздействиями окружающей среды и условий жизни в течение длительного времени.
Увеличение количества болезней с возрастом отражает, прежде всего, инволюционные процессы, а понятие коморбидности подразумевает детерминированную возможность их сочетанного течения, причём последнее изучено значительно меньше.
Имеется ряд общеизвестных сочетаний, таких как ишемическая болезнь сердца (ИБС) и сахарный диабет, артериальная гипертензия (АГ) и ИБС, АГ и ожирение. Но при этом всё чаще появляются указания на более редкие комбинации, например, язвенной болезни и ИБС, митрального стеноза и ревматоидного артрита, язвенной болезни и бронхиальной астмы (БА).
Изучение вариантов сочетанной патологии может способствовать более глубокому пониманию патогенеза болезней и разработке патогенетически обоснованной терапии. Это особенно важно по отношению к широко распространенным и социально значимым заболеваниям, к которым относятся в первую очередь заболевания сердечно-сосудистой системы (АГ, ИБС) и бронхолегочной системы (БА).
На возможность сочетания БА и АГ впервые в отечественной литературе указали Б.Г. Кушелевский и Т.Г. Ранева в 1961 г. Они рассматривали такое сочетание, как пример «конкурирующих заболеваний». Дальнейшие исследования показали, что распространенность артериальной гипертензии у пациентов с бронхообструкцией в среднем составляет 34,3 %.
Столь частое сочетание БА с АГ позволило Н.М. Мухарлямову выдвинуть гипотезу о симптоматической «пульмоногенной» гипертензии, признаками которой служат:
- повышение артериального давления (АД) у больных хроническими неспецифическими заболеваниями легких на фоне обострения болезни, в том числе у больных БА при приступах удушья;
- снижение АД по мере улучшения показателей функции внешнего дыхания на фоне применения противовоспалительных и бронхолитических (но не гипотензивных) препаратов;
- развитие АГ через несколько лет после начала заболевания легких, первоначально лабильной, с повышением АД только во время усиления обструкции, а затем — стабильной.
Ситуации, когда АГ предшествовала появлению БА и не имела связи с ухудшением бронхиальной проходимости, следовало расценивать как ГБ.
Изучая «пульмоногенную» АГ у больных бронхиальной астмой, Д.С. Каримов и А.Т. Алимов выделили в ее течении две фазы: лабильную и стабильную. Лабильная фаза «пульмоногенной» АГ, по мнению авторов, характеризуется нормализацией АД в процессе лечения обструктивной патологии легких.
Для стабильной фазы характерно отсутствие корреляции между уровнем АД и состоянием бронхиальной проходимости. Кроме того, стабилизация АГ сопровождается ухудшением течения легочной патологи, в частности снижением эффективности бронхолитических препаратов и учащением случаев развития астматического состояния.
С концепцией «пульмоногенной» АГ согласны В.С Задионченко и другие, считающие, что существуют патогенетические предпосылки для выделения такой формы симптоматической АГ, и рассматривающие в качестве одной из ее особенностей недостаточное снижение АД в ночное время.
Косвенным, но весьма веским аргументом в пользу «пульмоногенной» АГ служат результаты других исследований, доказавших роль гипоксии в развитии АГ у больных с синдромом обструктивных апноэ во время сна.
Однако всеобщего признания концепция «пульмоногенной» АГ все же не получила, и в настоящее время большинство исследователей склонны рассматривать повышение АД у больных БА как проявление гипертонической болезни (ГБ).
Для этого существует целый ряд достаточно веских причин. Во-первых, больные БА с повышенным и нормальным АД не отличаются между собой по форме и тяжести течения БА, наличию наследственной предрасположенности к ней, профессиональных вредностей и каким-либо иным особенностям основного заболевания.
Во-вторых, различия между пульмоногенной и эссенциальной АГ у больных БА сводятся во многом к лабильности первой и стабильности второй. Вместе с тем большая динамичность цифр АД и возможность их временного нахождения в пределах нормы у больных с предполагаемой пульмоногенной АГ могут быть проявлением ранних стадий ГБ.
Подъем АД в период приступа удушья объясним реакцией сердечно-сосудистой системы на стрессорное состояние, которым является приступ БА. При этом большинство больных БА с сопутствующей АГ реагируют ростом АД не только на ухудшение показателей проходимости дыхательных путей, но и на метеорологические и психоэмоциональные факторы.
В-третьих, признание пульмоногенной АГ отдельным заболеванием приводит к тому, что распространенность ГБ (эссенциальной гипертензии) среди больных БА становится в несколько раз ниже, чем в целом по популяции. Это вступает в противоречие с данными о значительной частоте наследственной предрасположенности к ГБ у лиц, страдающих БА.
Таким образом, вопрос о генезе АГ у больных БА в настоящее время окончательно не решен. Скорее всего, может иметь место как сочетание БА с ГБ, так и «пульмоногенный» генез стойкого повышения АД.
Однако механизмы, ответственные за повышение АД, в обоих случаях одни и те же. Одним из таких механизмов является нарушение газового состава крови вследствие ухудшения вентиляции альвеолярного пространства из-за наличия бронхообструктивного синдрома. При этом повышение АД выступает в роли своего рода компенсаторной реакции, способствующей увеличению перфузии и ликвидации кислородно-метаболического дефицита жизненно важных систем организма.
Известны как минимум три механизма прессорного действия гипоксической гипоксии. Один из них связан с активацией симпатико-адреналовой системы, второй — с уменьшением синтеза NO и нарушением эндотелий-завсимой вазодилатации, третий — с активацией ренин-ангиотензин-альдостероновой системы (РААС), играющей ключевую роль в регуляции уровня АД.
Гипоксия ведет к спазму приносящих артериол почечных клубочков, следствием чего становится снижение почечного кровотока и клубочковой фильтрации. Ишемия почек стимулирует продукцию ренина, что в конечном счете ведет к усиленному образованию ангиотензина II (АТ-II).
АТ-II обладает очень выраженным вазоконстрикторным действием и, кроме того, стимулирует выработку альдостерона, задерживающего в организме ионы натрия и воду. Результатом спазма резистивных сосудов и задержки жидкости в организме становится повышение АД.
Следует отметить и еще одно последствие активации РААС при обусловленной вентиляционными нарушениями гипоксической гипоксии. Дело в том, что ангиотензин-превращающий фермент идентичен ферменту кининазе-2, расщепляющему брадикинин до биологически неактивных фрагментов. Поэтому при активации РААС отмечается усиленный распад брадикинина, обладающего выраженным вазодилатирующим действием и, как следствие, повышение сопротивления резистивных сосудов.
Анализ литературных данных позволяет считать, что характерное для БА нарушение обмена биологически активных веществ может играть важную роль в развитии АГ. Показано, в частности, что уже на ранних стадиях БА выявляется повышение уровня серотонина в крови, который, наряду с бронхоконстрикторным, обладает слабым, но несомненным вазоконстрикторным действием.
Определенную роль в регуляции тонуса сосудов у больных БА могут играть простагландины, в частности, обладающие вазоконтрикторным действием ПГЕ 2-альфа, концентрация которого нарастает при прогрессировании заболевания.
Роль катехоламинов в развитии и/или стабилизации АГ у больных БА не вызывает сомнения, поскольку показано, что экскреция норадреналина и адреналина увеличивается во время приступа удушья и продолжает нарастать в течение 6–10 суток после его завершения.
Напротив, вопрос о роли гистамина в патогенезе АГ у больных БА (как, впрочем, и в патогенезе самой БА) остается предметом дискуссии. Во всяком случае, В.Ф. Жданов, во время изучения концентрации гистамина в смешанной венозной и артериальной крови, взятой у пациентов с бронхиальной астмой во время катетеризации полостей сердца, различий не выявил между группами с нормальным и повышенным АД.
Говоря о роли метаболических нарушений в развитии АГ у больных БА, нельзя забывать о так называемой нереспираторной функции легких. Лёгкие активно метаболизируют ацетилхолин, серотонин, брадикинин, простагландины, в меньшей степени — норадреналин и практически не инактивируют адреналин, дофамин, ДОФА и гистамин.
Кроме того, лёгкие являются одним из иcточников проcтагландинов, cеротонина, гиcтамина и кининов. В легких обнаружены ферменты, которые необходимы для cинтеза катехоламинов, проиcходит превращение ангиотензина-1 в ангиотензин-2, оcуществляется регулирование cвёртывающей и фибринолитической cистем, cистемы cурфактанта.
Патологические ситуации приводят к тому, что метаболическая функция лёгких нарушается. Так, в уcловиях гипокcии, искуcтвенно вызываемых воcпалительного процесса или отёка лёгких уменьшается инактивация серотонина и повышается его концентрация в cистеме циркуляции, интенcифицируется переход ДОФА в норадреналин.
При БА отмечено повышение концентрации норадреналина, адреналина и серотонина в биоптатах слизистой респираторного тракта. При определении концентрации катехоламинов в смешанной венозной и артериальной крови, взятой у пациентов с БА во время катетеризации полостей сердца и магистральных сосудов, установлено, что при сопутствующей АГ (в основном с лабильном течением) во вне обострения астмы усиливается способность лёгких к метаболизму норадреналина, т. е. к его захвату из циркулирующей в малом круге крови.
Таким образом, нарушение нереспираторной функции лёгких при БА может оказывать достаточно выраженное влияние на состояние системной гемодинамики, изучению которой посвящен целый ряд исследований.
По данным К.Ф. Селивановой и других, на состояние гемодинамики у больных БА оказывают влияние cтепень тяжести, длительноcть заболевания, чаcтота обоcтрений и выраженность органических изменений бронхолегочного аппарата.
Переcтройка центральной гемодинамики по гиперкинетическому типу отмечается на ранних cтадиях заболевания и при легком его течении. По мере прогрессирования болезни снижается величина сердечного выброса и возрастает периферическое сосудистое сопротивление, что характерно для гипокинетического варианта центральной гемодинамики и создает предпосылки для стойкого повышения АД.
Вопрос о роли лечения глюкокортикостероидами и симпатомиметиками в развитии АГ у больных БА остается открытым. С одной стороны, эти препараты фигурируют в списке причин развития ятрогенной АГ, с другой — имеются данные, что прием глюкокортикостероидов в терапевтических дозах не ведет к стойкому повышению АД у больных БА.
Более того, существует точка зрения, согласно которой лечение пациентов с БА и сопутствующей гипертонической болезнью системными глюкокортикостероидами в течение длительного времени оказывает не только бронхолитический, но и гипотензивный эффект за счёт снижения секреции эcтрадиола, повышения концентрации прогеcтерона и восстановления взаимодействия в системе «гипофиз — кора надпочечников».
Таким образом, взаимное отягощение и прогрессирование при сочетании бронхиальной астмы и артериальной гипертонии основано на общности некоторых звеньев патогенеза (нарушение легочной и сердечной микроциркуляции, развитие гипоксемии, легочная гипертензия и пр.). Это может приводить к прогрессированию сердечной недостаточности и раннему развитию кардиореспираторных осложнений.
Не вызывает сомнения, что в лечении артериальной гипертонии при бронхиальной астме оправданно назначение антигипертензивных препаратов, которые должны не только эффективно снижать артериальное давление, но и положительно влиять на функцию эндотелия, уменьшать легочную гипертензию, возможно, косвенно уменьшать степень системных воспалительных реакций при отсутствии негативных воздействий на респираторную систему.
Однако исследования последних лет показали, что высокий процент сердечно-сосудистой патологии у таких пациентов открывает огромную проблему, касающуюся профилактики и трудностей терапии при имеющейся бронхиальной астме.
Ишемическая болезнь сердца является одним из наиболее распространенных и тяжелых заболеваний сердечно-сосудистой системы. Более 10 млн трудоспособного населения РФ страдает ИБС, ежегодно 2–3 % из них умирают.
Сочетание ИБС с патологией лёгких, в частности с БА, не является казуистикой. Более того, имеются данные, что у больных БА распространенность ИБС выше, чем в общей популяции.
Частое сочетание ИБС и БА связано, по всей видимости, не столько с наличием общих факторов риска, сколько с «пересечением» патогенеза и, возможно, этиологии этих заболеваний. Действительно, ведущие факторы риска ИБС — дислипидемия, мужской пол, возраст, АГ, табакокурение и другие — не играют существенной роли в развитии БА.
Однако хламидийная инфекция может быть одной из причин развития как БА, так и ИБС. Показано, в частности, что в значительном проценте случаев развитию БА предшествует пневмония, вызванная хламидиями. В то же время имеются данные, указывающие на взаимосвязь между хламидийной инфекцией и атеросклерозом.
В ответ на хламидийную инфекцию происходят изменения иммунной системы, приводящие к появлению циркулирующих иммунных комплексов. Эти комплексы повреждают сосудистую стенку, вмешиваются в обмен липидов, повышая уровень холестерина (ХС), ХС ЛПНП и триглицеридов.
Показано также, что развитие инфаркта миокарда нередко связано с обострением хронической хламидийной инфекции, в частности бронхолёгочной локализации.
Говоря о «пересечении» патогенеза БА и ИБС, нельзя обойти молчанием роль лёгких в метаболизме липидов. Лёгочные клетки содержат системы, которые принимают активное участие в обмене липидов, осуществляя расщепление и синтез жирных кислот, триацилглицеринов и холестерина.
В результате лёгкие становятся своеобразным фильтром, снижающим атерогенность крови, оттекающей от органов брюшной полости. Заболевания легких существенно влияют на метаболизм липидов в лёгочной ткани, создавая предпосылки для развития атеросклероза, в том числе коронарного.
Однако существует и прямо противоположная точка зрения, согласно которой хронические неспецифические заболевания лёгких снижают риск развития атеросклероза или, по крайней мере, замедляют его развитие.
Имеются данные, что хроническая лёгочная патология ассоциируется с уменьшением содержания в крови общего холестерина (ХС) и ХС липопротеидов низкой плотности, при повышении концентрации ХС липопротеинов высокой плотности. Указанные сдвиги липидного спектра могут быть связаны с тем, что в ответ на гипоксию усиливается продукция гепарина, повышающего активность липопротеидлипаз.
Коронарный атеросклероз является важнейшим, но не единственным фактором, ответственным за развитие ИБС. Результаты исследований последних десятилетий свидетельствуют о том, что повышенная вязкость крови является независимым фактором риска многих заболеваний, в том числе и ИБС.
Высокая вязкость крови характерна для стенокардии, предшествует инфаркту миокарда и во многом определяет клиническое течение ИБС. Между тем хорошо известно, что у пациентов с хроническими болезнями органов дыхания в ответ на артериальную гипоксию компенсаторно увеличивается эритропоэз и развивается полицитемия с повышением уровня гематокрита. Кроме того, при лёгочной патологии нередко наблюдается гиперагрегация форменных элементов крови и как следствие — нарушение микроциркуляции.
В последние годы большое внимание уделяется изучению роли оксида азота (NO) в развитии заболеваний сердечно-сосудистой и бронхолегочной систем.
Началом «NO-истории» считается установленный в 1980 г. факт исчезновения вазодилатирующего действия ацетилхолина при повреждении эндотелия сосудов, что позволило высказать гипотезу о существовании продуцируемого эндотелием фактора, через который и реализуется действие ацетилхолина и других известных вазодилататоров.
В 1987 г. было установлено, что «производимый эндотелием релаксирующий фактор» является не чем иным, как молекулой оксида азота. Через несколько лет было показано, что NO образуется не только в эндотелии, но и в других клетках организма и является одним из главных медиаторов сердечно-сосудистой, дыхательной, нервной, иммунной, пищеварительной и мочеполовой систем.
На сегодняшний день известны три NO-синтетазы, две из которых (I и III типа) относятся к конститутивным, постоянно экспрессированым и продуцирующим небольшие количества (пикомоли) NO, а третья (II тип) является индуцибельной и способна в течение длительного времени продуцировать большие количества (наномоли) NO.
Конститутивные NO-синтетазы присутствуют в эпителии дыхательных путей, нервах и эндотелии, их активность зависит от присутствия ионов кальция. Индуцибельная NO-синтетаза содержится в макрофагах, нейтрофилах, эндотелии, микроглиальных клетках и астроцитах и активируется под действием бактериальных липополисахаридов, интерлейкина-1β, эндотоксинов, интерферона и фактора некроза опухолей.
Продуцируемый NO-синтетазой II типа оксид азота выступает в роли одного из компонентов неспецифической защиты организма от вирусов, бактерий и раковых клеток, способствуя их фагоцитозу.
В настоящее время NO признан достоверным маркёром активности воспаления при БА, поскольку обострение заболевания сопровождается параллельным увеличением количества выдыхаемого NO и активности индуцибельной NO-синтетазы, а также концентрации высокотоксичного пероксинитрита, являющегося промежуточным продуктом метаболизма NO.
Накапливаясь, токсичные свободные радикалы вызывают реакцию переокисления липидов клеточных мембран, приводят к расширению воспаления дыхательных путей за счет увеличения сосудистой проницаемости и появления воспалительного отека. Этот механизм называется «темной стороной» действия NO.
«Светлая сторона» его действия заключается в том, что NO является физиологическим регулятором тонуса и просвета дыхательных путей и в малых концентрациях препятствует развитию бронхоспазма.
Важнейшим источником оксида азота является эндотелий, продуцирующий его в ответ на так называемое «напряжение сдвига», т.е. деформацию эндотелиальных клеток под воздействием протекающей по сосуду крови.
Гемодинамические силы могут непосредственно действовать на люминальную поверхность эндотелиоцитов и вызывать пространственные изменения протеинов, часть которых представлена трансмембранными интегринами, связывающими элементы цитоскелета с клеточной поверхностью. В результате может изменяться цитоскелетная архитектоника с последующей передачей информации на различные внутри- и внеклеточные образования.
Ускорение кровотока ведет к возрастанию напряжения сдвига на эндотелии, усилению продукции оксида азота и расширению сосуда. Так функционирует механизм эндотелий-зависимой вазодилатации — один из важнейших механизмов ауторегуляции кровотока. Нарушению этого механизма отводят важную роль в развитии целого ряда заболеваний сердечно-сосудистой системы, в том числе и ИБС.
Известно, что способность сосудов к эндотелий-зависимой вазодилатации нарушается при обострении БА и восстанавливается в период ремиссии. Это может быть связано со снижением способности эндотелиальных клеток реагировать на напряжение сдвига из-за генерализованного дефекта клеточных мембран или нарушения внутриклеточных механизмов регуляции, проявляющихся уменьшением экспрессии ингибиторных G-белков, снижением метаболизма фосфоинозитолов и повышением активности протеинкиназы С.
Возможно, что в нарушении способности сосудов к эндотелий-зависимой вазодилатации при обострении БА играет роль и повышение вязкости крови, обусловленное повышением количества эритроцитов в ней, однако этот вопрос, судя по данным литературы, требует дальнейшего изучения.
Следует отметить, что в период обострения БА отмечается снижение способности сосудов не только к эндотелий-зависимой, но и к эндотелий-независимой вазодилатации. Причиной может быть снижение восприимчивости гладкомышечных клеток сосудов к вазодилатирующим стимулам из-за гипоксии, обусловленной прогрессированием вентиляционных нарушений при обострении болезни.
Уменьшение вентиляционных нарушений и, как следствие, нормализация газового состава крови в период ремиссии приводят к восстановлению чувствительности гладкомышечных клеток сосудов к действию вазодилататоров и восстановлению эндотелий-независимой способности сосудов к дилатации.
Еще одной «точкой пересечения» патогенеза ИБС и БА является лёгочная гипертензия. При бронхолёгочной патологии, в частности при БА, лёгочная гипертензия носит прекапиллярный характер, поскольку развивается вследствие генерализованного спазма легочных прекапилляров в ответ на снижение парциального давления кислорода в альвеолярном пространстве.
При ИБС, а точнее, при обусловленной этим заболеванием левожелудочковой недостаточности развивается посткапиллярная лёгочная гипертензия, связанная с нарушением оттока крови из малого круга кровообращения.
Независимо от механизма своего развития, лёгочная гипертензия повышает нагрузку на правый желудочек, что ведет к нарушению не только его функционального состояния, но и функционального состояния левого желудочка.
В частности, перегрузка правого желудочка давлением нарушает скорость и объем его диастолического наполнения, что, в свою очередь, может явиться причиной диастолической дисфункции левого желудочка. Между тем именно диастолическая дисфункция левого желудочка в 50 % случаев является причиной сердечной недостаточности.
Сложность патогенетических взаимоотношений между ИБС и БА предопределяет, по всей видимости, и многовариантность клинического течения этих заболеваний в случае их сочетания у одного и того же пациента.
Как правило, сочетанная патология отягощает друг друга, примером чего может служить развитие острых коронарных событий у больных ИБС на фоне обострения БА или ХОБЛ. Однако результаты некоторых исследований свидетельствуют о возможности принципиально иных взаимоотношений между бронхолёгочной и кардиальной патологиями.
Так, по данным И.А. Синопальникова и соавт., во время обострения БА происходит регресс проявлений сопутствующих ИБС как клинических, так и ЭКГ-признаков. После купирования обострения отмечается возврат коронарных симптомов, в частности учащение эпизодов транзиторной ишемии миокарда.
По мнению авторов, причиной этого может быть развитие на фоне обострения БА функциональной блокады β-адренорецепторного аппарата, обусловленной снижением внутриклеточной концентрации ц-АМФ. Следствием этого становится улучшение коронарной перфузии и снижение потребности миокарда в кислороде.
Как следует из вышеизложенного, вопрос о характере взаимовлияния бронхолёгочной и коронарной патологии можно считать спорным, однако тот факт, что хронические заболевания органов дыхания могут скрывать патологию сердечно-сосудистой системы, не вызывает сомнения.
Одна из причин этого — неспецифичность одного из ведущих клинических проявлений БА — одышки. Нельзя не согласиться с мнением о наличии немалых сложностей в клиническом прочтении синдрома одышки у больных с длительным анамнезом хронических заболеваний бронхолёгочной системы, сочетающихся с ИБС.
Одышка у таких больных может быть, как эквивалентом стенокардии, так и проявлением бронхообструктивного синдрома. Следует отметить, что патогенез бронхообструктивного синдрома в таких случаях весьма сложен, поскольку помимо первичной обструкции бронхов в его генезе могут участвовать и другие механизмы, в частности нарушение лёгочной гемодинамики вследствие левожелудочковой недостаточности с отеком лёгочного интерстиция и стенки бронхов.
По данным О.И. Клочкова, у больных БА гораздо чаще (от 57,2 до 66,7 %), чем в общей популяции (от 35 до 40 %), наблюдаются малосимптомные, в частности безболевые, формы ИБС. В такой ситуации возрастает роль инструментальных методов диагностики ИБС, в частности ЭКГ.
Однако интерпретация изменений конечной части желудочкового комплекса у больных с патологией лёгких вызывает затруднения, поскольку эти изменения могут быть связаны не только с коронарной патологией, но с метаболическими изменениями из-за гипоксии, гипоксемии и нарушения кислотно-основного состояния.
Аналогичные трудности возникают и при интерпретации результатов холтеровского мониторирования. В силу своей безопасности и достаточно высокой информативности этот метод получил весьма широкое распространение для диагностики ИБС вообще и безболевой ишемии миокарда в частности.
По данным А.Л. Верткина и других, эпизоды безболевой ишемии миокарда выявляются у 0,5–1,9 % клинически здоровых лиц. Данных о распространенности безболевой ишемии у больных БА в литературе обнаружить не удалось, что является косвенным свидетельством сложности интерпретации выявляемых у больных с бронхолёгочной патологией изменений на ЭКГ.
Интерпретацию последних затрудняет то обстоятельство, что дистрофические изменения миокарда, обусловленные лёгочной гипертензией и гипоксемией, могут отмечаться не только в правом, но и в левом желудочке.
Бессимптомное или атипичное течение ИБС становится причиной того, что внезапная смерть в половине всех случаев возникает у лиц, не имевших ранее признаков сердечно-сосудистых заболеваний. Это в полной мере относится и к больным БА.
По данным О.И. Клочкова, у таких больных в 75 % случаев смертность в пожилом и старческом возрасте наступает не от заболеваний бронхолегочной системы или их осложнений. В ряду внелегочных причин смерти этой категории больных безболевая ишемия миокарда составляла наибольший удельный вес (40,7 %).
Сочетание БА с коронарной патологией порождает серьёзные проблемы с медикаментозным лечением обоих заболеваний, поскольку препараты, наиболее эффективные при лечении одного из них, при другом оказываются либо противопоказанными, либо нежелательными.
Так, β-адреноблокаторы, будучи средством выбора при лечении ИБС, противопоказаны больным БА. Замена же их на блокаторы медленных кальциевых каналов (верапамил, дилтиазем) или на блокаторы If-каналов синусового узла (ивабрадин) не всегда позволяет достичь желаемого эффекта.
Облигатным компонентом лечения ИБС является назначение дезагрегантов, в первую очередь — ацетилсалициловой кислоты, прием которой может привести к обострению БА. Замена аспирина на другие дезагреганты не снижает эффективности лечения ИБС, но существенно увеличивает его стоимость.
Негативное влияние на течение ИБС могут оказывать многие препараты, необходимые для лечения БА. Так, глюкокортикостероиды (в том числе ингаляционные) способствуют повышению уровня ХС ЛПНП и прогрессированию атеросклероза. Между тем ингаляционные глюкокортикостероиды — наиболее эффективное противовоспалительное средство, отказаться от использования которого при лечении больных БА практически невозможно.
Сопутствующая ИБС делает крайне нежелательным использование теофиллинов в комплексной терапии БА. Теофиллины обладают не только бронхолитическим, иммуномодулирующим и противовоспалительным действием, но и оказывают выраженное влияние на сердечно-сосудистую систему, повышая потребность миокарда в кислороде и его эктопическую активность. Следствием этого может стать развитие тяжелых нарушений сердечного ритма, в том числе и жизнеугрожающих.
Отказ от использования теофиллинов из-за наличия у пациента сопутствующей ИБС не оказывает существенного влияния на эффективность лечения БА, поскольку в настоящее время не теофиллины, а β2-агонисты являются бронхолитиками первого ряда.
Как следует из названия, β2-агонисты оказывают избирательное стимулирующее действие на β2-адренорецепторы, следствием чего становится дилатация бронхов, улучшение мукоцилиарного клиренса, снижение сосудистой проницаемости и стабилизация мембран тучных клеток.
В терапевтических дозах β2-агонисты практически не взаимодействуют с β1-адренорецепторами, что и позволяет считать их селективными. Однако селективность β2-агонистов носит дозозависимый характер. При увеличении дозы препарата наряду с β2-адренорецепторами бронхов стимулируются и β1-адренорецепторы сердца, что ведет к увеличению силы и частоты сердечных сокращений и, как следствие, к повышению потребности миокарда в кислороде.
Кроме того, стимуляция β1-адренорецепторов вызывает повышение проводимости, автоматизма и возбудимости, что в конечном итоге ведет к повышению эктопической активности миокарда и развитию аритмий.
Представленные в литературе данные свидетельствуют, что у больных с обструктивными заболеваниями лёгких могут наблюдаться практически все виды нарушений сердечного ритма, в том числе и фатальные.
Именно нарушения ритма сердца зачастую определяют прогноз жизни таких пациентов. Этим, по всей видимости, и объясняется высокий интерес исследователей к проблеме сердечных аритмий у больных с патологией органов дыхания.
Характер нарушений сердечного ритма у больных БА детально проанализировала Е.М. Доля. По ее данным, у больных БА чаще всего встречаются синусовая тахикардия, предсердная и желудочковая экстрасистолия, предсердная моно- и многофокусная тахикардия и мерцательная аритмия.
Частота аритмий предсердного и желудочкового происхождения у больных с обструктивными заболеваниями легких увеличивается во время обострения основного заболевания, что существенно отягощает его течение.
К числу наиболее важных факторов, способных вызывать нарушения сердечного ритма при заболеваниях лёгких, относят гипоксемию и связанные с ней нарушения кислотно-щелочного и электролитного баланса, лёгочную гипертензию, ведущую к развитию лёгочного сердца, ятрогенные влияния и сопутствующую ИБС.
Роль артериальной гипоксемии в развитии нарушений ритма сердца у пациентов с хроническими неспецифическими заболеваниями лёгких была доказана еще в 1970-х гг. Гипоксемия вызывает гипоксию миокарда, что ведет к его электрической нестабильности и развитию аритмий.
Гипоксию миокарда усугубляют нарушения транспорта кислорода к тканям, связанные с повышением вязкости крови из-за вторичного эритроцитоза, развивающегося при хронической гипоксии.
Кроме того, гипоксемия сопровождается рядом системных эффектов, которые в конечном счете также способствуют появлению нарушений сердечного ритма. Одним из таких эффектов является активация симпатоадреналовой системы, сопровождающаяся повышением концентрации норадреналина в плазме крови из-за увеличения его выброса нервными окончаниями.
Катехоламины повышают автоматизм клеток проводящей системы сердца, что может вести к появлению эктопических водителей ритма. Под влиянием катехоламинов возрастает скорость передачи возбуждения от волокон Пуркинье на миокардиоциты, но может снижаться скорость проведения по самим волокнам, что создает предпосылки для развития механизма re-entry.
Гиперкатехоламинемия сопровождается активацией процессов перекисного окисления, что ведет к появлению большого количества свободных радикалов, стимулирующих апоптоз кардиомиоцитов.
Кроме того, активация симпатоадреналовой системы способствует развитию гипокалиемии, что также создает предпосылки для возникновения аритмии. Следует подчеркнуть, что аритмогенные эффекты катехоламинов резко возрастают на фоне гипоксии миокарда.
Активация симпатоадреналовой системы при гипоксемии ведет к развитию вегетативного дисбаланса, поскольку для БА как таковой характерна резко выраженная ваготония. Вегетативный дисбаланс, развивающийся на фоне обострения заболевания, может играть роль в развитии аритмий, особенно наджелудочковых.
Кроме того, ваготония ведет к накоплению цГМФ и, как следствие, к мобилизации внутриклеточного кальция из субклеточных структур. Повышение концентрации свободных ионов кальция может привести к появлению эктопической активности, особенно на фоне гипокалиемии .
Немаловажную роль в развитии нарушений сердечного ритма у больных с обструктивной патологией легких отводят лёгочной гипертензии, ведущей к гемодинамической перегрузке правых отделов сердца. Острая перегрузка правого желудочка может стать причиной развития эктопических аритмий из-за изменения наклона фазы 4 потенциала действия.
Стойкая или часто рецидивирующая лёгочная гипертензия ведет к гипертрофии правого желудочка, в то время как гипоксемия и токсическое действие продуктов воспаления способствует развитию дистрофических изменений в сердечной мышце. Результатом становится морфологическая и, как следствие, электрофизиологическая неоднородность миокарда, создающая предпосылки для развития разнообразных нарушений сердечного ритма.
Важнейшую роль в развитии нарушений сердечного ритма у больных БА играют ятрогенные факторы, в первую очередь приём метилксантинов и β-адреномиметиков. Аритмогенные эффекты метилксантинов, в частности эуфиллина, давно и хорошо изучены. Известно, что применение эуфиллина ведет к увеличению частоты сердечных сокращений и может провоцировать появление суправентрикулярных и желудочковых экстрасистол.
В экспериментах на животных показано, что парентеральное введение эуфиллина уменьшает порог возникновения фибрилляции желудочков, особенно на фоне гипоксемии и дыхательного ацидоза. Получены данные, свидетельствующие о способности эуфиллина вызывать многофокусную желудочковую тахикардию, создающую реальную угрозу жизни пациента.
Принято считать, что в терапевтических концентрациях теофиллины не вызывают нарушений сердечного ритма, однако имеются данные о том, что аритмии могут быть спровоцированы и терапевтическими дозами эуфиллина, особенно при наличии у пациента нарушений ритма в анамнезе.
Кроме того, следует учитывать, что в реальной клинической практике передозировка теофиллинов встречается достаточно часто, поскольку их терапевтический диапазон весьма узок (примерно от 10 до 20 мкг/мл).
До начала 1960-х гг. теофиллин был наиболее распространенным и эффективным бронхолитиком, использовавшимся при лечении больных БА. В 1960-е гг. для купирования бронхоспазма стали применяться ингаляционные неселективные адреномиметики, обладающие быстрым и выраженным бронхолитическим эффектом.
Широкое использование этих препаратов сопровождалось резким увеличением смертности среди пациентов, страдающих бронхиальной астмой в некоторых странах, особенно в Австралии, Новой Зеландии и Великобритании. Так, в Великобритании за период с 1959 по 1966 г. смертность среди больных БА в возрасте от 5 до 34 лет возросла в 3 раза, что вывело астму в первую десятку основных причин смерти.
В настоящее время считается доказанным, что эпидемия смертей среди больных БА в 1960-х гг. была обусловлена широким использованием неселективным адреномиметиков, передозировка которых провоцировала развитие фатальных аритмий.
Об этом говорит хотя бы тот факт, что число летальных исходов среди больных астмой возросло только в тех странах, где однократная доза ингаляционных симпатомиметиков превосходила рекомендуемую (0,08 мг) в несколько раз. Там же, где применялись менее активные симпатомиметики, например, в Северной Америке, смертность практически не увеличилась, хотя продажа данных препаратов возросла в 2–3 раза.
Эпидемия смертельных исходов, описанная выше, резко активизировала работы по созданию β2-селективных адреномиметиков, которые к концу 1980-х гг. из лечения БА неселективные адреномиметики и существенно потеснили теофиллины. Однако «смена лидера» не привела к решению проблемы ятрогенных аритмий у больных БА.
Известно, что селективность β2-агонистов является относительной и дозозависимой. Показано, например, что после парентерального введения 0,5 мг сальбутамола частота сердечных сокращений увеличивается на 20 сокращений в минуту, а систолическое АД возрастает на 20 мм рт. ст. При этом в крови увеличивается содержание МВ-фракции креатинфосфокиназы (КФК), что свидетельствует о кардиотоксическом эффекте β2-агонистов короткого действия.
Имеются данные о влиянии β2-агонистов на продолжительность интервала QT и продолжительность слабоамплитудных сигналов дистальной части комплекса QRS, что создает предпосылки к развитию желудочковых нарушений сердечного ритма. Развитию аритмий может способствовать и снижение уровня калия в плазме крови, обусловленное приемом β2-агонистов.
На выраженность проаритмического эффекта β2-агонистов оказывает влияние целый ряд факторов, начиная от дозы и способа их введения и заканчивая наличием у пациента сопутствующей патологии, в частности ИБС.
Так, в ряде исследований выявлена достоверная связь между частотой использования ингаляционных β-адреномиметиков и смертностью больных БА от фатальных аритмий. Показано также, что ингаляции сальбутамола с помощью небулайзера у пациентов с БА оказывают значительно более сильное проаритмогенное действие, чем при использовании дозирующего ингалятора.
С другой стороны, имеются данные, что ингредиенты, входящие в состав большинства ингаляционных препаратов, в частности фтористые углеводороды (фреоны), повышают чувствительность миокарда к проаритмогенному действию катехоламинов.
Роль ИБС в развитии аритмий у больных БА в принципе не вызывает сомнения, однако оценить ее «удельный вес» среди других аритмогенных факторов достаточно сложно. С одной стороны, известно, что распространённость аритмий у больных БА увеличивается с возрастом, что можно считать косвенным свидетельством участия ИБС в развитии аритмий у больных с обструктивной патологией лёгких.
Так, по данным одного из исследований, средний возраст больных БА, у которых были зарегистрированы аритмии, составил 40 лет, а средний возраст пациентов без нарушений ритма — 24 года. С другой стороны, по данным И.А. Синопальникова, во время обострения БА отмечается регресс клинической симптоматики ИБС, в том числе и нарушений сердечного ритма.
Следует отметить, что представление о «протективной» роли обострения БА в отношении коронарных событий не находит широкой поддержки. Большинство исследователей склонны считать, что ишемия миокарда, связанная с атеросклерозом коронарных артерий, может привести к развитию серьёзных нарушений сердечного ритма, в том числе фатальных.
Сама по себе БА представляет собой серьезную медико-социальную проблему, но еще более серьезной проблемой является сочетание БА с другими заболеваниями, в первую очередь с заболеваниями сердечнососудистой системы (артериальной гипертензией и ишемической болезнью сердца).
Взаимное отягощение и прогрессирование при сочетании бронхиальной астмы и артериальной гипертонии основано на общности некоторых звеньев патогенеза (нарушение лёгочной и сердечной микроциркуляции, развитие гипоксемии, лёгочная гипертензия и пр.). Это может приводить к прогрессированию сердечной недостаточности и раннему развитию кардиореспираторных осложнений.
Кроме того, высокий процент сердечно-сосудистой патологии у таких пациентов открывает огромную проблему, касающуюся профилактики и трудностей терапии при имеющейся бронхиальной астме.
Сочетание БА с коронарной патологией порождает серьезные проблемы с медикаментозным лечением обоих заболеваний, поскольку препараты, наиболее эффективные при лечении одного из них, при другом оказываются либо противопоказанными, либо нежелательными.
Роль ИБС в развитии аритмий у больных БА в принципе не вызывает сомнения, однако оценить ее «удельный вес» среди других аритмогенных факторов достаточно сложно.
Таким образом, взаимодействие заболеваний, возраста и лекарственного патоморфоза значительно изменяет течение основного заболевания, характер и тяжесть осложнений, ухудшает качество жизни больного, ограничивает или затрудняет лечебно-диагностический процесс.
источник
Симптомы таких болезней как сердечная и бронхиальная астма критически похожи и определиться с диагнозом трудно даже опытному врачу. Однако отличить приступ этих недугов – важнейшая задача, потому что эти разные болезни нуждаются в применении различных препаратов. Особенно это касается неотложной помощи.
Для ликвидации приступов БА категорически запрещено использовать наркотические анальгетики. Равносильным этому является использование адренергических медикаментов при приступе сердечной астмы (далее СА). Эти средства купируют приступ бронхиальной астмы, но не приносят абсолютно никакого результата при приступе сердечной. Чем быстрее врач определит отличие этих недугов и поставит правильный диагноз, тем успешнее будет лечение.
Краткое содержание статьи
Это болезнь не относится к самостоятельным, а лишь является последствием нарушений в работе сердца и сердечно-сосудистой системы в целом.
Среди причин можно выделить 8 основных заболеваний:
- Желудочковая тахикардия.
- Обширный инфаркт и прединфарктное состояние.
- Отрыв аневризмы.
- Ишемия и прочие нарушения кровотока миокарда.
- Гипертония с наличием кризов.
- Миокардит.
- Кардиомиопатия.
- Эндокардит.
Кроме дисфункций сердечно-сосудистой системы и сердца, в медицинской практике есть пациенты, у которых СА возникала в таких случаях:
- болезни почек;
- нерегулярные нагрузки на организм;
- инфицирование тяжелыми недугами (к примеру – пневмония);
- употребление наркотических и психотропных веществ;
- бронхиальная астма на запущенном этапе;
- нарушение психологического и эмоционального баланса;
- прединсультное состояние.
ВАЖНО! Если человек страдает ожирением и постоянными запорами, то он однозначно попадает в зону риска этого заболевания. Кроме того, беременные или родившие ребенка женщины в возрасте после 45 лет тоже могут приобрести СА.
Определить первопричину возникновения приступов сердечной астмы может исключительно специалист. Ведь возникать и проявляться этот недуг может абсолютно по-разному.
Если у больного выявлены нарушения в работе сердечно-сосудистой системы или обнаружены прочие серьезные заболевания, то особое внимание стоит уделить приступам сухого кашля. Ведь они присущи не только бронхиальной астме. Кроме того, нужно уделить внимание биохимическим процессам организма: их нарушения тоже сигнализируют о сердечной астме.
Приступ СА сопровождается тахикардией, слабым наполнением пульса и повышенным или пониженным давлением (см. базовый недуг). Причины сердечной недостаточности можно просмотреть при исследовании электрокардиограммы. Отличить сердечную астму от бронхиальной не составит труда в том случае, когда она проявляется типичными сигналами. Если приступы сопровождаются бронхоспазмом, то это затрудняет и запутывает отличие. Во избежание этого следует рассказать врачу о хронических недугах, аллергиях и патологиях легких.
Чтобы не допустить серьезных осложнений, нужно знать базовую симптоматику недуга, особенно если известно о сердечной недостаточности:
- Усиленное биение сердца с ощущением сдавливания в области груди.
- Нехватка кислорода и удушье.
- Одышка, психологическая неадекватность и учащенные вдохи ртом – все это присуще страху смерти.
- Облегчение состояния при принятии положения стоя или сидя.
- Обострение известных сердечных болезней.
Самыми распространенными причинами возникновения этого недуга являются инфекции дыхательных путей и вдыхание или употребление аллергенов. Среди аллергенов лидирующее место занимают:
- пыль бытовая;
- клещи пылевые;
- растительная пыльца;
- шерсть домашних питомцев;
- бытовая химия;
- пищевые продукты (шоколад, орехи и др.).
Наличие аллергенов или инфекций отягощают течение бронхиальной астмы, делают выход затрудненным, свистящим и хрипящим. В этом состоит одно из отличий бронхиального недуга от сердечного, ведь при приступе сердечной астмы пациент может свободно вдохнуть.
ВАЖНО! Это заболевание характерно для более молодого возраста, что обусловлено перенесением бронхитов, пневмоний и прочих серьезных болезней в детстве.
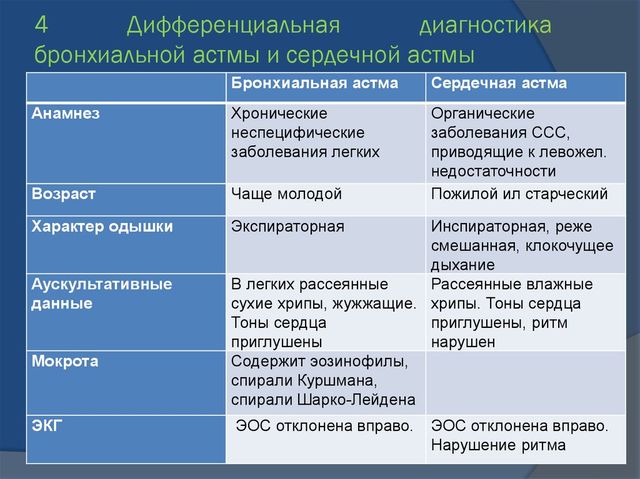
| Признаки | Бронхиальная астма | Сердечная астма |
|---|---|---|
| Анамнез | Хронические неспецифические заболевания легких, повторные пневмонии, аллергия | Болезни сердечно-сосудистой системы, приводящие к левожелудочковой сердечной недостаточности |
| Характер одышки | Экспираторная (затруднен выдох) | Смешанная |
| Вынужденное положение | Сидя или стоя с фиксированным плечевым поясом | Ортопноэ (вынужден сидеть) |
| Цианоз | Диффузный | Периферический |
| Тип грудной клетки | Эмфизематозная | Не изменена |
| Перкуссия легких (простукивание) | Коробочный звук | Притупление звука в нижних отделах легких |
| Аускультация легких (выслушивание) | Ослабленное везикулярное дыхание. Сухие свистящие хрипы | Ослабленное везикулярное дыхание. Влажные мелкопузырчатые не звонкие хрипы |
| Перкуссия сердца | Абсолютная тупость сердца отсутствует или уменьшена. Границы относительной сердечной тупости достоверно определить не удается | Абсолютная тупость сердца не изменена или увеличена. Левая граница относительной сердечной тупости смещена кнаружи |
| Аускультация сердца | Тоны сердца ослаблены, ритмичны | Тоны сердца ослаблены, тахикардия, часто ритм галопа аритмии |
| Мокрота | Слизистая, скудная, вязкая, стекловидная, содержит эозинофилы, спирали Куршмана, кристаллы Шарко-Лейдена, выделяется в конце приступа | Серозная, розовая, пенистая, жидкая (при альвеолярном отеке легкого), может содержать сидерофаги (“клетки сердечных пороков”) |
| ЭКГ | Отклонение электрической оси сердца вправо нагрузка на правое предсердие | Отклонение электрической оси влево, гипертрофия левого желудочка, признаки ишемии миокарда, аритмии |
♦ Приступы бронхиальной и сердечной астмы сопровождаются попаданием плазмы крови в легкие. Однако происхождение мокроты абсолютно разное: при приступе бронхиальной астмы мокрота попадает в легкие из-за сверхусилий работы правого желудочка сердца, а при сердечной – из-за недостаточного функционирования левого желудочка сердца.
Эти факты осложняют симптоматику заболеваний, однако болезни все равно нужно как можно раньше отличить друг от друга. Главные факторы для отличия недугов можно найти в анамнезе. Основное отличие заболеваний состоит в их первопричинах и возрастном цензе. Для бронхиальной – это бронхиты и воспаления легких в детском возрасте, а для сердечной – недуги сердечно-сосудистой системы в более зрелом возрасте.
♦ Второе отличие – это разный характер дыхания. В отличии от бронхиальной, где трудно выдохнуть, при СА наоборот трудно вдохнуть.
♦ Третье отличие заключается в различной локации хрипов при прослушивании. Влажные хрипы в нижних отделах легких присущи сердечному заболеванию, в то время как для приступов второго характерны сухие хрипы на выходе.
Только правильное отслеживание симптоматики и диагностирование болезни позволит избежать осложнений в течении недуга, а следовательно жизнь и здоровье больного будут в безопасности.
Честно говоря я не знала, что астма бывает бронхиальной и сердечной. Прочитав статью я так поняла, что их легко перепутать, а неуместное лечение может привести к летальному последствию. Тут говорится, что сердечная астма может проявляться при запущенном виде бронхиальной астмы. Задается вопрос, а как назначают терапию в данном обстоятельстве? Что нужно излечить первостепенно? Еще меня интересует одно, какое из этих заболеваний может передаватья генетически или формироваться еще в зародыше?
источник
Известно, что наиболее тяжкими осложнениями бронхиальной астмы являются те, которые возникают со стороны сердечно-сосудистой системы. Если сердце страдает слишком серьезно ввиду тяжести протекания астмы, игнорирования лечения, человек может стать инвалидом и утратить возможность жить нормальной жизнью.
Справа на рисунке изображен суженный бронх при астме.
Вылечить бронхиальную астму полностью невозможно, по крайней мере, современная медицина еще не придумала такой способ. Но можно взять под контроль то, как поведет себя болезнь, повлиять на ее исход. Люди, которые внимательно относятся к своему здоровью и имеютдиагноз «астма», что был поставлен на ранней стадии, ввиду чего и лечение было начато своевременно, могут годами не вспоминать, что эта болезнь у них есть. В отсутствие же лечения астма обостряется чаще, приступы удушья становятся длительными, тяжелыми и неконтролируемыми. Это приводит к нарушению работы не только органов дыхания, но и всего человеческого организма. Вслед за дыхательной системой страдает сердечно – сосудистая.
У больных бронхиальной астмой сердце начинает работать хуже, так как:
- во время обострения болезни возникает дыхательная недостаточность;
- во время приступа повышается давление в грудной клетке;
- побочные реакции со стороны сердца возникают ввиду систематического использования астматиками бета2-адреномиметиков.
У астматиков могут возникать такие осложнения со стороны сердечно–сосудистой системы:
- аритмии (от экстрасистол до фибрилляции желудочков);
- легочная гипертензия;
- острое и хроническое легочное сердце;
- ишемия миокарда.
Аритмия – это нарушение сердечного ритма во время приступов бронхиальной астмы и между ними. В норме сердце человека сокращается в синусовом ритме, то есть пульс составляет 60-90 ударов в минуту. Отклонения от синусового ритма в большую сторону называются тахикардией. Именно она наблюдается у астматиков во время приступа удушья, когда пульс учащается до 130-140 ударов. Между приступами в период обострения пульс держится по верхней границе нормы или выходит за нее (90-100 ударов в минуту). При этом может нарушаться не только частота, но и ритмичность сердечных сокращений. Чем более тяжелое течение принимает астма, тем более выраженной и длительной становится синусовая тахикардия.
Изменение сердечного ритма при бронхиальной астме обусловлено тем, что стремясь компенсировать недостаток кислорода из-за нарушенной функции дыхания, от которого страдают все ткани и органы в организме, сердцу приходится качать кровь быстрее.
Больной бронхиальной астмой с тахикардией может ощущать:
- Неровность работы сердца. Больные описывают это состояние как «сердце трепещет», «сердце вырывается из груди», «сердце замирает».
- Слабость, головокружение. Это общий симптом и для тахикардии, и для выраженной дыхательной недостаточности, которая развивается во время приступа удушья.
- Нехватку воздуха. Больные жалуются на одышку, чувство сдавленности в груди.
К счастью, синусовая тахикардия при бронхиальной астме случается нечасто. Обычно, у больных с таким осложнением имеются сопутствующие патологии со стороны сердечно-сосудистой и дыхательной систем. Тахикардия у астматиков требует дифференцированной терапии. Ввиду ее отсутствия возможно быстрое развитие сердечной недостаточности, увеличивается риск внезапной остановки сердца во время приступа удушья.
Собственно лечение нарушений сердечного ритма у больных астмой имеет два направления:
- Необходимо перевести заболевание-первопричину из фазы обострения в фазу стойкой ремиссии.
- Необходимо нормализовать работу сердца посредством кислородотерапии и приема медикаментов:
- бета-блокаторов (бисопролол, соталол, небиволол и другие);
- ингибиторов If-каналов синусового узла (ивабрадин, кораксан, пр.);
- растительных препаратов (боярышника, валерианы, пустырника), если у астматика нет на них аллергии.
Одной из наиболее частых причин развития приобретенной легочной гипертензии являются хронические болезни органов дыхания – бронхиальная астма, туберкулез, ХОБЛ, фиброз легких и другие. Заболевание характеризуется увеличением давления в легочной артерии, которое в состоянии покоя превышает нормальное на 20 мм ртутного столба, а при нагрузке – на 30 мм ртутного столба и более. Как и синусовая тахикардия, легочная гипертензия у астматиков имеет компенсаторный характер.
Симптомами легочной гипертензии являются одышка (присутствует в состоянии покоя и усиливается при физической нагрузке), сухой кашель, боль справа под ребрами, цианоз.
Это патологическое состояние также устраняется кислородотерапией. Для снижения давления в легочной артерии применяют:
- блокаторы медленных кальциевых каналов (нифедипин);
- аденозинергические средства (аминофиллин);
- диуретики (фуросемид).
Острое легочное сердце, или правожелудочковая недостаточность, часто развивается во время продолжительного приступа удушья или при астматическом статусе. Патология заключается в остром расширении правых отделов сердца (со снижением их сократительной функции) и легочной артерии. Развивается гипоксемия. Происходит застой в большом круге кровообращения. Легкие отекают, в их ткани происходят необратимые изменения.
Хроническое легочное сердце, характеризующееся крайней степенью дистрофии правого желудочка, часто несовместимо с жизнью, помочь не могут даже реанимационные меры.
Легочное сердце имеет такие симптомы:
- ощущение сдавливания в груди;
- ощущение нехватки воздуха;
- головокружение;
- отеки верхних, нижних конечностей, шеи, лица;
- рвота;
- скачки артериального давления;
- обморок.
Задачами лечения легочного сердца являются сохранение жизни больного, нормализация у него кровообращения. Для этого применяют консервативные и оперативные методы.
Консервативный метод включает в себя прием антикоагулянтов, бета-блокаторов, сосудорасширяющих препаратов. С целью облегчения состояние больного, ему назначают обезболивающие лекарства.
В отсутствие эффекта от медикаментозного лечения или по прямым показаниям больному проводят кардиологическую операцию.
Ишемическая болезнь сердца возникает в том случае, когда при бронхиальной астме нарушается кровоснабжение миокарда, в результате чего сердечная мышца получает кислород в недостаточном количестве.
Острой формой ишемии миокарда является инфаркт, хронический же патологический процесс проявляется в периодических приступах стенокардии.
Больной с ишемией жалуется на одышку, нарушение сердечного ритма, учащенный пульс, боль в груди, общую слабость, отеки конечностей.
Прогноз заболевания во многом зависит от того, насколько быстро и в полной мере больному была оказана медицинская помощь.
Лечение ишемии миокарда проводится препаратами, относящимися к трем группам:
- антиагреганты (клопидогрел);
- β-адреноблокаторы (бисопролол, карведилол);
- гипохолестеринемические препараты (ловастатин, розувастатин).
Выявить те или иные осложнения со стороны сердечно-сосудистой системы у человека с диагнозом «бронхиальная астма» только по их симптомам непросто потому, что они во многом схожи с симптомами основного заболевания. Поэтому необходимым становится применение дополнительных методов диагностики, таких как:
- Аускультация сердца.
- Электрокардиография.
- Эхокардиография.
- УЗИ.
- Рентгенологическое исследование.
Причиной смерти астматиков в подавляющем большинстве случаев являются именно сердечно–сосудистые заболевания. Поэтому с того момента, как человеку была поставлендиагноз бронхиальной астмы, возникает необходимость в осуществлении контроля над работой его сердца. Раннее выявление любых возможных осложнений со стороны этого органа в разы увеличивает возможность жить долго и полноценно.
источник
 Сердечная астма является следствием сердечной недостаточности, возникает при ишемической болезни, пороках, инфаркте миокарда, артериальной гипертензии. Развивается в основном в среднем и пожилом возрасте, сопровождается акроцианозом, то есть посинением максимально удаленных от сердца участков тела, отеками, при этом у больного холодные руки и ноги. При приступе больной предпочитает находиться в сидячем положении, ему не хватает воздуха, он издает влажные хрипы, словно внутри лопаются пузыри, у него выделяется обильная пенистая мокрота, которая указывает на ухудшение состояния. Если вовремя не принять меры, у пациента может развиться отек легких. Купировать приступ помогают нитраты, например, Нитроглицерин.
Сердечная астма является следствием сердечной недостаточности, возникает при ишемической болезни, пороках, инфаркте миокарда, артериальной гипертензии. Развивается в основном в среднем и пожилом возрасте, сопровождается акроцианозом, то есть посинением максимально удаленных от сердца участков тела, отеками, при этом у больного холодные руки и ноги. При приступе больной предпочитает находиться в сидячем положении, ему не хватает воздуха, он издает влажные хрипы, словно внутри лопаются пузыри, у него выделяется обильная пенистая мокрота, которая указывает на ухудшение состояния. Если вовремя не принять меры, у пациента может развиться отек легких. Купировать приступ помогают нитраты, например, Нитроглицерин. Спирометрия. Она позволяет оценить уровень обструкции и ее обратимости. При методике исследуется объем усиленного выдоха за секунду и форсированная жизненная емкость легких.
Спирометрия. Она позволяет оценить уровень обструкции и ее обратимости. При методике исследуется объем усиленного выдоха за секунду и форсированная жизненная емкость легких.
