
ГБОУ ВПО ОмГМА Минздрава РФ
Кафедра факультетской терапии с курсом профессиональных болезней
к.м.н., доцент НИКОЛАЕВ Николай Анатольевич
БРОНХИАЛЬНАЯ АСТМА – это хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы.
Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам или ранним утром.
Эти эпизоды обычно связаны с распространенной, но изменяющейся по своей выраженности обструкции дыхательных путей в легких, которая часто бывает обратимой либо спонтанно, либо под действием лечения
По данным ВОЗ, в мире БРОНХИАЛЬНОЙ АСТМОЙ страдают более 5% взрослых и 10% детей
ВАЖНЕЙШИЕ ФАКТОРЫ РАЗВИТИЯ АСТМЫ
1) ВНУТРЕННИЕ ФАКТОРЫ Генетические : например гены, предрасполагающие к атопии,
гены, предрасполагающие к бронхиальной гиперреактивности; Ожирение ; Пол .
2) ВНЕШНИЕ ФАКТОРЫ Аллергены :
аллергены помещений (клещи домашней пыли, шерсть домашних животных, аллергены тараканов, грибы, в том числе плесневые и дрожжевые); внешние аллергены: пыльца, грибы, в том числе плесневые и дрожжевые;
профессиональные сенсибилизаторы Инфекции (главным образом, вирусные) Курение табака (включая пассивное курение)
Загрязнение воздуха внутри и снаружи помещений
Наследственный компонент участвует в патогенезе БА, но весьма сложным образом. В настоящее время показано, что в патогенезе БА участвуют многочисленные гены, причем в различных этнических группах эти гены могут быть разными.
Поиск генов, связанных с развитием БА, сосредоточился на четырех крупных областях:
выработка аллергенспецифических антител класса IgE (атопия);
проявление бронхиальной гиперреактивности ;
образование медиаторов воспаления , например цитокинов, хемокинов и факторов роста;
определение соотношения между Th1 и Th2 опосредованными типами иммунного ответа (согласно гигиенической гипотезе развития БА)
Бронхиальная астма чаще встречается у людей, страдающих ожирением (индекс массы тела >30 кг/м2), и хуже поддается контролю.
У тучных больных БА в сравнении с больными БА с нормальной массой тела наблюдаются пониженная функция легких и больше сопутствующих заболеваний.
У пациентов с тяжелой БА применение системных ГКС и сидячий образ жизни могут способствовать развитию ожирения, однако в большинстве случаев ожирение предшествует развитию БА.
Мужской пол является фактором риска БА у детей.
У детей в возрасте младше 14 лет распространенность БА почти в два раза выше у мальчиков, чем у девочек.
По мере взросления половые различия сглаживаются, и у взрослых распространенность БА у женщин превосходит распространенность у мужчин.
Причины таких половых различий не установлены. Однако размеры легких при рождении у мальчиков меньше, чем у девочек, у взрослых наблюдается обратное соотношение.
У детей в возрасте до 3 лет сенсибилизация к аллергенам клеща домашней пыли, перхоти кошек и собак, а также к грибку рода Aspergillus является независимым фактором риска астматических симптомов.
Однако взаимосвязь между контактом с аллергеном и сенсибилизацией у детей носит непрямой характер. Она зависит от вида аллергена, дозы, длительности контакта, возраста ребенка и, вероятно, генетической предрасположенности.
Показано, что для аллергенов клещей домашней пыли и тараканов, частота сенсибилизации прямо коррелирует с длительностью контакта, а присутствие в доме тараканов является важным фактором аллергической сенсибилизации, особенно в городских домах.
Респираторно-синцитиальный вирус (РСВ) и вирус парагриппа формируют симптоматическую картину (включая бронхиолит), во многом напоминающую проявления БА.
С другой стороны, имеются сведения о том, что перенесѐнные в детстве корь и иногда даже РСВ инфекция, могут защищать от развития БА.
Паразитарные инфекции не защищают от БА, но инфицирование нематодами может снижать риск заболеваемости БА.
В соответствии с «гигиенической гипотезой» развития БА считается, что контакт с инфекциями в раннем детстве способствует развитию иммунной системы ребенка по «неаллергическому» пути, и снижает риск БА.
Известно свыше 300 веществ, взаимосвязанных с развитием профессиональной БА, которую определяют как БА, обусловленную контактом с аллергеном на рабочем месте.
К профессиональным сенсибилизаторам относятся вещества с низким молекулярным весом и высокой активностью, например изоцианаты – ирританты, способные вызывать бронхиальную гиперреактивность; соли платины, известные своей аллергенностью, а также сложные биологические вещества растительного и животного происхождения, стимулирующие выработку IgE.
Профессиональные сенсибилизаторы служат причиной примерно каждого десятого случая БА у взрослых трудоспособного возраста.
источник
При БА воспаление способствует развитию следующих состояний: гиперреактивность бронхов и бронхоспазм, отек дыхательных путей, гиперсекреция слизи. БА развивается в результате сложного взаимодействия двух основных групп факторов: факторы организма и факторы окружающей среды 1 .
Факторы организма: генетические факторы, атопия, гигиеническая гипотеза, эндокринные факторы, ожирение, сопутствующие заболевания, ухудшение функции легких.
Факторы окружающей среды: аллергены окружающей среды, воздействие, связанное с родом занятий, курение сигарет, вирусные инфекции 2 .
К факторам, провоцирующим обострения, относят вирусные инфекции, раздражители, применение лекарственных препаратов, воздействие холодного воздуха, физическая нагрузка, психологические факторы, обострения в анамнезе 1 .
Появление стойких свистящих хрипов и развитие БА у таких чувствительных пациентов могут вызывать различные провоцирующие факторы, например, инфекции нижних дыхательных путей 1,2 .
На сегодняшний день распространенность БА в мире оценивается в 339 млн., хотя она варьирует в различных странах и популяциях от 1 до 18% 2,3 . Согласно официальным данным, среди взрослого населения в России бронхиальной астмой страдает более 1,2 млн. человек (по состоянию на 2017 г.) 4 . В России распространенность БА среди взрослых — 6,9%, а среди детей и подростков — около 10% 5,6 .
Ежегодное количество смертельных случаев, связанных с БА в мире, оценивается как 250 000 несмотря на то, что смертность, по-видимому, не имеет прямой взаимосвязи с распространенностью заболевания 2,3 .
Снижение смертности, по мнению экспертов, связано с разработкой национальных и международных руководств и увеличением использования ингаляционных глюкокортикостероидов (ИГКС) содержащих препаратов 7 .
Смертность и заболеваемость, связанные с БА, влекут за собой существенные экономические потери, включая прямые затраты на лечение и непрямые затраты, связанные с уменьшением продуктивности труда. По оценкам ВОЗ, ежегодно БА обусловливает потерю 15 млн. так называемых DALY (Disability Adjusted Life Year — дословно «год жизни, измененный или потерянный в связи с нетрудоспособностью»), что составляет 1% от общего всемирного ущерба от болезней 2,3 .
В исследовании, проведенном в США, было показано, что по сравнению с пациентами с легкой астмой, затраты у пациентов с умеренной БА были примерно в два раза больше, а затраты для пациентов с тяжелой БА в 6 раз выше 7 .
ИГКС являются наиболее эффективными противовоспалительными препаратами для лечения БА любой степени тяжести. Лечение ИГКС, за счет подавления воспаления в дыхательных путях, позволяет ослабить симптомы астмы, улучшить качество жизни и функцию легких, уменьшить частоту и тяжесть обострений астмы, а также значимо снизить смертность, связанную с БА. У пациентов с недостаточным контролем астмы на низких дозах ИГКС добавление длительно действующих β2-агонистов (ДДБА) более эффективно, чем увеличение дозы ИГКС, в снижении частоты обострений, требующих применения пероральных стероидов, а также в улучшении показателей функции дыхания и уменьшении симптомов. Ингаляторы, содержащие фиксированные комбинации, гарантируют применение ДДБА только вместе с ИГКС и могут улучшать комплаентность пациентов 1,4,7 .
1. The Global Asthma Report 2018. Available online at: http://globalasthmareport.org/Global%20Asthma%20Report%202018.pdf Last accessed: February 2019.
3. Beasley R. The Global Burden of Asthma Report, Global Initiative for Asthma (GINA). Available from www.ginasthma.org; 2004.
4. https://www.rosminzdrav.ru/ministry/61/22/stranitsa-979/statisticheskie-i-informatsionnye-materialy/statisticheskiy-sbornik-2017-god.
5. Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы. [Электронный ресурс] 09.04.2019 http://spulmo.ru/download/Asthmarec3.pdf.
6. Министерство здравоохранения Российской Федерации. Общая заболеваемость всего населения России в 2012 году: стат. материалы, часть II. Департамент анализа, прогноза и инновационного развития здравоохранения ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава. — М., 2013. — 140 с.
7. Вафин А.Ю., Визель А.А., Шерпутовский В.Г. и др. Заболевания органов дыхания в Республике Татарстан: многолетний эпидемиологический анализ. Вестник современной клинической медицины. — 2016. — Т. 9, вып.1. — С.24—31.
Тяжелая астма, по определению экспертного совета по Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA) 2018 г., — это БА, которая требует лечения, соответствующего ступеням 4–5 терапии 1 (высокие дозы ИГКС совместно с ДДБА или антилейкотриеновыми препаратами/теофиллином) в предыдущий год или применения системных ГКС ≥50% предыдущего года для достижения и сохранения контроля или которая остается неконтролируемой, несмотря на эту терапию 2 . При этом контролируемая тяжелая БА будет ухудшаться при уменьшении высоких доз ИГКС или системных ГКС (или биологических препаратов), а неконтролируемая БА определяется наличием, по крайней мере, одного из следующих признаков:
- плохой контроль симптомов: ACQ >1,5; ACT
- частые тяжелые обострения БА: ≥2 курсов системных ГКС (продолжительностью >3 дней каждый) в предыдущий год;
- серьезные обострения: по крайней мере одна госпитализация, пребывание в отделении интенсивной терапии или механическая вентиляция в предыдущий год;
- ограничение бронхиальной проходимости: ОФВ1
Согласно данным Департамента мониторинга, анализа и стратегического развития здравоохранения ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России общая заболеваемость взрослого населения Российской Федерации бронхиальной астмой на 2017 г. составляет 1190917 человек 3 . Большинство пациентов, страдающих БА, хорошо отвечают на традиционную терапию достигая контроля заболевания. Однако, по международным данным приблизительно 5-10% от населения, страдающего БА имеют тяжелую БА 4,5 , лечение которых требует значительных расходов, достигающих по данным ряда авторов более 80% всех ресурсов здравоохранения, затраченных на терапию всей БА 6,7 . Именно у этих больных отмечается высокая частота обострений и обращений за неотложной медицинской помощью 7 . В приемных отделениях и отделениях неотложной помощи стационаров развитых стран на долю больных с обострением БА приходится до 12% всех поступлений, причем 20–30% больных нуждаются в госпитализации в специализированные отделения и около 4% больных — в отделения реанимации и интенсивной терапии. Около 5% всех больных с обострением БА требуют проведения интубации трахеи и искусственной вентиляции легких (ИВЛ), в случае проведения ИВЛ летальность больных достигает 7% 7 .
Ежегодное зафиксированное количество смертельных случаев, связанных с БА в мире, составляет 397 000 8,9 . Пациенты с тяжелой БА имеют повышенный риск смертности по сравнению с населением в целом и более легкой степенью тяжести БА, особенно если заболевание не контролируется 1,2,5,10 .
Тяжелым бременем для пациента и для системы здравоохранения являются ятрогенные осложнения вследствие необходимости длительного применения системных ГКС, тем более, что нежелательные эффекты суммируются с эффектами высоких доз ИГКС. Побочные эффекты системных ГКС всем хорошо известны и включают в себя ятрогенный остеопороз с переломами, повышение артериального давления, тромбоз, стероидную катаракту, стероидный диабет, стероидную язвенную болезнь с возможностью перфорации и кровотечения, атрофию кожи и подкожной жировой клетчатки, инфаркт миокарда, инсульт и многое другое 11 . ИГКС имеют доказанный благоприятный профиль безопасности, однако с увеличением дозы и длительности применения ИГКС (особенно старых поколений с высокой системной биодоступностью) растет риск развития всех системных класс-специфических нежелательных эффектов.
Затраты на лечение органных поражений, возникающих при длительном применении пероральных ГКС являются существенными. В исследовании Sarnes et al. в 2011 г. сообщалось, что ежегодные затраты на лечение нежелательных явлений системных ГКС у одного пациента с тяжелой БА составляли: до 21 824,68 долл. США для пептической язвы, 26 471,80 долл. США для нефатального инфаркта миокарда и до 18 357,90 долл. США на одно событие, связанное с переломом. Исследование также показало, что сокращение использования кортикостероидов, которое, в свою очередь, может снизить побочные эффекты, связанные с системными ГКС, может привести к экономии средств для систем здравоохранения 12 . Пероральные ГКС должны титроваться до минимальной поддерживающей дозы, а при необходимости длительного применения следует тщательно оценивать риск органных поражений. Эти рекомендации обусловлены опасениями относительно безопасности долгосрочного использования пероральных ГКС, особенно в средних и высоких дозах (более 5 мг в сутки) 13 .
Смертность и заболеваемость, связанные с БА, влекут за собой существенные экономические убытки, включая прямые затраты на лечение и непрямые затраты, связанные с уменьшением продуктивности труда. По оценкам ВОЗ, ежегодно БА обусловливает потерю 26,2 млн. так называемых DALY (Disability Adjusted Life Year — дословно «год жизни, измененный или потерянный в связи с нетрудоспособностью»), что составляет 1,1% от общего всемирного ущерба от болезней 8,9 . В исследовании, проведенном в США, было показано, что по сравнению с пациентами с легкой астмой, затраты на пациентов с тяжелой БА в 6 раз выше 14 .
Основная цель лечения БА любой степени тяжести – достижение и поддержание контроля над заболеванием. В связи с тем, что по меньшей мере у 40% пациентов с тяжелой БА отсутствует контроль над заболеванием на фоне приема высоких доз ИГКС/ДДБА 15 , большие надежды возлагаются на таргетную терапию, нацеленную на отдельные звенья патогенеза БА при разных фенотипах 15,16 . Данные пациенты нуждаются в новых подходах в лечении, которые основаны на понимании гетерогенности и типа воспаления при БА, который определяет фенотип астмы. Первоначально фенотипы астмы были сосредоточены на клинических характеристиках пациентов с БА. Фенотипы выделяемые GINA, как наиболее распространенные: аллергическая, неаллергическая БА, астма с поздним началом, БА с фиксированной бронхиальной обструкцией и БА ассоциированная с ожирением 1 . Однако с ростом понимания иммунопатологических механизмов, вызывающих заболевание, представления о фенотипах (или эндотипах) астмы эволюционировали. В настоящее время это дает возможность направить терапию на конкретный фенотип (или эндотип) воспаления и значимо помочь пациенту с тяжелой БА 1,18-20 . Описаны фенотипы БА на основе воспаления 21 : эозинофильная, нейтрофильная, смешанная и пангранулоцитарная БА. По данным Бельгийского регистра пациентов с тяжелой БА, выявлено, что 55% пациентов характеризуются эозинофильным типом воспаления дыхательных путей (эозинофилы ≥ 3%), у 21% больных определяется нейтрофильный фенотип (нейтрофилы ≥76%), у 18% — малогранулоцитарный и у 6% — смешанный фенотип воспаления дыхательных путей 22 .
В соответствии с международными и отечественными данными более половины пациентов с тяжелой астмой соответствуют фенотипу тяжелой эозинофильной БА 1,18,20 . Эозинофилия мокроты коррелирует с выраженностью симптомов, количеством обострений, тяжестью БА и снижением функции легких. Взрослые пациенты с тяжелой БА и эозинофильным воспалением подвержены более высокому риску обострений, постоянному ограничению воздушного потока и худшему прогнозу, чем пациенты тяжелой БА с нормальным уровнем эозинофилов в крови 23,24 . Кроме того, имеются данные, свидетельствующие о том, что обострения, связанные с эозинофильным воспалением дыхательных путей, являются более серьезными, чем без эозинофильного воспаления; что подтверждается значительно меньшим объемом форсированного выдоха за одну секунду (ОФВ1; р=0,03) и большей вероятностью необходимости дополнительного кислорода при поступлении (р = 0,002) 25 .
источник
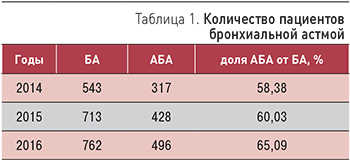
Цель исследования. Изучить распространенность, половозрастные особенности БА и ее атопической формы (АБА), выявить и проанализировать возможные их закономерности и тенденции на модели крупного многопрофильного учреждения первичной медико-санитарной помощи г. Москвы. Материалы и методы. Проведен анализ распространенности, половозрастных особенностей в структуре общей заболеваемости БА и АБА. Анализ заболеваемости проводили за 2014–2016 гг. Проведена статистическая обработка собранного материала и анализ полученных данных. Результаты. Отмечен рост распространенности БА и АБА. Абсолютное и относительное количество женщин, страдающих БА, стабильно больше, чем мужчин, а показатель распространенности при расчете на 1000 мужчин и 1000 женщин контингента выше среди пациентов мужского пола. БА встречается у пациентов всех возрастных групп. Выявлена тенденция к увеличению распространенности БА среди молодых пациентов и уменьшению среди лиц старческого возраста. Прослеживается четкая закономерность омоложения пациентов АБА. В будущем прогнозируется существенный рост распространенности БА в большей степени за счет атопической формы. Заключение. Полученные данные подтверждают продолжающийся рост заболеваемости БА преимущественно за счет АБА.
Всемирная организация здравоохранения (ВОЗ) считает бронхиальную астму (БА) одной из важнейших проблем общественного здоровья. Многие аналитики отмечают стойкую мировую тенденцию к нарастанию численности БА. Распространенность БА начала резко увеличиваться с 60-х гг. прошлого века в странах Западной Европы и Северной Америки, а спустя 20 лет и в странах Восточной Европы [1]. В 2011 г. уже 235 млн человек в мире страдало БА [2], в 2015 г. их количество достигло уже 358 млн [3], а к 2025 г., по мнению некоторых экспертов, это число может составить около 400–450 млн человек [1, 4]. На современном этапе тенденция по увеличению распространенности БА более выражена в развивающихся странах [5]. В странах с низким уровнем дохода населения наблюдается более высокий уровень смертности, связанный с БА [2].
В России также наблюдается тенденция к неуклонному росту распространенности БА. На это указывают и данные официальной статистики, и результаты эпидемиологических исследований отечественных ученых. Так, по информации Минздрава России, распространенность БА с 1991 по 1994 г. возросла на 32,3%, а с 1998 по 2002 г. – еще на 28,2% [6]. В последние годы также отмечен продолжающийся рост общей заболеваемости БА. С 2013 по 2014 г. общее количество зарегистрированных пациентов с БА в России увеличилось на 21 238 человек, в основном за счет пациентов Центрального и Южного федеральных округов [7]. В некоторых районах России только за последние 10 лет количество заболевших БА увеличилось в 1,6 раза [8]. Распространенность БА среди взрослого населения России составляет от 3,4 до 10,6%, [9, 10]. Согласно исследованиям GARD (Global Alliance against Respiratory Diseases – Глобальный альянс по борьбе с хроническими респираторными заболеваниями), распространенность симптомов БА значительно выше и составляет 25,7% [11]. В России смертность от БА составляет 2,3 на 100 000 населения [12]. По результатам исследования зарубежных авторов, этот показатель выше и составляет 6–10 случаев на 100 000 населения [1].
Цель исследования. Изучить распространенность, половозрастные особенности БА и ее атопической формы (АБА), выявить и проанализировать возможные их закономерности и тенденции на модели крупного многопрофильного учреждения оказания первичной медико-санитарной помощи г. Москвы.
На основе эпидемиологического наблюдательного описательно-оценочного (дескриптивного) исследования проведен анализ распространенности, половозрастных особенностей в структуре общей заболеваемости БА в целом и атопической ее формы (АБА) в частности. Эпидемиологическое исследование охватывает трехгодичный период (2014–2016). Собранный материал подвергался статистической обра.
- Masoli M., Fabian D., Holt S. et al. Global Initiative for Asthma (GINA) program: the global burden of asthma: executive summary of the GINA Dissemination Committee report. Allergy. 2004; 59: 469-478.
- World Health Organization. Fact Sheet Fact sheet No 307: Asthma. 2009. Archived from the original on June 29, 2011. Retrieved 30 September 2017
- Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016 ; 388 (10053): 1545–1602. DOI http://doi.org/10.1016/S0140-6736(16)31678-6
- Reddel H.K.; Hurd S.S.; FitzGerald J.M. World Asthma Day. GINA 2014: A global asthma strategy for a global problem. Int. J. Tuberc. Lung Dis. 2014, 18(5), 505–506. DOI: https://doi.org/10.5588/ijtld.14.0246
- Pocket Guide for Asthma Management and Prevention, Updated 2017. Available from: www.ginasthma.org Retrieved 30 September 2017
- Пульмонология. Национальное руководство. Краткое издание / под ред. А. Г. Чучалина. М. : ГЭОТАР-Мед, 2014. 800 с.
- Общая заболеваемость взрослого населения России в 2014 году. Министерство здравоохранения Российской Федерации. Департамент мониторинга, анализа и стратегического развития здравоохранения ФГБУ «Центральный научно-исследовательский институт организации и информатизации здравоохранения» Минздрава России. Статистические материалы, ч. IV. Москва, 2015 г.
- Бельтюков Е.К., Братухин К.П. Эпидемиология аллергического ринита и бронхиальной астмы в Свердловской области. Доктор.ру. 2015; 7(108): 11-14.
- Prata C., Marto J., Mouzinho L. et al. Epidemiologic study of bronchial asthma in schoolchildren from the Azores. Acta Med. Port. 1994; 10 (7): 541-544.
- Козлова О.С., Жестков А.В., Кулагина В.В. Бронхиальная астма в сочетании с аллергическим ринитом: клинико-функциональные и иммунологические особенности. Пульмонология. 2011;(1):70-73.
- Chuchalin A.G., Khaltaev N., Antonov N.S. et al. Chronic respiratory diseases and risk factors in 12 regions of the Russian Federation. International Journal of COPD. 2014; 9: 963–974.
- Экономика здравоохранения: учебное пособие / под ред. А. В. Решетникова. М. — ГЭОТАР-Мед, 2003. — 272 с.
- Vink N.M., Postma D.S., Schouten J.P., Rosmalen J.G., Boezen H.M. Gender differences in asthma development and remission during transition through puberty: the TRacking Adolescents’ Individual Lives Survey (TRAILS) study. J. Allergy Clin. Immunol, 2010, 126, 498–504
Дина Владимировна Ушакова, врач аллерголог-иммунолог, зав. отделением аллергологии и иммунологии, пульмонологии и инфекционных заболеваний ФГБУ «Поликлиника № 1» УДП РФ. Адрес: 119002, Россия, Москва, пер. Сивцев Вражек, д. 26/28. Е-mail: d.ushakova@vipmed.ru
Евгений Леонидович Никонов, д.м.н., профессор, начальник управления делами и координации деятельности Департамента здравоохранения города Москвы. 127006, Россия, Москва, Оружейный пер., д. 43.
источник
Бронхиальная астма (БА) является одним из наиболее распространенных аллергических заболеваний в детском возрасте. В структуре хронических заболеваний детского возраста удельный вес БА составляет от 8 % до 35 %. Распространенность БА в мире варьирует от 1,5 % до 8 %, достигая в экономически развитых странах 5-10 % [2]. Согласно данным экспертов Всемирной организации здравоохранения эпидемиологическая оценка распространенности БА, основанная на стандартизованных методах исследования, свидетельствует о тенденциях к ее росту. В России число больных БА в начале 90-х годов не превышало 1 %, а к концу 90-х годов увеличилось до 2-4 % в популяции [2; 5].
Высокий уровень распространенности БА во все периоды детства, включая детей старшего возраста, является частой причиной нарушения жизненной и физической активности ребенка, создающих социально–психологические проблемы в семье [3].
Многочисленными исследованиями, проводившимися в различных странах, в том числе в России, доказана связь между ростом заболеваемости БА и показателями загрязнения окружающей среды [1; 5]. Высокий уровень урбанизации сопровождается интенсивным ростом воздействия на человеческую популяцию экологических факторов, обладающих аллергенными свойствами. Ухудшение экологической ситуации и частые респираторные заболевания у детей способствуют ускорению эволюции астмы и формированию высокого уровня распространенности в популяции [4].
Учитывая высокую актуальность проблемы особое значение приобретают региональные исследования по изучению распространенности бронхиальной астмы. Особенно актуальны они для Республики Северная Осетия-Алания с высокой концентрацией предприятий перерабатывающей промышленности, деятельность которых оказывает негативное влияние на здоровье, усугубляющееся климатогеографическими особенностями республики [1]. Выявление неблагополучных по заболеваемости бронхиальной астмой районов позволит с учетом экологической ситуации планировать дифференцированные лечебно-профилактические мероприятия.
Цель исследования
Выявить региональные особенности распространенности бронхиальной астмы среди детского населения Республики Северная Осетия-Алания и определить их детерминированность факторами окружающей среды.
Материалы и методы исследования
В работе применены аналитический, статистический методы исследования. Проанализированы ежегодные статистические отчеты МЗ РСО-Алания (форма 12) за 2007-2014 гг., в которых представлены данные обращаемости в медицинские организации по поводу бронхиальной астмы у детского населения (от 0 до 17 лет). Экологическая характеристика атмосферного воздуха получена из материалов Государственных докладов «О состоянии окружающей среды и деятельности Министерства охраны окружающей среды РСО-Алания», а также управления природных ресурсов и охраны окружающей среды Министерства природных ресурсов РФ по РСО-Алания. Показатели общей и впервые выявленной заболеваемости рассчитаны на 100 тысяч детского населения. При анализе динамических рядов рассчитан темп прироста показателей за изучаемый период, вычислены среднемноголетние значения показателей по отдельным районам республики. Статистическая обработка полученных данных осуществлена на основе комплекса современных методов автоматизированного хранения и обработки информации на персональных компьютерах с использованием программы MS Excel и стандартного пакета прикладных программ SPSS (vers. 18).
Результаты исследования и их обсуждение
Результаты анализа полученных данных свидетельствуют о территориальной дифференциации заболеваемости детей бронхиальной астмой. Выявлена тенденция к росту показателя заболеваемости в трех сельских районах, которые, однако, характеризовались все годы относительно низкими значениями. Так, заметный рост общей заболеваемости отмечен в Ардонском районе (с 308,2 в 2007 г. до 448,3 в 2014 г.), темп прироста показателя за исследуемый период составил 45,5 %. В наиболее крупном, Пригородном районе, общая заболеваемость выросла с 269,9 в 2007 г. до 303,8 в 2014 г., темп прироста составил 12,6 %, а в Ирафском районе показатель вырос с 302,2 до 331,7, темп прироста составил 9,8 %.
Наряду с этим в пяти сельских районах за исследуемый период фиксируется благоприятные тенденции снижения общей заболеваемости БА: Кировском (с 372,3 до 186,0), темп убыли показателя составил 50,0 %; Правобережном (с 507,50 до 263,5), темп убыли показателя – 48,1 %; Алагирском (с 392,0 до 264,6), Моздокском (с 247,0 до 120,1), Дигорском (с 592,4 в 2007 г. до 463,2 в 2014 г.). В Моздокском и Дигорском районах темп убыли составил, соответственно 51,4 % и 21,8 %. Во Владикавказе заболеваемость снизилась с 725,5 в 2007 г. до 639,7 в 2014 г. Темп снижения составил – 11,8 %. Снижение общей заболеваемости отмечено так же в РСО-Алания в целом на 15,9 % (с 477,7 в 2010 г. до 424,3 в 2014 г.) (таблица).
Уровень общей заболеваемости бронхиальной астмой детей от 0-17 лет в РСО – Алания за 2007-2014 гг. (на 100 тыс. детского населения)
источник
Распространенность бронхиальной астмы и рецидивирующего обструктивного бронхита в детском возрасте
Наурызалиева Ш.Т., Байжанова М.М, Иманкулова К. Д (Научный центр педиатрии и детской хирургии МЗ РК, г.Алматы, Казахстан)
Изучение распространенности бронхолегочных заболеваний у детей, в том числе рецидивирующего обструктивного бронхита и бронхиальной астмы является одним из важнейших разделов современной пульмонологии детского возраста [1,2.3,4,5,6,7]. В структуре детской инфекционной заболеваемости болезни респираторного тракта занимают наибольший удельный вес (до 80%), причем до 60% в этой группе составляют бронхиты различной этиологии[8,9,10]. По имеющимся литературным данным первый эпизод бронхиальной обструкции более, чем у половины детей развивается во время острых респираторных заболевании (ОРЗ) на втором году жизни. Довольно часто бронхиты повторяются на 3-4 году жизни [11,12,13,14]. Высокой распространенности бронхитов в раннем возрасте способствуют анатомо-функциональные особенности дыхательной системы у детей, такие как интенсивное кровоснабжение, узкий просвет бронхов, медленное движение слизи в бронхах и низкий уровень местной системы иммунитета. Все это способствует быстрому истощению защитных механизмов и развитию воспалительного процесса в стенках бронхов или полной их обструкцией.
БА, являясь одним из наиболее распространенных хронических заболеваний, которому подвержены люди всех возрастных групп, рассматривается в современном обществе не только как крупная медицинская, но и социально значимая проблема. Увеличение распростаненности данного заболевания отмечают во многих странах – США, Англии, Новой Зеландии, Австрии, России. Как отмечается в Национальном Консенсусе, помимо высокой распространенности (при этом заболеваемость у детей опережает таковую у взрослых) и утяжеления болезни, характеризующейся прогрессирующим течением. Поэтому вопросы профилактики, эффективного лечения и повышения качества жизни больных БА являются актуальными для большинства стран мира [15,с.5;2,с.10]. Распределение по степени тяжести больных астмой, выявленных эпидемиологическими методами, выглядит следующим образом: 70%—легкая степень, 25% — средняя и 5% — тяжелая и существенно отличается от такового по данным официальной медицинской статистики, где легкие формы составляют около 20%, средней тяжести — 70% и тяжелые — 10% [15,с.8]. Астма — мультифакториальная болезнь и на ее распространенность и тяжесть течения влияют генетические факторы, микроокружение, климат, уровень развития общества, материальная обеспеченность, социальная и расовая принадлежность, а также до конца непонятные глобальные факторы. Для выявления роли каждого из них в эпидемиологии болезни необходимым условием является использование близких, желательно единых критериев и подходов в оценке частоты встречаемости астмы в различных странах и группах населения.
Определенные трудности в точной оценке распространенности БА у детей, особенно раннего возраста, представляют рецидивирующий кашель и свистящее дыхание. Изменения в классификации респираторных симптомов, произошедшие за последние годы, коснулись и этого вопроса; в частности, в рекомендациях Глобальной инициативы (GINA) и Национальной программы по бронхиальной астме (Россия) в педиатрии утверждается, что следует избегать у детей таких терминов, как рецидивирующий обструктивный бронхит (РОБ), синдром свистящих хрипов, астматический компонент при респираторно-вирусных инфекциях и т.п.; правильнее использовать термин «бронхиальная астма», что обосновывает назначение таким больным противоастматической терапии [16].
По некоторым данным на рецидивирующие обструктивные бронхиты из числа детей, состоящих на учете как часто болеющие, приходится до 20-25% [17], а иногда – и до 30% [18,19]. Эпидемиологические исследования последних лет с использованием современных критериев диагностики бронхиальной астмы позволяют считать, что рецидивирующие обструктивные бронхиты являются манифестацией бронхиальной астмы [20,21,22].
Причинами роста заболеваемости БА считаются следующие факторы [23,24]:
— увеличение числа детей, находящихся на искусственном вскармливании;
— изменение образа жизни («западный образ жизни»), что подразумевает наличие герметично закрытых окон, систем кондиционирования воздуха, ковровых покрытий и т.д., что приводит к повышению влажности и созданию условий для концентрации домашней пыли и других аллергенов в помещениях;
— увеличение распространенности курения среди матерей;
— изменение стереотипов ухода за ребенком — дети более рано начинают посещать детские дошкольные учреждения, где они более подвержены заболеваниям ОРВИ.
— воздействие аэрополлютантов, источником которых являются автомобильный транспорт, газовые плиты, открытые источники тепла.
Таким образом, обструкция дыхательных путей является следствием воспалительных изменений в бронхах мелкого калибра. Наиболее часто (90-95%) воспаление вызывается двумя патологическими состояниями: аллергией и инфекцией. В практической деятельности врача трудно различить, развивается ли бронхообструктивный синдром на основе инфекционного воспаления или является манифестацией БА.
В диагностике бронхообструктивных заболеваний особое место занимает исследование функции внешнего дыхания. В современной педиатрической практике широко используется у детей с респираторными симптомами исследование функции внешнего дыхания (ФВД). При заболеваниях бронхолегочной системы нарушения в системе внешнего дыхания могут быть обусловлены вентиляционной недостаточностью, изменением вентиляционно-перфузионных соотношений и диффузионными расстройствами. Обычно эти причины сочетаются при хронических заболеваниях респираторной системы, однако наиболее доступно для исследования изучение состояния вентиляционной функции легких, которая обеспечивает доставку кислорода из воздуха в легочные альвеолы и удаляет углекислый газ из альвеол в атмосферу. Для этого необходимо наличие достаточного количества функционирующих альвеол, а также отсутствие препятствия на пути воздуха до альвеол и обратно. В соответствии с механизмами нарушения вентиляции выделяют 3 формы вентиляционной недостаточности (ВН): обструктивную, рестриктивную и комбинированную.
Помимо статических легочных объемов обязательно исследуются динамически легочные объемы: форсированная жизненная емкость легких (ФЖЕЛ), объем форсированного выдоха за 1-ю сек (ОФВ1), их процентное соотношение ОФВ1/ФЖЕЛ), пиковая скорость выдоха (ПСВ), реже — максимальная вентиляция легких (МВЛ). Все исследуемые параметры выражаются в процентном отношении к должным величинам, которые рассчитываются индивидуально для каждого пациента с учетом их физического развития. Степень и форма ВН устанавливаются в зависимости от выраженности отклонений показателей (статических и динамических легочных объемов). Многолетние клинико-функциональные исследования детей с хроническими воспалительными заболеваниями легких показали, что течение этих заболеваний во многом определяется объемом поражения респираторных структур, характером изменений бронхов и частотой и тяжестью обострений. Поскольку хронический процесс в легких у детей, как правило, возникает в раннем возрасте, когда структуры респираторной системы (альвеолы, бронхи, сосуды) продолжают свою дифференцировку и развитие, поэтому компенсаторные возможности у детей гораздо выше, чем у взрослых. Вот почему нарушения функции внешнего дыхания у части детей отсутствуют даже при значительном поражении бронхолегочной системы.
Диагностику нарушений бронхиальной проходимости проводят на основании оценки легочных объемов (ФЖЕЛ и ОФВ1) и скоростных показателей (максимальных скоростных поток в отрезках выдоха 25,50 и 75% ФЖЕЛ, пиковой скорости выдоха). В современных приборах можно сопоставить несколько кривых поток-объем, на основании чего судят о правильности выполнения маневра. Наложение кривых или их тесное расположение дает представление о правильности выполнения маневра и хорошей воспроизводимости показателей. В процессе выполнения маневра форсированный выдох выполняется из положения максимального вдоха, при этом время выдоха не устанавливается в отличие от исследования взрослых пациентов. Сам форсированный выдох является функциональной нагрузкой, поэтому между попытками необходимо выдерживать паузы. Но даже в этих условиях редко, но можно наблюдать так называемую обструкцию от спирометрии, когда с каждым последующим маневром наблюдается уменьшение площади под кривой и соответственно снижение регистрируемых показателей. показатели выражаются в процентах от должной величины. Для оценки границ нормальных значений применяют персентильное распределение [25]. Анализ показателей кривой поток-объем (КПО) позволяет выявить нарушения бронхиальной проводимости, тяжесть или степень этих нарушений, а также уровень поражения бронхов: нарушения проходимости мелких (или периферических) бронхов, крупных (или центральных) бронхов или их сочетание (генерализованные нарушения). Вопрос об обратимости выявленной обструкции дыхательных путей решается с помощью тестов с ингаляционными бронхолитиками (бронходилататорами). Для правильной оценки теста, если пациент получает бронхолитики, их надо необходимо отменить до начала исследования:
1. бета2 агонисты короткого действия – за 6 часов;
2. бета2 агонисты длительного действия – за 12 часов;
3. пролонгированные теофиллины – за 24 часа.
При исходном исследовании функции легких у детей важно обращать внимание на воспроизводимость показателей: разница между максимальным и минимальным значением показателей ОФВ1 и ФЖЕЛ не должна превышать 5%. В случае плохой воспроизводимости кривой, а также у больных с симптомом бронхообструкции от спирометрии дальнейшая оценка прироста показателей будет затруднительна и необъективна. До настоящего времени нет единых подходов в оценке бронходилатационного ответа [25]. Общепринята оценка по абсолютному приросту величины ОФВ1. Это связано с тем, что при изучении воспроизводимости показателей кривой поток-объем наилучшая воспроизводимость оказалась у показателя ОФВ1.
Проблема рецидивирующего обструктивного бронхита остается актуальной не только в педиатрий, но и в терапевтической практике Практика свидетельствует, что под маской РОБ при выраженном обструктивном синдроме, могут скрываться не диагностированные другие хронические заболевания легких, в частности БА. К сожалению, при РОБ не существует единых подходов, не разработан алгоритмы диагностики и тактика реабилитации таких детей. Между тем своевременная дифференциальная диагностика БА и РОБ на тактику лечения и реабилитаций, и улучшает качество жизни больных детей.
Таким образом, БА и РОБ у детей является не только проблемой педиатрии. В настоящее время их решения относятся не столько к общемедицинским задачам, сколько к социально-экономическим. Разработка комплексного плана борьбы с этими заболеваниями возможна только на основе результатов массовых ЭИ, позволяющих получить достоверные, не зависящие от качества здравоохранения данные о распространенности болезни в различные возрастные периоды, распределении ее по степени тяжести, выяснить провоцирующие и приводящие факторы заболевания и установить основные причины ее поздней диагностики. Только на этом основании можно разработать наиболее оптимальные подходы к профилактике этой патологии в детском возрасте.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Turner – Warwik M. Can asthma be cured? // Clin.Exp.Allergy.- 1991.-Vol.21, suppl.1.- P.105-110.
2. Чучалин А.Г. Бронхиальная астма // Русский медицинский журнал.- 1995.-№ 2.- С. 7-10.
3. Debelic M. Besonderheitin des Asthmas bei Kindern und Jugendeichen //Atemwegs und Lungenkrankh.- 1992. – Bd. 18, № 1.-S.980-987.
4. Mutius E., Martines F. D. et. Al. Prevalense of Asthma and Atopy in Two Areas of West and East Germany //Am. J. Respir. Crit. Med.- 1994.- Vol.№ 149.- P.358-364.
5. Маланчиева Т.Г., Шамова А.Г. Распространенность и структура бронхиальной астмы среди детского населения //Сб.резюме 5-го Нац.Конгресса по болезныя органов дыхания.- М., 1995.- №1032.
6. Соколова Л.В. Диагностические ошибки при бронхиальной астме у детей // Пульмонология.- 2002- №1 – С.72-77.
7. Чучалин А.Г. Бронхиальная астма и астмаподобные состояния // Русский медицинский журнал. — 2002. – Т. 10, №5 – С. 232- 235.
8. Kelloway JS., Wyatt RA., Adlis SA. Comparison of patients` compliance with prescribed oral and inhaled asthma medication // Arch Int Med.- 1994.- №154.- P.1349 – 1353.
9. Busse W., Raphael GD., Galant S, et.al. Low-dose fluticasone propionate compared with montelukast for first-line treatment of persistent asthma: a randomized clinical trial //J Allergy Clin Immunol – 2001.- № 107 – P.461-468.
10. Carr W., Zeitel L., Weiss K. Asthma mortality in Russia between 1980-1989 // Eur.Respir. J.- 1999. — №13 (2). – P. 278-289.
11. Геппе Н.А., Малышев В.С., Селиверстов Н.А. и др. Бронхофонография в комплексной диагностике бронхиальной астмы у детей. //Пульмонология.- 2002.- №5.- С 33-39
12. Коровина Н.А. , Овсянникова Е.М., Данилова И.Е. Комплексная терапия обструктивного бронхита с применением фенспирида (Эреспала) у детей раннего возраста // Клиническая фармакология и терапия.- 2001.- №5.- С.-1-4.
13. Мизерницкий Ю.Л. Клинические варианты бронхообструктивного синдрома у детей раннего возраста // Вопросы охраны материнства и детства. – 1992.- № 6-7.- С. 18-22.
14. De Montis ., D. Berman. Y. Diof – on abahdonner le diagnostic de bronchite asthmatiform? // Ann. Pediatr. – 1989.- Vol. 36, № 6. – Р. 603-606.
15. Turner – Warwik M. Can asthma be cured? // Clin.Exp.Allergy.- 1991.-Vol.21, suppl.1.- P.105-110.
16. Чучалин А.Г. Бронхиальная астма // Русский медицинский журнал.- 1995.-№ 2.- С. 7-10.
17. Флетчер Р., Флетчер С., Вагнео Э. Клиническая эпидемиология. Основы доказательной медицины. – М,1998.- С.100.
18. Середа Е.В. Современная терапия при бронхитах у детей / Е.В. Середа // Детский доктор.- 2000.- Специальный выпуск.
19. Новиков П.Д., Новикова В.И. Бронхиты у детей /– Витебск, 1998. — 153с.
20. Самсыгина Г.А, Зайцева О.В. // Педиатрия. – М., 2000.- Приложение.
21. Malmstron K., Rodriguez-Gomez G., Guerra J., et.al. Oral montelukast, inhaled beclometasone, and placebo for chronic asthma: a randomized, controlled trial //Ann Intern Med. -199/- №130.- P.487-495.
22. Jaakkola JJ., Gissler M., Maternal smoking in pregnancy, fetal development, and childhood asthma, Am J Public Health.- 2004.- № 94 (1). – P. 136-140.
23. Новиков П.Д., Новикова В.И.. Бронхиты у детей /– Витебск, 1998.- 153с.
24. Артамонов Р.Г. Рецидивирующий бронхит. // Болезни органов дыхания у детей.- М., 1987.- С.246-253.
25. Огородова Л.М. Тяжелая бронхиальная астма у детей/ Л.М.Огородова // Consillium medicum: Приложение .-2001.- С. 25-33.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
«Астма — это когда ходишь в четверть шага, думаешь в четверть мысли, работаешь в четверть возможности и только задыхаешься в полную мощь»
К. Г. Паустовский
Бронхиальная астма (БА) относится к числу наиболее распространенных и социально значимых заболеваний человека. Так, среди взрослого населения европейских стран распространенность БА составляет 6–9%, в США — 11% [1–5]. Согласно официальной статистике, распространенность астмы в России составляет около 3%. В то же время результаты отдельных эпидемиологических исследований позволяют уточнить истинную распространенность БА в Москве — 6,4%, Екатеринбурге — 6,2%, Иркутске — 5,6%. Экспертами Российского респираторного общества признается, что распространенность БА среди детей составляет от 5,6 до 12,1%, а среди взрослых — 5,6–7,3%. В абсолютных цифрах можно предположить, что в России общее число больных БА составляет как минимум 7 млн человек [6, 7].
Проблема усугубляется тем, что больные БА нуждаются в продолжительной медицинской помощи, что требует больших экономических затрат. В развитых странах затраты на ведение пациентов с БА составляют 1–2% от бюджетных средств, выделяемых на здравоохранение. Экономическое бремя БА связано не только с высокими расходами на лечение, но и с затратами, связанными с потерей работоспособности и снижением качества жизни больных [1]. Согласно российским данным, общие расходы на ведение больных БА в 2007 г. составили более 11 млрд руб. [8]. Из них порядка 6 млрд руб. составляют расходы на оказание неотложной помощи и стационарное лечение пациентов в связи с обострением заболевания или ухудшением состояния недостаточно эффективной терапии. Очевидный рост затрат вследствие неадекватной базисной терапии подтверждается целым рядом исследований [9–11]. Таким образом, рациональный выбор терапии для достижения и поддержания контроля над клиническими проявлениями БА является чрезвычайно важной задачей [12–14].
Типичные симптомы БА, отмечаемые большинством пациентов, включают: экспираторную одышку, свистящее дыхание, кашель и заложенность в груди [12]. Наиболее часто симптомы БА проявляются ночью или сразу после пробуждения, а также после физической нагрузки, что зачастую приводит к ограничению физической активности пациентов. Важным этапом клинической оценки БА является оценка внелегочных проявлений аллергии — прежде всего аллергического ринита, конъюнктивита, атопического дерматита. Диагноз БА устанавливается на основании жалоб и анамнестических данных пациента, обследования с оценкой обратимости бронхиальной обструкции, специфического аллергологического обследования (кожные тесты с аллергенами и/или специфический иммуноглобулин класса Е (IgЕ) в сыворотке крови) и исключения других заболеваний. Важнейшим фактором диагностики является тщательный сбор анамнеза, который укажет на причины возникновения, продолжительность и разрешение симптомов, наличие аллергических реакций у пациента и его кровных родственников, особенности возникновения признаков болезни и ее обострений.
Начало заболевания БА в большинстве случаев приходится на детский и юношеский возраст. Однако дебют болезни может быть в любом возрасте, и начало болезни у взрослых и даже пожилых пациентов не является редкостью. Вместе с тем бронхообструктивный синдром, впервые развившийся в пожилом возрасте, требует проведения дифференциальной диагностики с целым рядом сходных по клиническому течению заболеваний (хроническая обструктивная болезнь, тромбоэмболия легочной артерии, острая левожелудочковая недостаточность, опухолевый процесс в легких и др.). Важно установить связь появления симптомов БА после контакта с аллергеном, сезонную вариабельность симптомов, сочетание с ринитом, наличие в семейном анамнезе атопии или БА. Иногда встречается кашлевой вариант БА, когда единственным проявлением заболевания является кашель, беспокоящий преимущественно в ночные часы.
Клинические признаки, повышающие вероятность наличия БА [12]:
- наличие более одного из следующих симптомов: хрипы, удушье, чувство заложенности в грудной клетке и кашель, особенно в случаях ухудшения симптомов ночью и рано утром; возникновение симптомов при физической нагрузке, воздействии аллергенов и холодного воздуха; возникновение симптомов после приема ацетилсалициловой кислоты или β-блокаторов;
- наличие атопических заболеваний в анамнезе;
- наличие астмы и/или атопических заболеваний у родственников;
- распространенные сухие свистящие хрипы при аускультации;
- низкие показатели пиковой скорости выдоха (ПСВ) или объема форсированного выдоха за 1 с (ОФВ1) (ретроспективно или в серии исследований), необъяснимые другими причинами;
- эозинофилия периферической крови, необъяснимая другими причинами.
Специальные методы диагностики БА включают исследование вентиляционной функции легких с оценкой обратимости бронхиальной обструкции, выявление бронхиальной гиперреактивности, проведение специфического аллергологического обследования. При проведении спирометрии важным параметром является ОФВ1, указывающий на степень бронхиальной обструкции. Бронходилатационный тест считается положительным, если после ингаляции бронходилататора величина прироста ОФВ1 составляет ≥12% от должного или абсолютный прирост составляет 200 мл и более (для заключения о положительном тесте обязательно достижение обоих критериев). У пациентов с показателями спирометрии в пределах нормы следует провести дополнительное исследование для выявления бронхиальной гиперреактивности — ингаляционный тест с метахолином. Тест является высокочувствительным, поэтому положительный результат является подтверждением БА. Мониторирование ПСВ используется для выявления повышенной суточной вариабельности показателей, характерных именно для БА (вариабельность показателей ПСВ или >30% в течение 1 сут). Характерным признаком БА является эозинофилия периферической крови (более 0,4×109/л), в анализах мокроты обнаруживаются также эозинофилы, кристаллы Шарко — Лейдена, спирали Куршмана. Среди дополнительных тестов стоит упомянуть аллергологическое обследование, позволяющее выявить чувствительность к различным аллергенам, определение общего и специфических IgE. Проба с физической нагрузкой используется для подтверждения БА у детей и подростков. После упражнений более чем у 90% детей с БА наблюдается снижение ОФВ1.
В зависимости от факторов, провоцирующих обострение, выделяют различные клинические формы БА: аллергическая (атопическая), аспириновая, астма физического усилия и др. Аллергические механизмы имеют преобладающее значение (
80% случаев) в развитии детской астмы и обнаруживаются более чем в 50% случаев у взрослых. Такая астма нередко сочетается с аллергическим ринитом, конъюнктивитом и дерматитом. Отмечается гиперчувствительность к различным аллергенам. Для аспириновой астмы характерна триада симптомов: БА, полипозный риносинусит и непереносимость нестероидных противовоспалительных препаратов. Астма физического усилия характерна для молодого и детского возраста (приступ бронхоспазма провоцируется физической активностью — ходьбой, бегом , причем симптомы возникают не во время действия фактора, а через 5–30 мин после него. Нередко провоцирующим фактором обострения БА является вирусная инфекция, поэтому говорят об астме. В ряде случаев выделить механизм не представляется возможным, поэтому в клинических диагнозах встречается термин «смешанная форма БА».
По степени тяжести БА делится на интермиттирующую и персистирующую (легкой, средней и тяжелой степени тяжести) (табл. 1).
В руководстве GINA (The Global Initiative for Asthma) в настоящее время рекомендована классификация БА по уровню контроля клинических признаков и характеристике внешнего дыхания (контролируемая, частично контролируемая и неконтролируемая БА) (табл. 2). Такой подход лучше описывает состояние болезни на фоне проводимых лечебных мероприятий, отражает понимание того, что тяжесть БА зависит не только от выраженности симптомов заболевания, но и от ответа на терапию.
Целями фармакотерапии БА являются достижение и поддержание клинического контроля над заболеванием в течение длительного периода времени с учетом безопасности терапии, потенциальных нежелательных реакций и стоимости лечения [12, 14–15]. Увеличение потребности в препаратах неотложной помощи, особенно ежедневное их использование, указывает на утрату контроля над БА и необходимость пересмотра терапии. Если текущая терапия не обеспечивает контроля над БА, необходимо увеличивать объем терапии до достижения контроля. В случае достижения частичного контроля над БА следует рассмотреть возможность увеличения объема терапии с учетом наличия более эффективных подходов к лечению, их безопасности, стоимости и удовлетворенности пациента достигнутым уровнем контроля. При сохранении контроля над БА в течение 3 мес. и более возможно уменьшение объема поддерживающей терапии с целью установления минимального объема терапии и наименьших доз препаратов, достаточных для поддержания контроля.
Фармакотерапия БА включает в себя 2 вида препаратов: препараты неотложной помощи (купирование бронхоспазма) и препараты для базисной («поддерживающей») терапии. К первым относятся β короткого и длительного действия (сальбутамол, фенотерол, формотерол), ингаляционные антихолинергические препараты (ипратропия бромид, тиотропия бромид). Препараты базисной терапии: ингаляционные глюкокортикостероиды (ИГКС) и системные кортикостероиды, комбинированные препараты (пролонгированные β + ИГКС), пролонгированные теофиллины, антагонисты лейкотриеновых рецепторов и антитела к IgE.
ИГКС являются препаратами первой линии в терапии БА, они показаны для лечения персистирующей БА любой степени тяжести [12–14]. ИГКС, составляющие основу базисной противовоспалительной терапии БА, предотвращают развитие симптомов и обострений болезни, улучшают функциональные показатели легких. Раннее назначение ИГКС может улучшить контроль БА и нормализовать функцию легких, а также предотвратить развитие необратимого поражения дыхательных путей. В клинической практике применяются следующие ИГКС: беклометазона дипропионат (БДП), будесонид, флютиказона пропионат, мометазона фуроат и циклесонид.
Отдельной строкой необходимо выделить, что в лечении среднетяжелой и тяжелой БА наиболее эффективной и перспективной является комбинация ИГКС и длительно действующего β (ДДБА) [12–14]. В настоящее время в клинической практике применяются следующие фиксированные комбинации ИГКС+ДДБА: салметерол+флутиказон, формотерол+будесонид, формотерол+беклометазон. По результатам ряда исследований показано, что комбинация ДДБА+ИГКС эффективнее увеличенных доз ИГКС, быстрее позволяет достигнуть контроля над симптомами БА, и при использовании комбинированного препарата отмечается снижение количества обострений. Так, исследование GOAL [16] продемонстрировало преимущества комбинированной терапии ИГКС+ДДБА в достижении контроля над симптомами заболевания при среднетяжелой и тяжелой БА по сравнению с монотерапией ИГКС. В авторитетном исследовании N. Barnes et al. было показано, что при персистирующей БА терапия с использованием комбинации флутиказон/салметерол оказалась более эффективной по сравнению с монотерапией флутиказоном [17]. В метаанализе, включившем более 20 тыс. пациентов с персистирующей БА, применение комбинированного препарата салметерол/флутиказон сопровождалось снижением риска обострений заболевания, риска госпитализаций по сравнению с монотерапией ИГКС [18].
Таким образом, в целом ряде клинических исследований было доказано, что добавление ДДБА к низким и средним дозам ИГКС обеспечивает лучший клинический эффект, чем увеличение дозы ИГКС, что в конечном итоге легло в основу современной стратегии ведения больных с БА [12–14].
Очевидно, что большим преимуществом фиксированных комбинаций является не только их высокая эффективность в достижении контроля над симптомами БА, но и хорошая комплаентность за счет соединения лекарственных средств в одном ингаляторе. Стоит отметить, что представленные на российском фармацевтическом рынке оригинальные комбинированные препараты обладают достаточно высокой стоимостью, но появление в настоящее время дженерических форм, безусловно, расширяет возможности их применения в реальной клинической практике.
Так, в начале 2015 г. в России зарегистрирован препарат Сальмекорт — фиксированная комбинация салметерол+флутиказон в форме дозированного аэрозольного ингалятора (ДАИ) в дозировках 25/50, 25/125 и 25/250 мкг. Клиническая эффективность и безопасность Сальмекорта в сравнении с оригинальным препаратом в форме аэрозоля для ДАИ изучались в рамках клинического исследования, включившего 107 больных с персистирующей БА и нуждающихся в комбинированной терапии высокими дозами ИГКС+ДДБА [19, 20]. Препараты применялись в дозе 25/250 мкг по 2 ингаляции 2 р./сут, продолжительность наблюдения за больными составила 12 нед. В группу больных, получавших Сальмекорт, вошли 56 пациентов, группу сравнения (оригинальный препарат) составил 51 больной с БА. В ходе исследования Сальмекорт продемонстрировал сравнимые с оригинальным препаратом эффективность и безопасность. Так, количество пациентов с положительным ответом на лечение по данным спирометрии составило 35 (64,81%) в группе Сальмекорта и 25 (49,02%) — в группе больных, получавших оригинальный препарат (табл. 3).
При анализе контроля над симптомами БА с использованием опросника АСТ — теста по контролю над астмой (Asthma Control Test) в обеих группах был отмечен значимый прирост показателей на фоне лечения, при этом количество пациентов с приростом оценки как минимум на 1 балл составило 45 в группе Сальмекорта и 40 — в группе сравнения (табл. 4).
В ходе исследования пациенты указывали на уменьшение общего количества приступов БА. При сравнительном анализе оказалось, что статистически значимое уменьшение общего количества приступов астмы наблюдалось в группе больных, получавших Сальмекорт. Анализ частоты развития нежелательных явлений не выявил статистически значимой разницы между группами. Нежелательные явления были зарегистрированы у 9 (16,1%) пациентов, получавших Сальмекорт, и у 3 больных (5,88%) в группе сравнения.
Таким образом, практические врачи располагает теперь более широкими возможностями для базисной терапии БА.
Возвращаясь к принципам терапии, необходимо отметить, что системные глюкокортикостероиды не рекомендуются для поддерживающей терапии БА развития побочных эффектов. Эти препараты применяются для лечения тяжелых обострений БА. Теофиллины длительного действия могут быть использованы в качестве препаратов второй линии у пациентов с персистирующей БА. — новый класс лекарственных средств, используемых в настоящее время для улучшения контроля над тяжелой персистирующей атопической БА. В числе наиболее изученных препаратов стоит упомянуть омализумаб. Его применение наиболее оправданно у больных с высоким сывороточным уровнем IgE, нуждающихся в повторных госпитализациях, экстренной медицинской помощи, применяющих высокие дозы ингаляционных и/или системных глюкокортикостероидов.
Для достижения контроля над симптомами БА рекомендован принцип ступенчатой терапии [12]. Каждая ступень включает варианты лечения, которые могут служить альтернативой при выборе поддерживающей терапии БА. У большинства больных с симптомами персистирующей БА, не получавших терапии, следует начинать лечение со ступени 2. Если симптомы БА при первичном осмотре указывают на отсутствие контроля (табл. 5), то лечение необходимо начинать со ступени 3. Если лечение неэффективно или ответ на него недостаточен, проверьте технику ингаляции, соблюдение назначений, уточните диагноз и оцените сопутствующие заболевания. При принятии решения, дозу какого препарата снижать первой и с какой скоростью, должны быть приняты во внимание тяжесть астмы, побочные эффекты лечения, продолжительность приема текущей дозы, достигнутый положительный эффект и предпочтения пациента. Снижение дозы ингаляционных стероидов должно быть медленным в связи с возможностью развития обострения. При достаточном контроле возможно снижение дозы каждые 3 мес., примерно от 25 до 50%.
источник
Опубликовано в журнале:
«ПРАКТИКА ПЕДИАТРА»; март-аперль; 2015; стр. 42-49.
С.Э. Цыпленкова, к. м. н., врач-пульмонолог, Обособленное структурное подразделение Научно-исследовательский клинический институт педиатрии ГОУ ВПО РНИМУ им. Н.И. Пирогова Минздрава РФ, г. Москва
Бронхиальная астма (БА) остается серьезной общемировой проблемой. Повсеместно люди всех возрастов страдают этим хроническим заболеванием дыхательных путей, которое при недостаточно эффективном лечении значительно ограничивает повседневную жизнь пациентов и даже приводит к смерти. Распространенность БА, особенно среди детей, неуклонно возрастает, что связывают как с ухудшением экологической ситуации, так и с более совершенной диагностикой. БА наносит значительный ущерб, связанный не только с затратами на лечение, но также с потерей трудоспособности и ограничением социальной активности.
Ключевые слова: бронхиальная астма, Глобальная стратегия лечения и профилактики бронхиальной астмы, уровни контроля, принципы самоконтроля, синдром сочетания бронхиальной астмы и хронической обструктивной болезни легких (ХОБЛ).
Key words: bronchial asthma, Global Initiative for Asthma (GINA), control levels, the principles of self-control, syndrome the combination of bronchial asthma and chronic obstructive pulmonary disease (ACOS).
На протяжении последних десятилетий представления о БА радикально изменились, появились новые возможности для ее своевременной диагностики и эффективного лечения. Однако многообразие систем здравоохранения в разных странах и различия в доступности препаратов для лечения БА обусловили потребность в адаптации наиболее эффективных и экономически оправданных рекомендаций по лечению БА к локальным условиям во всем мире. В связи с этим в 1993 году Национальный институт сердца, легких и крови (NIHLB, США) совместно со Всемирной организацией здравоохранения (WHO, ВОЗ) создал рабочую группу, результатом деятельности которой явился доклад «Глобальная стратегия лечения и профилактики бронхиальной астмы» (Global Initiative for Asthma, GINA (англ.)), чтобы обеспечить внедрение результатов современных научных исследований в стандарты лечения БА. Однако, несмотря на все меры по распространению рекомендаций GINA, многократно обновленных с тех пор, и наличие эффективных препаратов, данные международных исследований свидетельствуют о низком уровне контроля над БА во многих странах. В связи с этим в 2014 году появилась новая редакция GINA. В нижеприведенном обзоре этого документа уделено внимание основным позициям, претерпевшим принципиальные изменения со времени предыдущей редакции GINA.
Следует отметить, что GINA-2014, в отличие от прежних вариантов, является справочником для реальной клинической практики, основанным на принципах доказательной медицины, стандартизированных результатах лечения и профилактики БА, предназначенным для стран с разным уровнем развития.
Что же на сегодняшний день известно о бронхиальной астме? Прежде всего, БА — это хроническое заболевание, которое можно контролировать, но нельзя вылечить. БА — это гетерогенное заболевание, характеризующееся хроническим воспалением дыхательных путей. Характерные симптомы БА — свистящие хрипы, или визинг (от англ. wheezing), одышка, затруднение дыхания, чувство заложенности в груди, кашель, различные по времени появления, частоте и интенсивности, — связаны с вариабельным ограничением экспираторного (выдыхаемого) потока воздуха. Симптомы бронхиальной обструкции, обусловленные при БА бронхоспазмом, утолщением стенки дыхательных путей и увеличением количества слизи в просвете, могут появляться или усиливаться в ответ на вирусные инфекции, аллергены, курение, физическую нагрузку и стресс.
При первичном выявлении типичных для БА симптомов, согласно рекомендациям экспертов, необходимо провести детальный сбор анамнеза, клиническое обследование, спирометрию (или пикфлоуметрию) с тестом на выявление бронхиальной обратимости; при подтверждении диагноза БА показано назначение соответствующего лечения. В ходе обследования может быть верифицирован альтернативный диагноз и назначено пробное лечение предполагаемого заболевания. При нетипичной картине БА проводится тщательное дообследование, при невозможности подтверждения диагноза БА и исключении альтернативных диагнозов предлагается проведение эмпирической терапии ингаляционными глюкокортикостероидами (ИГКС) и коротко действующими бета-2-агонистами (КДБА) по потребности с оценкой эффекта через 1-2 месяца.
В ходе лечения БА рекомендуют регулярно проводить динамическую оценку эффективности терапии БА, которая складывается из показателей контроля симптомов за последние 4 недели и выявления факторов риска неблагоприятного прогноза БА, к которым относят в числе прочих низкие показатели функции дыхания. Контроль лечения БА также включает в себя проверку техники ингаляции и приверженности к лечению, выявление побочного действия препаратов, составление письменного плана действий для пациента после выяснения предпочтений и целей пациента в лечении БА.
Наличие дневных симптомов БА более 2 раз в неделю, ночных симптомов (пробуждения из-за БА); потребность в препаратах, купирующих приступы удушья, более 2 раз в неделю и ограничение активности из-за БА в совокупности определяют уровень контроля БА: при отсутствии симптомов диагностируется контролируемая БА; частично контролируемая БА предполагает наличие 1-2 признаков, неконтролируемая БА — 3-4 признаков. Следует отметить, что в GINA-2014 показатели ФВД исключены из оценки уровня контроля БА, их рекомендуют использовать при оценке факторов риска неблагоприятного прогноза.
Необходимо учитывать, что такие сопутствующие заболевания, как хронический риносинусит, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), ожирение, синдром обструктивного апноэ сна, депрессия, тревожные расстройства, всегда вносят вклад в симптоматику БА и ведут к снижению качества жизни, что требует соответствующих корректив в плане лечения таких пациентов.
Тяжесть БА в GINA-2014 рекомендуют оценивать ретроспективно (обычно после нескольких месяцев базисного лечения) исходя из объема терапии, необходимой для контроля над симптомами БА и ее обострениями. Особо подчеркивается, что степень тяжести БА непостоянна: она может изменяться с течением времени и в том числе под воздействием новых методов терапии.
Так, при легкой БА для пациентов с редкими симптомами (менее 2 раз в месяц) без сопутствующих факторов риска возникновения обострений на первой ступени терапии для купирования симптомов астмы рекомендуют коротко действующие бета-2-агонисты (КДБА), однако пока накоплено мало данных о безопасности монотерапии КДБА. Пациентам с легкой БА и высоким риском обострений показан регулярный прием низких доз ИГКС с КДБА по потребности (вторая ступень терапии), поскольку было показано, что низкие дозы ИГКС при легкой БА уменьшают симптомы и снижают риск обострений, госпитализаций и летальных исходов. В качестве альтернативы, особенно у пациентов с сопутствующим аллергическим ринитом или при отказе от лечения ИГКС, при легкой БА могут использоваться антагонисты лейкотриеновых рецепторов (АЛТР) или низкие дозы теофиллинов с КДБА по потребности. Однако в клинических исследованиях эффективность АЛТР и теофиллинов была достоверно ниже, чем при лечении низкими дозами ИГКС. При сезонных обострениях БА и отсутствии симптомов в межсезонье рекомендуют интермиттирующие курсы ИГКС и КДБА по потребности, причем предлагается начинать прием ИГКС сразу же при появлении первых симптомов и продолжать лечение еще 4 недели после окончания сезона цветения. Обращается внимание, что на каждом этапе перед принятием решения об увеличении объема терапии обязательна проверка техники ингаляции и приверженности лечению.
На третьей ступени терапии рекомендуется прием низких доз ИГКС в сочетании с ДДБА и КДБА по потребности (или низкие дозы будесонида/беклометазона + формотерол по потребности). Доказано, что такая терапия способствует уменьшению симптоматики и улучшению легочной функции, но при этом существенно не влияет на частоту обострений и довольно дорога. В то же время ДДБА уменьшают симптомы, снижают риск обострений, увеличивают ОФВ1 и позволяют уменьшить дозу ИГКС. Менее эффективной альтернативой является увеличение дозы ИГКС (до средних или высоких) или добавление АЛТР (или теофиллинов) к низким дозам ИГКС.
На четвертой ступени терапии используется комбинация средних или высоких доз ИГКС и ДДБА и КДБА по потребности (или по потребности низкие дозы ИГКС/формотерол); альтернативным является назначение высоких доз ИГКС в сочетании с АЛТР или низкими дозами теофиллинов (и КДБА или низкие дозы ИГКС/формотерол по потребности).
На пятой ступени терапии при недостаточной эффективности максимальных объемов ингаляционной противовоспалительной терапии рекомендовано добавление анти-IgE-препарата омализумаб (Ксолар) (и КДБА или низкие дозы ИГКС/формотерол по потребности). Альтернативой является назначение низких доз системных стероидов (менее 7,5 мг/с по преднизолону), что в целом способствует снижению риска обострений и в ряде случаев позволяет уменьшить дозу ИГКС, но при этом значительно увеличивает риск системных нежелательных явлений и требует тщательного мониторинга.
Важной проблемой остается недостаточный контроль над симптомами БА на фоне проводимой терапии. Для его улучшения предлагается регулярно оценивать технику ингаляций и приверженность пациентов к лечению. В сомнительных случаях необходимо тщательное повторное обследование для подтверждения диагноза БА; при нормальной легочной функции и наличии типичных жалоб рекомендуют на 2-3 недели сократить суточную дозу ИГКС вдвое с последующей оценкой симптомов и параметров внешнего дыхания. Очень важно устранить все факторы риска (курение, прием бета-блокаторов, нестероидных противовоспалительных препаратов, воздействие аллергенов), оценить и подобрать терапию сопутствующих заболеваний (ринит, ожирение, ГЭРБ, тревога, депрессия и т. д.). При сохранении симптомов нестабильной БА после тщательной оценки соотношения риска и пользы рекомендован перевод на следующую ступень терапии.
К долгосрочным целям лечения БА в GINA-2014 относят достижение хорошего уровня контроля симптомов и нормального уровня физической активности, минимизацию риска обострений, формирования фиксированной обструкции и нежелательных явлений лекарственной терапии. Достижение этих целей требует партнерства между пациентами и специалистами здравоохранения разного уровня. Выбор между препаратами для базисной терапии БА рекомендовано осуществлять согласно национальным руководствам и рекомендациям, основанным на данных об эффективности в клинических исследованиях и реальной практике, безопасности использования, доступности и стоимости. При выборе терапии для контроля симптомов БА и снижения риска неблагоприятного прогноза также необходимо учитывать индивидуальные особенности пациентов и их предпочтения. Следует принимать во внимание факторы риска или предикторы недостаточного ответа на терапию (курение, тяжелые обострения в анамнезе, сопутствующие заболевания и т. д.), практические навыки ингаляционной техники, приверженность лечению, доступность препаратов по стоимости.
Основным принципом стартовой терапии БА является раннее начало лечения сразу после установления диагноза. Низкие дозы ИГКС рекомендуют, если дневные симптомы БА возникают чаще 2 раз в месяц (ночные — чаще 1 раза в месяц) и сочетаются с факторами риска обострений. Старт с более высокой ступени терапии БА показан, если частота дневных симптомов выше (или ночные симптомы возникают чаще 1 раза в неделю), особенно при наличии факторов риска обострений. При дебюте БА с тяжелого обострения допустимо после короткого курса системных стероидов начать базисную терапию высокими дозами ИГКС (табл. 1) или ИГКС/ДДБА с последующим постепенным сокращением объема базисного лечения по мере стабилизации состояния.
Суточные дозы ингаляционных глюкокортикостероидов (с сопоставимой эффективностью) для пациентов с БА
| ИГКС | Суточная доза (мкг) (старше 12 лет) | Суточная доза (мкг) (6-11 лет) | ||||
| низкая | средняя | высокая | низкая | средняя | высокая | |
| Беклометазона дипропионат (CFC) | 200-500 | >500-1000 | >1000 | 100-200 | 200-4000 | >400 |
| Беклометазона дипропионат (HFA) | 100-200 | >200-400 | >400 | 50-100 | >100-200 | >200 |
| Будесонид (ДПИ) | 200-400 | >400-800 | >800 | 100-200 | >200-400 | >400 |
| Будесонид (суспензия для инг.) | 250-500 | >500 | >1000 | |||
| Циклезонид (HFA) | 80-160 | >160-320 | >320 | 80 | >80-160 | >160 |
| Флутиказона пропионат (ДПИ или HFA) | 100-250 | >250-500 | >500 | 100-200 | >200-500 | >500 |
| Мометазона фуроат | 110-220 | >220-440 | >440 | 110 | >220-440 | >440 |
| Триамцинолона ацетонид | 400-1000 | >1000-2000 | >2000 | 400-800 | >800-1200 | >1200 |
Установлено, что наибольшие клинические преимущества ИГКС отмечаются при использовании низких доз; эффективность применения высоких доз ИГКС при БА обсуждается, большинство случаев связано с увеличением риска системных нежелательных явлений.
Оценку эффективности проводимого лечения при БА рекомендуют проводить через 1-3 месяца после начала лечения (после перенесенного обострения БА — спустя неделю), в последующем — через 3-12 месяцев (у беременных пациенток с БА — каждые 4-6 недель). Через 2-3 месяца при недостаточном уровне контроля БА после оценки техники ингаляции и реальной приверженности лечению рекомендуют увеличение объема базисной терапии («шаг вверх»).
При присоединении вирусной инфекции или сезонном воздействии аллергенов при наличии письменного плана действий пациент с БА может самостоятельно увеличивать объем базисной терапии на 1-2 недели (особенно это касается пациентов, получающих низкие дозы ИГКС/формотерол в режиме базисной терапии и для купирования приступов). Уменьшение объема терапии («шаг вниз») рекомендуют после достижения хорошего контроля БА через 3 месяца до минимальной эффективной дозы ИГКС, которая полностью контролирует симптомы БА и предотвращает ее обострения.
GINA-2014 рекомендует тактику самоведения начинающихся обострений БА, что подразумевает постоянное наблюдение за симптомами и/или функцией легких (ПСВ, ОФВ1), наличие индивидуального плана действий, регулярный контакт пациента со специалистом для обсуждения вопросов лечения. При развитии обострения пациентам рекомендуют увеличить частоту использования «скоропомощного» ингалятора и объем базисной терапии с оценкой состояния через 48 часов: при сохранении ПСВ или ОФВ1 менее 60% от лучшего показателя и отсутствии улучшения рекомендуют продолжить применение «скоропомощного» ингалятора, базисной терапии в сочетании с введением преднизолона (40-50 мг/с) и обязательным контактом с врачом. Подчеркивается, что тяжелые обострения БА могут быть внезапными и без очевидных причин даже при легкой и хорошо контролируемой БА.
Хотя большинство пациентов могут достигнуть цели лечения и хорошо контролировать БА, некоторые пациенты не достигают контроля, несмотря на оптимально подобранную терапию. Термин «трудная в лечении» БА подразумевает под собой наличие различных сопутствующих заболеваний, продолжение контакта с аллергенами, низкую приверженность лечению, неадекватную ингаляционную технику. При резистентной (стойкой к лечению, рефрактерной) тяжелой БА симптомы или обострения плохо контролируются, несмотря на высший уровень рекомендуемого лечения. Это требует более тщательного выявления причин плохого контроля БА и тщательного мониторинга состояния таких пациентов.
В GINA-2014 впервые описан синдром сочетания астмы с хронической обструктивной болезнью легких (ХОБЛ) (ACOS — англ.), который характеризуется стойким ограничением воздушного потока с отдельными проявлениями, обычно связанными как с БА, так и с ХОБЛ. Актуальность этой проблемы связана с тем, что прогноз пациентов с признаками БА в сочетании с ХОБЛ хуже, чем при наличии только одного диагноза: для них характерны более частые и тяжелые обострения, более низкое качество жизни, быстрый регресс легочной функции, высокая стоимость лечения и летальность. Согласно литературным данным, распространенность синдрома сочетания БА и ХОБЛ среди пациентов с хроническими заболеваниями дыхательных путей варьирует от 15 до 55% и сильно зависит от возраста и пола. Считается, что если у пациента более трех признаков, характерных для БА и ХОБЛ или имеется равное количество признаков обоих заболеваний (табл. 2), то это очевидное доказательство синдрома сочетании астмы и ХОБЛ.
Характерные симптомы БА и ХОБЛ
| Признаки | БА | ХОБЛ | |
| Возраст, когда появились симптомы | До 20 лет | После 40 лет | |
| Характер симптомов | Варьируются по минутам, часам или дням. Ухудшение ночью или в ранние утренние часы. Появляются во время физической нагрузки, эмоций (включая смех), воздействия пыли или аллергенов. | Персистируют, несмотря на лечение. Дневные симптомы и одышка при физической нагрузке есть всегда. Хронический кашель и про дукция мокроты предшествуют одышке, обычно не связаны с триггерами. | |
| Функция легких | Вариабельные ограничения воздушного потока (спирометрия или пиковая скорость выдоха) | Персистирующие ограничения воздушного потока (ОФВ1/ФЖЕЛ 50 ppb), характерно для эозинофильного воспаления. | Обычно нормальный, низкий у активных курильщиков. |
| Эозинофилия крови | Поддерживает диагноз «астма». | Может быть выявлена во время обострений. | |
| Анализ воспалительных элементов в мокроте | Роль в дифференциальной диагностике не установлена на большой популяции пациентов. | ||
Стартовая терапия синдрома сочетания астмы и ХОБЛ (ACOS) основана на синдромной оценке и спирометрии: если у пациента доминируют проявления БА, то лечат как БА; если доминируют проявления ХОБЛ, то лечат как ХОБЛ. Если синдромная оценка подтверждает наличие ACOS или сохраняются сомнения в диагнозе ХОБЛ, то следует начать лечение БА на фоне проведения дополнительных исследований. Перед началом лечения необходимо тщательно взвесить эффективность и безопасность терапии: при любых проявлениях БА рекомендуют избегать назначения ДДБА без ИГКС, при любых проявлениях ХОБЛ показано симптоматическое лечение бронхолитиками или комбинированная терапия (ИГКС/ДДБА), избегая назначения монотерапии ИГКС. В случае подтвержденного диагноза ACOS показана терапия ИГКС в сочетании с ДДБА и/или длительно действующими холинолитиками (ДДХЛ). Важными стратегическими направлениями в лечении ACOS и ХОБЛ остаются мотивированный отказ о курения, различные методы легочной реабилитации, вакцинация против пневмококковой инфекции и гриппа и лечение сопутствующих заболеваний.
Диагностика БА у детей, согласно рекомендациям GINA-2014, в основном базируется на характерных симптомах (свистящие хрипы, кашель, затрудненное дыхание, ночные пробуждения и/или ограничение физической активности из-за этих симптомов) в сочетании с отягощенной семейной наследственностью и результатами клинического обследования.
Для БА у детей младше 5 лет характерен повторяющийся или постоянный кашель, усиливающийся в ночное время и сопровождающийся свистящими хрипами и затруднением дыхания. Характерно, что кашель при БА может провоцироваться физической активностью, плачем, криком, табачным дымом в отсутствие признаков респираторной инфекции. Для БА у детей также характерны повторные эпизоды свистящего дыхания (wheezing), в том числе во сне или при воздействии различных триггеров (вирусных инфекций, физической активности, смехе, плаче или под воздействием табачного дыма и различных поллютантов). Этими же факторами при БА у детей провоцируется появление затрудненного или тяжелого дыхания с удлиненным выдохом; оно, как правило, сопровождается снижением физической активности (одышка при беге, плаче, смехе, играх) и быстрой утомляемостью. Безусловно, вероятность установления диагноза БА у детей значительно увеличивается при выявлении семейной отягощенности по БА (особенно при наличии БА у родителей и сибсов), а также при наличии других аллергических заболеваний у ребенка (атопический дерматит, аллергический ринит и т. д.).
При назначении базисной терапии БА у детей младшего возраста предпочтительны низкие дозы ИГКС и бронхолитики короткого действия по потребности (КДБА). Диагноз БА у ребенка может быть подтвержден при достижении стойкого улучшения на фоне 2-3-месячного пробного лечения низкими дозами ИГКС и возобновлением симптомов БА после отмены терапии.
Важным вопросом остается прогнозирование риска обострений БА в ближайшее время. К таким признакам относятся сохранение неконтролируемых симптомов БА, более одного тяжелого обострения за предшествующий год, наступление сезона поллинации, сохранение экспозиции к табачному дыму и различным поллютантам, неустраненный контакт с аллергенами, особенно при присоединении вирусных инфекций, неблагоприятный социальный и психологический фон в семье, низкая приверженность лечению и плохая ингаляционная техника. К факторам формирования фиксированной бронхиальной обструкции при БА у детей относят тяжелое течение БА с госпитализациями в ОРИТ и перенесенный бронхиолит в анамнезе. Кроме того, следует учитывать возможные побочные эффекты проводимой терапии (системные — при повторных курсах системных стероидов или использовании высоких доз ИГКС; местные — вследствие неправильной ингаляционной техники, в том числе различные повреждения кожи лица и глаз при длительном использовании маски для небулайзера или спейсера).
В GINA-2014 для детей с БА до 5 лет также предложено использовать ступенчатый подход к терапии, который предполагает 4 ступени лечения. Первая ступень терапии используется у детей с редкими симптомами БА и низким риском обострений и предполагает в отсутствие базисной терапии использование КДБА по потребности. Вторая ступень лечения, предполагающая использование ИГКС в низких дозах (беклометазон дипропионат (HFA) — 100 мкг/с, будесонид pMDI + спейсер — 200 мкг/с, будесонид (суспензия для небулайзера) — 500 мкг/с, флютиказона пропионат (HFA) — 100 мкг/с, циклесонид — 160 мкг/с), предназначена детям с более частыми симтомами БА или при редких симптомах и наличии высокого риска обострений; в качестве альтернативы предлагается использовать антилейкотриены (АЛТР). На третьей ступени терапии при выраженных симптомах БА, не контролирующихся приемом низких доз ИГКС, рекомендовано использовать удвоенную суточную дозу ИГКС (как альтернатива — прежняя доза ИГКС + АЛТР). На четвертой ступени лечения при тяжелом течении БА у ребенка до 5 лет показано использование удвоенной суточной дозы ИГКС в сочетании с АЛТР.
Для детей в возрасте 0-3 лет предпочтительным способом доставки препаратов для базисного лечения БА считается ДАИ в сочетании со спейсером, снабженным лицевой маской; альтернативой является небулайзерная терапия с лицевой маской. Для пациентов с БА в возрасте 4-5 лет для базисной терапии предпочтительно использовать ДАИ в сочетании со спейсером с загубником, но возможно использование и спейсера с лицевой маской или небулайзера с загубником или лицевой маской.
Ранними симптомами начинающегося обострения БА у детей до 5 лет следует считать внезапное или постепенное появление/усиление свистящих хрипов и затрудненного дыхания, появление/усиление кашля, особенно вне сна, сонливость или вялость, слабость, снижение двигательной активности, изменение поведения, включая трудности при кормлении, недостаточный ответ на прием «облегчающих» препаратов; зачастую симптомы вирусных инфекций могут маскировать начинающееся обострение БА.
На любой ступени лечения, если активность ребенка с БА внезапно изменилась, а симптомы БА не купируются приемом ингаляционных бронходилататоров или период их действия прогрессивно укорачивается, то необходимо проводить повторные ингаляции КДБА каждые несколько часов и наблюдать за ответом; при отсутствии выраженного эффекта родителями должна быть начата терапия обострения БА на дому. Первоначальное лечение должно быть начато с назначения 2 доз (200 мкг сальбутамола или его эквивалента) через спейсер (с маской или без в зависимости от возраста), при отсутствии эффекта с интервалами в 20 минут допустимо проведение двух аналогичных ингаляций; после этого ребенок должен находиться под тщательным медицинским наблюдением (при необходимости — до нескольких дней). Если симптомы сохраняются на фоне приема 6 доз КДБА в течение 2 часов или отсутствует значимое улучшение в течение суток, то назначаются ИГКС в высоких дозах или системные стероиды (однако указывается, что оба вида лечения могут сопровождаться выраженными системными эффектами и требуют тщательного врачебного наблюдения).
Показаниями к неотложной госпитализации детей с БА до 5 лет, согласно рекомендациям GINA-2014, являются эпизоды нерегулярного дыхания и/или остановки дыхания, нарушения речи и глотания, разлитой цианоз, втяжение межреберных промежутков, падение сатурации при дыхании комнатным воздухом ниже 92%, резкое ослабление дыхания при аускультации, отсутствие ответа на начальную терапию КДБА, низкий ответ на последовательные ингаляции 6 доз сальбутамола (по 2 дозы троекратно с интервалами в 20 минут), сохраняющаяся одышка после использования КДБА (даже если отмечено некоторое улучшение состояния ребенка), невозможность организации лечения обострения на дому.
В GINA-2014 много внимания уделяется методам немедикаментозной профилактики и реабилитации больных с БА, что, безусловно, способствует повышению эффективности проводимых мероприятий и улучшению качества жизни этих пациентов.
В целом следует отметить, что GINA-2014 является рекомендательным документом, вобравшим в себя общемировой опыт борьбы с таким социально значимым заболеванием, как бронхиальная астма. Хочется надеяться, что в современных российских согласительных документах по лечению и профилактике БА найдут отражение основные положения GINA-2014 с учетом организационных и экономических возможностей нашей системы здравоохранения, что сделает жизнь пациентов с БА более качественной и безопасной.
источник