Бронхиальная астма — одна из самых распространенных болезней органов дыхания во всем мире. Медицина пока не знает способа избавлять пациентов от астмы раз и навсегда, но благодаря эффективным методам лечения и современным лекарственным препаратам в настоящее время это заболевание хорошо поддается лечению.
Однако лечение должно быть подобрано правильно: ведь при его недостаточной эффективности астма может не только существенно ограничивать нормальную жизнь пациентов, но и приводить к госпитализации, даже требовать лечения в условиях реанимационного отделения. Поэтому подбор адекватной терапии очень важен, и основная задача лечения — достижение контроля над заболеванием.
Начиная с 2006 года ежегодно выпускаемые международные рекомендации для врачей «Глобальная инициатива по бронхиальной астме» (GINA) нацеливают нас на лечение заболевания, направленное на достижение контроля астмы. Контроль над бронхиальной астмой определяется тем, что симптомы астмы должны отсутствовать или быть минимальными, потребность в препаратах неотложной помощи — очень мала и частота обострений должна стремиться к нулю. Другими словами, влияние болезни на повседневную активность пациентов и в целом на их жизнь должно быть минимальным, и лечение подбирается так, чтобы достичь и поддерживать максимально полный контроль над астмой.
Препараты для лечения астмы подразделяются на препараты для поддерживающей терапии и препараты для облегчения симптомов. Препараты для поддерживающей терапии принимаются ежедневно и длительно, они должны использоваться регулярно, в том числе и при отсутствии симптомов, так как благодаря своему противовоспалительному эффекту они уменьшают воспаление в дыхательных путях и тем самым обеспечивают контроль над астмой и препятствуют развитию клинических проявлений заболевания, являющихся следствием активности этого воспаления. Разумеется, также назначается препарат, быстро облегчающий симптомы, если они возникнут, но увеличение потребности в препаратах неотложной помощи указывает на необходимость скорректировать терапию противовоспалительными препаратами.
Для лечения астмы в настоящее время широко применяется комбинированная терапия ингаляционными глюкокортикостероидами и ингаляционными бета-2-агонистами длительного действия. Препараты, составляющие данную комбинацию, являются синергистами: добавление длительно действующих бета-2-агонистов к ингаляционным гормонам обеспечивает больший контроль астмы, чем увеличение дозы последних, и позволяет добиться контроля в тех случаях, когда астму не удается контролировать только ингаляционными гормонами даже в высоких дозах. Клиническая эффективность этой комбинации подтверждена анализом многих исследований.
Описанный эффект достигается благодаря тому, что эти препараты взаимно помогают действию друг друга на клеточном уровне. При использовании ингаляционных гормонов увеличивается количество бета-2-рецепторов и повышается их активность, а значит, и бронхорасширяющее действие бета-2-агонистов усиливается. В свою очередь, бета-2-агонисты запускают каскад особых внутриклеточных биохимических механизмов, приводящих к усилению противовоспалительного эффекта ингаляционных гормонов.
Таким образом, совместное действие двух препаратов оказывается большим, чем просто сумма их эффектов по отдельности, и их комбинация позволяет достичь большего результата в лечении астмы. Крайне важно, что необходимый результат достигается при лечении меньшими дозами ингаляционных гормонов.
Надо отметить, что облегчение от терапии бета-2-агонистами за счет их бронхорасширяющего воздействия субъективно ощущается пациентом. Воздействие же ингаляционных гормонов непосредственно не ощущается, однако именно их противовоспалительный эффект и необходим для лечения астмы.
Важно помнить, что лечить астму только длительно действующими ингаляционными бронхолитиками нельзя — это крайне опасно и может вызвать серьезное обострение заболевания. Зато при совместном применении с ингаляционными гормонами длительное использование бронхорасширяющих препаратов остается безопасным, а лечение эффективным. Для этого созданы фиксированные комбинации, которые содержат два препарата в одной ингаляционной дозе.
Такой режим терапии позволяет пациентам почувствовать облегчение симптомов благодаря бронхорасширяющему действию и одновременно получать поддерживающую дозу противовоспалительного препарата, необходимую для контроля над заболеванием.
В настоящее время применяются различные фиксированные комбинации препаратов для контроля над бронхиальной астмой. Из этих препаратов относительно новым является Тевакомб, но оба компонента, входящие в его состав, используются в лечении астмы достаточно давно: флутиказона пропионат — с 1993 года, салметерола ксинафоат — с 1990 года.
Флутиказон (флутиказона пропионат) — один из самых эффективных и безопасных противовоспалительных ингаляционных гормональных препаратов на сегодняшний день. Выраженный положительный эффект достигается уже при небольших дозах флутиказона. Препарат мало всасывается из ротовой полости и желудочно-кишечного тракта, практически не попадает в кровь и не оказывает побочных эффектов. При этом противовоспалительная и противоаллергическая активность препарата в бронхах является высокой.
Благодаря своей высокой активности флутиказон может эффективно применяться в терапии астмы даже при тяжелом течении заболевания и у больных, длительно применявших системные гормоны. Его прием в большинстве случаев способствует отмене таблетированных и инъекционных гормональных препаратов. Кроме того, к ингаляционным глюкокортикостероидам не формируется зависимость.
Салметерол относится к селективным ингаляционным бета-2-агонистам длительного действия с медленным началом действия. Исследования конца 1990-х годов подтвердили его способность не только предупредить ночные симптомы и астму физического усилия, но и уменьшить дозу ингаляционных глюкокортикостероидов, необходимую для достижения адекватного контроля над астмой.
Препарат обладает также противовоспалительным эффектом, который, правда, не имеет самостоятельного значения при лечении астмы, но может проявляться клинически при сочетании салметерола с ингаляционными гормонами. Салметерол назначается только в качестве препарата для базисной терапии и не применяется по потребности — его следует принимать регулярно в рекомендованных дозах, а при необходимости купирования симптомов использовать бета-2-агонисты короткого действия.
Комбинированное действие ингалятора, содержащего салметерол и флутиказон, отличается высоким противовоспалительным эффектом, что особенно необходимо при астме, так как именно активность воспаления в бронхиальном дереве лежит в основе всех проявлений заболевания и тяжести его течения.
При лечении астмы может возникнуть необходимость изменить дозу ингаляционного гормона в зависимости от течения заболевания, и при этом следует помнить, что при использовании салметерола в комбинированном ингаляторе нельзя превышать допустимую дозу салметерола более 100 мкг в сутки. Поэтому для ингаляторов с этой комбинацией препаратов наличие вариантов с разными дозировками флутиказона является преимуществом, позволяющим при необходимости увеличить или уменьшить дозу противовоспалительного препарата (ингаляционного гормона), не превышая доз салметерола и не назначая дополнительную дозу флутиказона в отдельном ингаляторе.
Итак, Тевакомб — новый ингаляционный препарат, содержащий комбинацию флутиказона и салметерола, обладает необходимыми вариантами дозировок, позволяющими применять его в широком диапазоне клинических ситуаций, при которых требуются различные дозы флутиказона. Препарат применяется и у детей (начиная с четырехлетнего возраста), и у пожилых пациентов, причем не требуется пересмотр дозы у пожилых людей или у людей с заболеваниями печени и почек.
Тевакомб — это привычный и удобный в применении для многих пациентов аэрозольный ингалятор. Он настолько же эффективен и безопасен, как и ранее известные ингаляторы, содержащие флутиказон и салметерол. Высокоэффективные компоненты, усиливая положительные эффекты друг друга, уменьшают выраженность дневных и ночных симптомов, улучшают функцию легких, снижают потребность в препаратах для облегчения симптомов и частоту обострений, позволяя достичь хорошего контроля над астмой у большего числа пациентов.
Возможность достижения контроля при использовании меньших доз ингаляционного гормона повышает безопасность лечения. Препарат широко используется во многих зарубежных странах и уже более чем полгода применяется в России. Тевакомб хорошо переносится, практически не вызывает нежелательных явлений (при правильном использовании ингалятора), а наличие различных дозировок по флутиказону дает возможность подобрать оптимальную дозу и применять этот ингалятор у пациентов с различной степенью тяжести заболевания.
Результаты международных исследований, которые легли в основу современной стратегии лечения астмы, показали преимущество комбинации ингаляционных гормонов и бета-2-агонистов длительного действия при среднетяжелой и тяжелой астме, и это подтверждается реальной практикой.
Благодаря современным технологиям имеется большой выбор в лекарственных препаратах и в том числе ингаляторах для лечения астмы, и это очень важно: в настоящее время у врача и у пациента есть удачная возможность выбрать именно тот препарат, который наиболее подойдет для контроля над астмой. Это увеличивает удобство и эффективность терапии для пациента, обеспечивает соблюдение рекомендаций врача. А как мы уже говорили, астма является заболеванием, которое хорошо поддается лечению, если следовать врачебным рекомендациям.
В заключение, хочу порекомендовать вам видео лекцию доктора медицинских наук Куколь Л.В., контроль над бронхиальной астмой — как достичь и поддерживать?
источник
Неконтролируемая бронхиальная астма, которая характеризуется возникновением приступов удушья, свистящим кашлем и сильной одышкой, как правило, сопровождается ограничением повседневной активности пациента и требует обязательного лечения.
В том случае, когда это состояние остается без изменений даже на фоне проводимого лечения, его классифицируют, как обострение бронхиальной астмы. В соответствии с этим диагнозом при первых проявлениях неконтролируемого заболевания необходимо увеличение дозировки лекарственных препаратов для предупреждения астматического приступа.
Бронхиальная астма характеризуется хроническим течением, что требует обязательного контроля развития симптоматики, которая зависит от индивидуальных особенностей организма и тяжести заболевания.
Астма неконтролируемой, средней и тяжелой степени оценивается по выраженности симптоматики в ночное и дневное время. Кроме того, учитывается потребность в бронхолитиках для лечения острого приступа и возможности заболевания повлиять на активность пациента.
В классификации астмы по уровню контроля можно выделить следующие формы:
К определению уровня контроля необходимо отнестись со всей ответственностью, так как многие астматики не в состоянии самостоятельно оценить степень тяжести заболевания, в результате чего переоценивают возможные результаты лечения.
Кроме того, недостаточно контролируемая форма заболевания способна резко изменить уровень жизни, оказывая воздействие на социальный и психологический статус пациента. Наиболее распространенной формой бронхиальной астмы является персистирующая. При неконтролируемом заболевании возможно внезапное появление астматического приступа, увеличивающего риски развития патологических изменений в организме больного.
Клиническое течение любой формы заболевания зависит от количества дневных и ночных приступов, возникающих в течение недели. На основании этого выбирается интенсивность воздействия β2 -адреномиметиков короткого действия.
- К первой ступени относится астма легкой интермиттирующей степени, проявляющаяся одышкой и нечастым спастическим кашлем. Симптомы интермиттирующей астмы могут отмечаться 1 раз в течение 7 дней, а в ночное время не чаще 1 раза в месяц. Симптомы средней степени в промежутках между приступами практически не наблюдаются.
- Ко второй ступени относится персистирующая легкая астма. Симптомы заболевания возникают не чаще 2 раз в месяц. В ночное время приступы появляются очень редко. В период обострений пациент чувствует дискомфорт, связанный с нарушением привычной деятельности. Постепенно отмечается рост реактивности легочной системы.
- К третьей ступени относится персистирующая форма заболевания средней тяжести. При этом наблюдаются практически ежедневные приступы, которые способствуют снижению качества жизни, нарушая сон и затягивая выздоровление. Эта стадия требует ежедневного приема бета-адреномиметиков короткого действия.
- Четвертое место принадлежит тяжелой, неконтролируемой, форме бронхиальной астмы, течение которой осложняется постоянными болями. При этой форме заболевания осложняется постоянными астматическими приступами, которые могут повторяться несколько раз за ночь и требуют дополнительного приема бронхолитиков.
Необходимо отметить, что степень развития тяжести заболевания, опираясь только на симптоматику, можно выяснить только до начала лечебных мероприятий. При получении надлежащей терапии рекомендуется учитывать степень ее интенсивности.
Неконтролируемое течение заболевания предусматривает выбор наиболее эффективных препаратов, к которым относятся и комбинированные средства, например ингаляционный препарат Беродуал. Входящие в его состав Фенотерол и Ипратропия бромид обладают способностью расслабления бронхиальной мускулатуры, обеспечив тем самым максимально быстрое и пролонгированное действие.
Нередко применяются синтезированные симпатомиметики, которые избирательно стимулируют β – адренорецепторы. К ним относятся Новодрин, Эуспиран, Изадрин, Астмопент и т.д. Избирательное свойство позволяет избежать побочных воздействий, которые отмечаются при использовании Адреналина. Эти препараты чаще всего применяются ингаляционно, что позволяет добиться быстрого купирования приступа. Однако при передозировке ингаляций (4-6 раз в течение суток) способен возникнуть воспалительный процесс дыхательных путей и бронхоспазмы.
Острая симптоматика может купироваться при помощи Эуфиллина в таблетированной форме или растворе для внутримышечного и внутривенного введения, в зависимости от состояния пациента. Пероральный прием Эуфиллина(0,15 г) можно совмещать с (0,025 г) Эфедрина гидрохлоридом. Кроме того, независимо от стадии заболевания, рекомендуется прием увлажненного кислорода.
При выборе лечебной тактики необходимо учитывать возможные осложнения. От этого зависит увеличение или снижение потребности в лекарственных препаратах для купирования острого приступа. Увеличение дозировки противоастматических препаратов (более 2 раз в течение 7 дней) указывает на потерю контроля над бронхиальной астмой, что требует пересмотра базисного лечения в дальнейшем.
Состояние пациента, в зависимости от степени тяжести симптоматики, необходимо проводить регулярно. Для контроля над тяжестью состояния следует оценить такие показатели, как показатели диагностических обследований и лабораторных анализов.
Важно проводить мониторинг состояния больного для того, чтобы оценить эффективность проводимого лечения. При необходимости проводится коррекция терапии, предполагающая « ступенчатую» систему назначений. При этом интенсивность медикаментозной терапии зависит от тяжести симптоматики.
Такая система наиболее оптимальна и позволяет достигнуть контроля над бронхиальной астмой при минимальном лекарственном воздействии и длительно его поддерживать. При этом необходимо учитывать индивидуальные особенности организма и тяжесть симптоматики.
Достижение полного контроля над бронхиальной астмой должно характеризоваться не только отсутствием симптомов заболевания и нормализацией легочной функции. В этом состоянии необходимо следить за тем, чтобы в нижних отделах дыхательных путей отсутствовали воспалительные процессы, так как они способны привести к бронхиальной гиперреактивности.
В том случае, когда астма находится под контролем, пациент может вести привычный образ жизни, занимаясь спортом, посещая учебные заведения и занимаясь профессиональной деятельностью. При этом нормализуется сон, и предупреждается развитие новых приступов и обострений.
Профилактические мероприятия по предупреждению развития острого приступа бронхиальной астмы заключается в соблюдении следующих условий:
- Важно избегать прямого контакта с аллергенами, так как наиболее часто заболевание связано с повышенной аллергической чувствительностью организма.
- Рекомендуется в холодное время года защищать дыхательные пути и дышать только через нос. Это позволит избежать переохлаждения и, как результата, воспалительных заболеваний дыхательных путей.
- Необходимо регулярно проводить мониторинг заболевания по степени тяжести. Если оно осложняется присоединением вторичных инфекций, необходимо обратиться к лечащему врачу для дальнейшего лечения.
- Рекомендуется соблюдать гипоаллергенную диету, особенно при наследственной предрасположенности к аллергическим проявлениям.
- Своевременного предупреждение астматического приступа можно добиться с помощью аэрозольного ингалятора, который необходимо всегда иметь с собой.
Важно помнить, что нельзя заниматься самолечением, так как иногда это может привести к тяжелым осложнениям, а в некоторых случаях и к летальному исходу. При первых признаках заболевания следует незамедлительно обратиться к лечащему врачу для получения высококвалифицированной консультации и лечебных рекомендаций.
источник
Выделяют контролируемую, частично контролируемую и неконтролируемую бронхиальную астму. Среди наиболее распространенных заболеваний хронического характера, присущих людям, бронхиальная астма занимает одну из ведущих позиций. Одной из сложнейших ее форм является неконтролируемая бронхиальная астма.
Бронхиальная астма (БА) представляет собой воспалительное заболевание, развивающееся в дыхательных путях. Оно отличается участием в воспалительном процессе разнообразных клеточных элементов и хронической природой. Это заболевание может проявиться у представителей любой национальности и пола, в любом возрасте. Согласно статистическим данным, этой болезнью страдает около 300 миллионов людей на планете.
Что же обозначает определение «неконтролируемая бронхиальная астма»? Это такое течение болезни, при котором отсутствует контроль над его симптоматикой. Еще не так давно специалисты использовали критерии оптимального контроля над этим заболеванием. Однако на практике они оказывались слишком расплывчатыми, тем самым не позволяя доподлинно определить степень контроля и своевременно перейти на следующую ступень с подходящим объемом терапии.

- не наблюдается обострений;
- определение минимального числа эпизодов бронхообструкции в течение дня;
- ночные симптомы полностью отсутствуют;
- больному требуется лишь одна ингаляция за сутки b2-агонистов короткого действия;
- значение ПСВ в среднем за сутки выше 80%;
- при терапии не наблюдается побочных эффектов;
- в течение суток показатель лабильности бронхов не превышает 20%.
На сегодня создана и активно применяется трехуровневая система определения контроля симптомов бронхиальной астмы. При этом указанный перечень относится ко второму уровню контролируемости.
Бронхиальная астма часто переходит в тяжелые формы. Это приводит к тому, что человек становится инвалидом, а при дальнейшем неоказании адекватной медицинской помощи — к ХОБ. Эта необратимая стадия проявляется в форме хронической инструктивной болезни легких. Лечение неконтролируемой бронхиальной астмы проводится гораздо дольше и с малой эффективностью. Это не только влияет на пациента, но и вызывает большие затраты времени и усилий врача.

В большинстве случаев пациенты подвергаются неадекватной терапии бронхиальной астмы, вследствие чего наблюдается отсутствие контроля. Впрочем, ряд типов неконтролируемой бронхиальной астмы получили отдельные названия из-за особенностей их формирования. Сложная, или как ее еще называют, терапевтически резистентная бронхиальная астма нередко определяется как неконтролируемая. Она не реагирует на оптимальную терапию. Также выделяют ряд разновидностей сложной астмы:
- Хроническая сложная — отличается постоянной бронхообструкцией. Она сильно влияет на качество жизни человека. При ней крайне важна системная терапия с применением кортикостероидов, имеющих неполный эффект. Однако тяжелые обострения наблюдаются нечасто.
- Хрупкая, также ее часто называют нестабильной. Существует в двух вариантах. В первом применяются высокие дозы ингаляционных кортикостероидов и наблюдается высокая вариабельность ПСВ. Вторая форма — интерпретирующая тяжелая бронхиальная астма. Она обладает внезапными острыми приступами, которые развиваются на протяжении 3 часов, при этом не имея объективной причины. Наблюдается практически нормальная функция легких.
- Фатальная форма — это обострение, угрожающее смертью или приводящее к летальному исходу. Его яркими признаками и одновременно обострениями являются пневмоторакс, гиперкапния или респираторный ацидоз. При нем крайне важно скорейшее применение реанимационных мероприятий.
Существует и ряд других форм неконтролируемых БА. Как показывает практика, под неконтролируемый тип этой болезни могут подпадать случаи любой степени тяжести.
Чтобы назначить адекватное лечение, для начала следует в каждом случае тщательно изучить причину, по которой возникло это состояние. Врач должен быть уверен в том, что диагноз «бронхиальная астма» верен. Нередко его сложно отличить от ХОБЛ. В таких случаях очень важно наблюдение за состоянием больного в динамике. Диагностику могут затруднять разнообразные патологии верхних дыхательных путей.
Часто бывает, что из-за недостаточной квалификации специалиста или его невнимательности назначается неадекватная базисная терапия. Это происходит и в случае, когда он недооценивает степень тяжести состояния больного. Иногда и сам пациент является причиной развития этого типа бронхиальной астмы: частично или полностью отказывается от назначенной врачом терапии, не соблюдает режим и т. п.
Причины отсутствия контроля над симптомами заболевания могут скрываться и в индивидуальных особенностях организма пациента: к примеру, наследственная склонность к развитию воспалений или бронхиальная гиперактивность неуправляемого характера. Зачастую применяется комбинированная терапия для лечения рассматриваемого типа БС. При этом выделяют такие ее этапы:
- приведение к ремиссии;
- переход на более щадящий тип терапии;
- произведение комплекса действий для поддержания состояния ремиссии.
На первом этапе важно максимально подавить воспаление, поскольку именно оно выступает ведущим патогенетическим механизмом этого заболевания. Начальная доза препаратов базовой терапии определяется врачом на основании тяжести течения заболевания. Период лечения на этом этапе может достигать полугода. Минимальный срок терапии — месяц.
После прохождения этого этапа начинается уменьшение дозы препаратов до такой, которая будет обеспечивать контроль над симптоматикой болезни и при этом будет минимальной. Коррекция объемов терапии проводится строго индивидуально и продолжается до полугода, но не меньше трех месяцев. В зависимости от успешности второго этапа принимается решение о начале третьего. Назначается комплекс препаратов и мер (в ряде случаев определенный препарат), направленный на сохранение состояния ремиссии.
С учетом широкого спектра действующих препаратов их подбор возможен лишь лечащим врачом исходя из индивидуальных особенностей пациента и течения болезни. Наличие симптоматики, свидетельствующей о развитии заболевания или его обострения, в частности, удушья, — это серьезный повод для срочного обращения к врачу.
Бронхиальная астма — смертельно опасное заболевание, подлежащие обязательному лечению с привлечением специалистов!
При неконтролируемой бронхиальной астме признаки обычно наблюдаются у пациента в дневные и ночные часы, ограничивают повседневную активность, требуют более частого использования ингаляторов. Если такое ухудшение сохраняется хотя бы неделю, состояние пациента расценивают как обострение бронхиальной астмы. При первом появлении признаков неконтролируемой астмы необходимо увеличить дозы, кратность применения или количество используемых препаратов для того, чтобы предупредить развитие обострения.
источник
В современной медицине классификация все больше становится прикладным инструментом, позволяющим достичь главной цели – избавить пациента от болезни или как можно сильнее уменьшить ее проявления с помощью лечения. Таким образом, деление заболевания на варианты, формы, степени во многом становится условным. В ходе лечения нередко один вариант заболевания сменяется другим, отличие которого заключается прежде всего в ином лечении.
Бронхиальная астма не стала исключением. Если в прежние годы врачи выделяли степени тяжести болезни, то в последней редакции всех отечественных и зарубежных руководств внимание переместилось на степень контроля заболевания, то есть на интенсивность и эффект лечения.
Классификация по степени тяжести сохраняет свое значение при первом визите пациента к врачу, когда он еще не получает никакого лечения, особенно ингаляционных глюкокортикоидов и других средств базисной терапии.
Классификация по степени тяжести определяет, насколько поражено бронхиальное дерево. Она помогает определить, какие препараты следует назначить и в какой дозировке, чтобы в дальнейшем добиться устранения симптомов болезни. Это деление проводится исключительно до начала лечения.
Тяжесть течения оценивается по наличию клинических проявлений в сочетании с показателями функции внешнего дыхания (ФВД), прежде всего объема форсированного выдоха за 1 секунду (ОФВ1) и пиковой скорости выдоха (ПСВ).
- Интермиттирующее течение, или I ступень, характеризуется нечастыми признаками (кашель, одышка), беспокоящими больного реже 1 раза в 7 дней и до 2 раз в месяц ночью; данные ФВД близки к нормальным.
- Астма легкой степени, или II ступени, сопровождается более частым появлением клинических признаков: днем чаще раза в 7 дней, но не ежедневно, ночью – чаще 2 раз в месяц. При обострении болезни может быть нарушен сон и снижена активность больного. Данные ФВД при этом остаются близкими к нормальным.
- Средняя степень (III ступень) сопровождается ежедневными проявлениями, ночью симптомы возникают раз в 7 дней и чаще. Пациент вынужден ежедневно пользоваться препаратами «скорой помощи» (сальбутамол) для устранения кашля или удушья. Функция внешнего дыхания ухудшается.
- Тяжелое течение (IV ступень) сопровождается ежедневными приступами и частыми симптомами в ночные часы. Заболевание протекает с частыми обострениями, во время которых ограничивается физическая активность пациента. Показатели ФВД меньше 60% от должных величин.
Если клиническая картина и данные спирометрии не совпадают, степень тяжести устанавливают согласно более тяжелым признакам.
Тяжесть заболевания можно охарактеризовать и у больных, уже получающих лечение. В этом случае легким считается течение болезни, которое можно контролировать с помощью небольшого количества лекарств и низких дозировок. Тяжелая астма в этом случае – состояние, требующее назначения комплексной терапии в больших дозах. Плюсом этой классификации является учет получаемой больным терапии, дающей представление об истинной тяжести болезни.
Таким образом, у больного с исходной IV степенью тяжести болезни на фоне лечения мы можем добиться такого контроля над астмой, что у него вообще не будет приступов ночью, а днем он лишь иногда будет пользоваться, например, сальбутамолом. Однако получится это у врача только при назначении соответствующей комбинированной базисной терапии, что соответствует астме тяжелого течения.
Задача врача при бронхиальной астме у пациента – добиться контроля заболевания, то есть предотвращения ее проявлений. Полное излечение при этом заболевании считается невозможным. Оценив на первом приеме тяжесть состояния пациента, врач назначает ему лекарственную терапию. В процессе дальнейшего наблюдения он оценивает уже не степень тяжести, а уровень контроля над заболеванием, при необходимости изменяя лечение.
Для оценки уровня контроля используются разнообразные опросники. Их можно применять начиная с возраста пациента 4 года. Для взрослых наиболее распространен «Тест контроля над астмой». Если при ответе на все вопросы сумма составила 25 баллов – контроль хороший;20 – 24 балла – недостаточный; менее 20 баллов – результат плохой, нужно срочно обратиться к врачу. Для детей создан детский вариант теста: если ребенок набрал 19 баллов и меньше – это говорит о плохом контроле над заболеванием.
На необходимость усиления терапии указывает частое использование средств «скорой помощи» (например, сальбутамола). При этом следует увеличить объем терапии до достижения контроля над признаками болезни. Если состояние полного контроля сохраняется более 3 месяцев, можно попробовать уменьшить интенсивность лечения до минимальных поддерживающих доз.
Различают три уровня контроля над болезнью:
- контролируемая астма;
- частично контролируемая;
- неконтролируемая.
При полностью контролируемой патологии в течение как минимум месяца:
- регистрируется меньше двух эпизодов ухудшения в неделю;
- ночные пробуждения из-за симптомов болезни отсутствуют;
- физическая активность не ограничена;
- необходимость пользоваться препаратами «скорой помощи» отсутствует или есть, но не чаще двух раз в неделю;
- ФВД в пределах нормы (для детей старше 5 лет).
При частично контролируемом течении болезни хотя бы один из перечисленных показателей наблюдается чаще или выражен сильнее. Показатели ФВД меньше 80% от нормы или наилучшего известного для данного пациента показателя.
При неконтролируемой патологии могут наблюдаться три и более из следующих признаков:
- более двух эпизодов ухудшения самочувствия в неделю;
- любые ночные симптомы;
- любое ограничение активности;
- потребность в препаратах «скорой помощи» чаще 2 раз в неделю;
- ФВД менее 80% от нормы.
Кроме того, учитывается риск осложнений. Он увеличивается при плохом контроле, частые обострения, госпитализация в отделение интенсивной терапии по поводу этой патологии, низкий показатель ОФВ1, курение, необходимость приема лекарств в большой дозировке.
Под обострением понимается 7 и более дней неконтролируемого течения болезни.
Некоторые пациенты считают, что частые приступы удушья, ежедневная потребность в ингаляциях сальбутамола, одышка – признаки тяжелого течения патологии. Однако такое мнение не совсем верно. Это признаки неконтролируемого течения заболевания, которое может быть как при тяжелой, так и при легкой астме.
С чем может быть связана невозможность полного контроля над болезнью? Прежде всего, необходимо узнать, насколько пациент выполняет требования по элиминации аллергенов, правильно ли он проводит ингаляции, выполняет ли все назначения врача. Затем нужно устранить провоцирующие факторы – гастроэзофагеально-рефлюксную болезнь, синуситы, хронический ринит. Примерно у четверти больных безуспешность терапии связана с неправильно поставленным диагнозом, когда за астму принимается другое заболевание. Если же все эти факторы устранены, нужно усилить терапию.
Однако у части пациентов, несмотря на интенсивное лечение, добиться полной ремиссии не удается. Чаще всего это связано с генетическими и анатомическими особенностями – изменчивостью рецепторов к интерлейкинам, смешанным типом воспаления, наличием внутриклеточных возбудителей, более толстой стенкой бронхов и другими особенностями. Изучение таких вариантов продолжается, оно позволит в будущем создать новые препараты для помощи людям с тяжелой неконтролируемой бронхиальной астмой.
источник
Дыхательная система, как и другие органы человека, подвержена интенсивному воздействию внутренних и внешних негативных факторов. При определенных условиях это может привести к возникновению бронхиальной астмы.
Наиболее опасной формой заболевания считается неконтролируемая астма. По статистике, она развивается у 20% населения.
Данную патологию вылечить полностью нельзя, но существует способы, позволяющие добиться полного или частичного контроля над течением заболевания, что позволит больному вести полноценный образ жизни.
Бронхиальная астма — распространенное заболевание нижних дыхательных путей с непосредственным участием клеточных элементов. Оно характеризуется гиперреактивностью бронхов, на что организм отвечает сужением их просвета.
При этом отмечается бронхоспазм, отек слизистой оболочки, скопление большого количества мокроты и как следствие, нарушение газообмена и возникновение приступов удушья.
Контролирование состояния больного в большинстве случаев позволяет снизить риск обострения болезни и развития астматического статуса.
Заболевание классифицируется не только по степени тяжести, особенностям протекания, наличию[М9] осложнений, но также по степени контроля.
Он определяется по следующим параметрам:
- симптоматические проявления болезни в разное время суток;
- ограничение активности;
- функциональное состояние дыхательной системы;
- частота астматических приступов;
- необходимость применения медикаментозных препаратов неотложной помощи.
Существуют три вида астмы, отличающиеся по степени контроля:
- Контролируемая бронхиальная астма — наблюдается отсутствие клинических проявлений в период лечения. Показатели диагностических исследований соответствуют норме. Препараты при контролируемой форме назначаются пациентам в минимальном количестве.
- Частично контролируемая — отмечается наличие отдельных симптомов заболевания. В этом случае рекомендуется смена терапевтических мероприятий для возвращения болезни в контролируемую форму.
- Неконтролируемая бронхиальная астма — наиболее опасная форма заболевания, при которой наблюдается ярко выраженная симптоматика и частые обострения с астматическими приступами, повторяющимися неоднократно в течение недели. В этот период требуется приложить все усилия для возврата болезни в контролируемую форму.
Контроль болезни заключается в продолжительном наблюдении за ее развитием (сопутствующие признаки, частота повторений приступов) и подборе индивидуального лечения. Комплексная терапия способна перевести болезнь в состояние длительной ремиссии.
Причинами развития неконтролируемой астмы являются:
- наследственная предрасположенность;
- неподходящие климатические условия;
- работа, связанная с воздействием химически активных веществ;
- ожирение;
- гормональные нарушения;
- особенности строения дыхательных органов;
- не полностью вылеченные инфекционные заболевания;
- ослабление иммунитета.
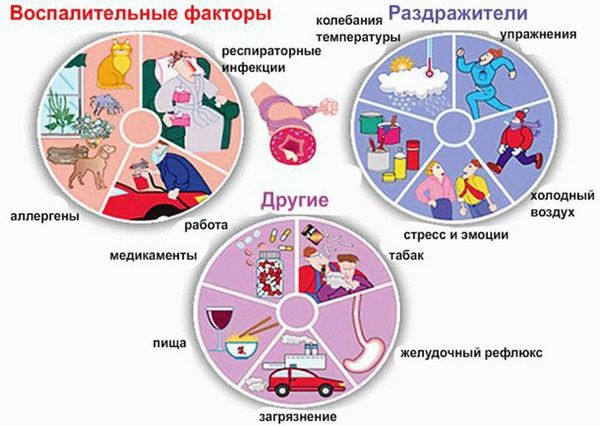
Триггерами (провоцирующими факторами), запускающими патологические процессы в организме и приводящими к обострению хронического заболевания, могут быть:
- лекарственные препараты;
- продукты питания;
- средства бытовой и строительной химии;
- пух и шерсть домашних питомцев;
- сухие корма для животных;
- домашняя пыль.
Астма может развиваться под влиянием одной или нескольких причин, но клинические проявления заболевания от этого не изменяются.
Для болезни характерна следующая симптоматика:
- спазм гладкой мускулатуры бронхов;
- нарушение дыхания (свистящее, хриплое, затрудненное);
- появление одышки;
- большое количество отделяемой слизи;
- возникновение приступов кашля.
При неконтролируемой астме возникает удушье, которое способно привести к летальному исходу. Чтобы избежать этого, необходимо своевременно обратиться к врачу и пройти назначенное обследование (для определения степени тяжести болезни, подбора соответствующего лечения и восстановления контроля над бронхиальной астмой).
Основные цели лечения астмы:
- уменьшить чувствительность к влиянию провоцирующих факторов;
- получить полный контроль над астмой;
- снизить частоту обострений;
- предотвратить состояния, угрожающие жизни больного;
- нормализовать дыхательные процессы;
- снизить потребность в лекарствах.
Одним из методов борьбы с бронхиальной астмой является базисная терапия.
Она включает применение следующих препаратов:
- кортикостероидов (в форме аэрозолей), способствующих купированию воспалительных процессов в дыхательных путях;
- бронхолитиков, улучшающих отхождение слизи;
- антихолинергических средств (при большом скоплении мокроты и ее плохом отхождении), вызывающих расширение бронхов, уменьшающих одышку и кашель;
- бета-2-адреномиметиков длительного и короткого действия, предупреждающих обструкцию бронхиальных ветвей, способствуют их расширению;
- системных глюкокортикостероидов, использующихся в качестве поддерживающей терапии и во время астматических приступов.
Лекарства данных групп применяются в течение продолжительного времени. Они способны приостановить процесс развития астмы, уменьшить ее проявления и снизить вероятность обострений.
Прием лекарственных препаратов корректируется в индивидуальном порядке (в зависимости от состояния пациента и проявления клинических признаков).
- соблюдать спокойствие;
- снять все, что мешает свободному дыханию;
- принять положение сидя или стоя, упереться руками, локти отвести в сторону;
- использовать ингалятор.
Если приступ невозможно снять самостоятельно, необходимо вызвать скорую помощь.
Лечение считается успешным, если астма взята под контроль,
Эффективность проведенной терапии оценивается по следующим критериям:
- не отмечается появления побочных действий от назначенных препаратов;
- нету обострений и отсутствует выраженная симптоматика болезни;
- не требуется приема препаратов быстрого действия;
- отмечается стабильное снижение дозировки принимаемых лекарств;
- стабилизируется дыхательная функция;
- улучшается общее состояние пациента в покое и при физических нагрузках.
Контролированная форма бронхиальной астмы — показатель успеха проведенной терапии.
При неконтролируемом течении заболевания увеличивается риск возникновения осложнений. Частые обострения приводят к нарушению газообмена (воздух поступает в легкие в недостаточном объеме).
Астма может стать толчком к развитию вторичных инфекций (пневмонии, гнойного бронхита), а также:
- эмфиземы (раздувание) легких — приводит к дыхательной недостаточности;
- дыхательной недостаточности;
- пневмоторакса — скопления воздуха в плевральной полости;
- ателектаза – спадения легкого из-за частичного или полного закрытия просвета бронхов;
- астматического статуса — тяжелого угрожающего жизни состояния, которое возникает в результате длительного приступа.
Неконтролируемая астма может привести к необратимым последствиям — инвалидности и даже смерти.
Чтобы уменьшить влияние неконтролируемой бронхиальной астмы на качество жизни человека, необходимо придерживаться некоторых рекомендаций:
- избегать тяжелых физических нагрузок;
- укреплять защитные силы организма;
- исключить воздействие аллергенов, способных вызвать обострение заболевания;
- контролировать эмоциональное состояние;
- не злоупотреблять алкоголем;
- избегать курения и вдыхания сигаретного дыма;
- использовать ингалятор в период обострения;
- проходить регулярные осмотры у пульмонолога, аллерголога и других специалистов.
Следует помнить, что бронхиальная астма нуждается в постоянном контроле. Каждый человек, страдающий астмой, должен иметь при себе ингалятор, который поможет в критической ситуации облегчить состояние и не допустить развития астматического статуса.
источник
По данным эпидемиологических исследований, бронхиальной астмой (БА) страдает 5-10% детского населения. БА — хроническое воспалительное заболевание респираторного тракта, в котором участвуют многие клетки врожденной и адаптивной иммунной системы совместно с эпителиальными клетками, вызывая основные клинические синдромы, характерные для данного заболевания.
Существует мнение, что БА гетерогенна. Выделяют различные ее фенотипы и эндотипы, которые определяются особенностями взаимодействия генетических и средовых факторов, различаются возрастом начала заболевания, клиническими проявлениями, спектром биомаркеров, прогнозом и ответом на традиционные и новые терапевтические воздействия.
При этом продемонстрировано, что фенотипы астмы, диагностированные с учетом превалирования тех или иных воспалительных клеточных популяций в мокроте, в течение 12-месячного периода наблюдения не были стабильными.
Иммунологические механизмы, лежащие в основе БА, преимущественно опосредованы Т-лимфоцитами-хелперами 2-го типа (Th2), ассоциированы с гиперпродукцией иммуноглобулинов Е и формированием эозинофильного варианта воспаления в респираторном тракте.
Однако некоторые аспекты эозинофильного воспаления могут быть ассоциированы с активацией лимфоидных клеток 2-го типа врожденного иммунитета (innate lymphoid cells 2 — ILC-2), действующих совместно с базофилами. Кроме того, для некоторых фенотипов БА характерно преимущественно нейтрофильное воспаление, контролируемое подмножеством Th17 хелперных Т-клеток.
У большинства детей формирование БА связано с Тh2-вариантом иммунного ответа, атопией, врожденной склонностью к гиперпродукции общего и специфического IgE, снижением функциональной активности T-reg-клеток (Th3, Tr1, CD4-, CD25+) и дисбалансом Th1/ Th2.
Взаимодействие на поверхности тучных клеток и базофилов специфических IgE с причиннозначимыми аллергенами индуцирует высвобождение преформированных и синтезируемых de novo медиаторов, вызывающих развитие острого воспаления бронхов, сопровождающегося миграцией клеток в слизистую оболочку дыхательных путей и формированием клеточного инфильтрата, включающего эозинофилы, базофилы, Тh2-лимфоциты с участием макрофагов, моноцитов, дендритных, тучных и эпителиальных клеток, тромбоцитов, нейтрофилов, фибробластов.
Выделяемые тучными клетками, эозинофилами, базофилами, ТИ2-лимфоцитами провоспалительные цитокины способствуют формированию хронического воспаления. Миграция провоспалительных клеток из сосудистого русла в межклеточное пространство происходит под влиянием хемокинов и адгезивных молекул.
Персистированию аллергического воспаления в дыхательных путях при БА способствуют длительная экспозиция причинно-значимых аллергенов, наличие у больного высокого индекса атопии, высвобождение нервными клетками воспалительных нейрокинов (субстанции Р, нейрокинов А и В), наслоение вирусной, бактериальной или атипичной (хламидийной, микоплазменной) инфекций.
Так как астма характеризуется рецидивирующей вариабельной обструкцией дыхательных путей, уровень контроля данного заболевания можно оценить, опираясь на выраженность его симптомов, значения параметров внешнего дыхания, результаты функциональных тестов, отражающих вариабельность проходимости бронхов и бронхиальную гиперреактивность.
В связи с тем, что центральное место в патогенезе астмы занимает воспаление дыхательных путей, его мониторинг должен стать составной частью планов ведения пациентов. В настоящее время наиболее изученным биомаркером воспаления при БА является уровень оксида азота и его метаболитов в выдыхаемом воздухе.
Активно в этой связи изучаются также клеточный состав индуцированной мокроты, компоненты конденсата выдыхаемого воздуха (pH, лейкотриены, альдегиды и другие параметры). Новым аналитическим методом детекции биомаркеров в конденсате выдыхаемого воздуха является метаболомика.
Биомаркеры могут быть использованы также для диагностики основных фенотипов и эндотипов астмы. Так, например, уровни Feno, сывороточного периостина, эозинофильного нейротоксина и остеопонтина могут быть использованы для диагностики и мониторирования ТИ2-зависимого эозинофильного варианта воспаления при БА.
Персистирование аллергического воспаления в дыхательных путях лежит в основе неконтролируемого течения БА. Достижение у больного полного контроля над течением астмы является главной целью проводимого лечения при данном заболевании. В связи с тем, что воспаление дыхательных путей — это основное патогенетическое звено, определяющее течение БА, возникает необходимость проведения противовоспалительной терапии в качестве базисного лечения.
Для достижения и поддержания контроля над симптомами и течением БА в настоящее время используются следующие группы фармакологических средств:
- ингаляционные глюкокортикостероиды (ГКС),
- антагонисты лейкотриеновых рецепторов,
- кромоны,
- бета-2-агонисты,
- теофиллины длительного действия.
При тяжелой и резистентной к указанным фармакологическим препаратам астме применяются системные ГКС и анти-IgE-терапия. Кроме того, для патогенетической терапии БА в настоящее время разрабатываются и иные лекарственные препараты — антицитокинового и антимедиаторного действия.
Глюкокортикостероиды обладают высоким противовоспалительным и противоаллергическим действием, связанным с их способностью активировать противовоспалительные гены и подавлять многие из провоспалительных генов, которые были инициированы в процессе воспаления.
В результате наблюдаются ингибирование синтеза провоспалительных цитокинов, липидных медиаторов (лейкотриенов, простагландинов), торможение участия эозинофилов в развитии аллергического воспаления и экскреции эозинофильных медиаторов.
При БА назначаются прежде всего ингаляционные ГКС, что позволяет нивелировать возникновение системных побочных эффектов, свойственных этим препаратам. В результате лечения ими на 5-7-й день от начала терапии у большинства пациентов с недостаточным уровнем контроля БА отмечается исчезновение бронхообструктивного синдрома. К 3-й неделе лечения наблюдаются нормализация или значительное улучшение функции внешнего дыхания, снижение неспецифической бронхиальной гиперреактивности.
Терапия стартовой дозой ингаляционных ГКС проводится, как правило, в течение 3 мес и затем, при отсутствии симптомов, их суточная доза постепенно снижается до поддерживающей, предупреждающей обострение астмы. Поддерживающую дозу больные могут получать в течение нескольких лет. Применение ингаляционных ГКС повышает качество жизни больных БА.
Для проведения базисной противовоспалительной терапии при БА у детей в настоящее время используются следующие ингаляционные ГКС: беклометазона дипропионат, будесонид, циклесонид, флутиказона пропионат, мометазона фуроат. Эти препараты обладают высоким сродством к глюкокортикостероидным рецепторам, способны достигать высоких и длительно сохраняющихся терапевтических концентраций в тканях при местном использовании, быстро инактивируются за счет биотрансформации в печени после системной абсорбции. Наличие высокой местной противовоспалительной активности и низкой системной биодоступности является важным фактором эффективности и безопасности ингаляционных ГКС.
Беклометазона дипропионат — ингаляционный ГКС, обладающий значительной противовоспалительной активностью при наличии небольшого системного действия. Более 40 лет используется в терапии БА и продемонстрировал клиническую эффективность и благоприятный профиль безопасности у детей и взрослых с хронической персистирующей астмой.
Беклометазона дипропионат представляет собой пролекарство, которое в легких гидролизуется до беклометазона монопропионата, а он в свою очередь гидролизуется до беклометазона. Суточная доза беклометазона дипропионата составляет 200-1200 мкг и вводится в 3-4 приема.
Беклометазона дипропионат является действующей субстанцией в аэрозоли «Кленил с Джет-системой». Джет-система повышает депозицию аэрозоля в легких и снижает отложение его частиц в ротоглотке, что позволяет уменьшить риск развития орофарингеального кандидоза, кашля, осиплости голоса и системное воздействие препарата.
Одна ингаляционная доза содержит 200 или 250 мкг беклометазона дипропионата. Детям 6-12 лет назначается по 250 мкг 2 раза в сутки, у детей старше 12 лет при легкой БА суточная доза составляет 200-600 мкг за 2 ингаляции, при астме средней тяжести — 600- 1000 мкг за 2-4 ингаляции, при тяжелой астме — 1000-2000 мкг за 2-4 ингаляции.
Кленил УДВ представляет собой препарат на основе беклометазона дипропионата для небулайзерной терапии БА, выпускается в виде суспензии в ампулах, содержащих 800 мкг беклометазона дипропионата. Детям старше 6 лет препарат назначается по половине одноразовой ампулы для небулизации в дозе 400 мкг 1-2 раза в день.
Будесонид, уже 35 лет использующийся для терапии астмы, является единственным негалогенизированным ингаляционным ГКС. Препарат на 90% метаболизируется в печени и выводится из организма в виде неактивных продуктов обмена. В клетках при взаимодействии будесонида с жирными кислотами образуются комплексы, которые представляют собой внутриклеточные депо препарата.
Пульмикорт Турбухалер — это порошок будесонида, доставляемый в бронхи с помощью турбухалера. Одна ингаляционная доза Пульмикорта Турбухалера содержит 200 мкг препарата. Пульмикорт Турбухалер назначают детям старше 7 лет в суточной дозе 400-800 мкг в 2-4 приема.
Для лечения обострений БА у детей широкое применение находит суспензия Пульмикорта на основе будесонида, выпускаемая в небулах (для небулайзерной терапии). Используется также аналог Пульмикорта — Буденит Стери-Неб, дозированная суспензия. Для лечения детей с БА доза Пульмикорта в суспензии подбирается индивидуально, для детей в возрасте 6 мес и старше начальная доза этого препарата составляет 0,25-0,5 мг/сут. При необходимости доза может быть увеличена до 1 мг/сутки.
Бенакорт — отечественный глюкокортикостероидный препарат на основе будесонида. Препарат представляет собой порошок в ингаляторе циклохалер, содержащем 400 доз будесонида. В качестве наполнителя используется бензоат натрия, обладающий противогрибковой активностью. Другой формой Бенакорта является порошок для ингаляций в виде капсул (200 доз). Применяется у детей старше 7 лет в суточной дозе 400-800 мкг в 2-3 приема.
Флутиказона пропионат обладает выраженной противовоспалительной активностью. Терапия этим ингаляционным ГКС в течение 6 мес и более дает возможность добиться контроля над БА и достичь клинической ремиссии болезни.
Фликсотид — дозированный аэрозоль для ингаляций, выпускается во флаконах, 60 (120) ингаляционных доз по 125/250 мкг препарата, а также в виде порошка в ротодисках, в которых одна ингаляционная доза препарата может содержать 50, 100, 250 и 500 мкг флутиказона пропионата. В зависимости от тяжести течения БА Фликсотид назначается детям старше 4 лет в суточной дозе 100-500 мкг в 2 приема.
Циклесонид является экстрамелкодисперсным ингаляционным ГКС. Депозиция циклесонида происходит как в центральных, так и в периферических отделах бронхов. По своему механизму действия препарат является пролекарством, которое активируется в эндотелиальных клетках дыхательных путей с образованием активного метаболита дезциклесонида, имеющего в 100 раз большее сродство к глюкокортикостероидным рецепторам по сравнению с циклесонидом. Лечение циклесонидом способствует улучшению контроля БА, препарат обладает высокой клинической эффективностью.
Альвеско выпускается в виде аэрозольных упаковок с содержанием 40, 80 и 160 мкг в 1 ингаляционной дозе. Применяется при БА у детей с шестилетнего возраста. Доза препарата в зависимости от тяжести БА составляет 80-300 мкг.
Мометазона фуроат — ГКС, обладающий самой высокой аффинностью к глюкокортикостероидным рецепторам по сравнению с другими ГКС для ингаляционного применения при БА, что наряду с продолжительным периодом полужизни коррелирует с высоким уровнем терапевтической эффективности и безопасности.
Преимуществом Асманекса Твистхейлер является возможность применения препарата 1 раз в день, что способствует повышению приверженности больных лечению. Форма выпуска препарата в разных дозах (200 и 400 мкг) соответствует требованиям, предъявляемым к ступенчатой терапии БА, и позволяет повышать или снижать дозу в соответствии с характеристиками достигаемого контроля астмы.
Терапия низкими и средними дозами ингаляционных ГКС сводит к минимуму возможность возникновения системных побочных эффектов. Однако при терапии ингаляционными ГКС следует учитывать рост ребенка и рекомендовать использовать минимальные эффективные дозы препаратов у всех детей с БА.
Ингаляционные ГКС являются наиболее эффективными противовоспалительными препаратами, обеспечивающими достижение и поддержание контроля над симптомами и течением большинства случаев БА. Однако встречаются случаи стероидорезистентности, что требует увеличения доз препаратов и сопряжено с повышением риска формирования нежелательных побочных эффектов.
Понимание молекулярных механизмов действия ГКС позволяет детализировать причины формирования глюкокортикостероидной резистентности. В настоящее время установлено, что врожденная стероидорезистентность, связанная с мутациями в генах, кодирующих глюкокортикостероидные рецепторы, встречается при БА очень редко.
Чаще наблюдается приобретенная стероидорезистентность, которая при астме обусловлена главным образом модификацией глюкокортикостероидных рецепторов: под влиянием Тh2-провоспалительных цитокинов, продуктов нитрозилирующего и оксидативного стресса, микробных и грибковых суперантигенов, а также деградацией их под влиянием протеаз.
Проблему стероидорезистентности в настоящее время пытаются решить двояко. С одной стороны, продолжается интенсивное изучение фенотипов и эндотипов БА с целью определения когорт пациентов, у которых патогенетические особенности заболевания обусловливают исходную резистентность к ГКС (например, Тh17-опосредованные, преимущественно нейтрофильные варианты воспаления при БА). С другой стороны, интенсивно разрабатываются подходы к увеличению противовоспалительной активности ГКС, снижению вероятности нежелательных побочных эффектов данных препаратов. Эта работа осуществляется по трем направлениям.
- Комбинированная терапия — добавление к ингаляционным ГКС второго препарата для того, чтобы преодолеть стероидорезистентность и уменьшить дозы ГКС, необходимые для достижения клинического эффекта. Такими свойствами обладают пролонгированные бета-2-агонисты.
В настоящее время в клинической разработке имеются и новые препараты, такие как селективные ингибиторы р38-МАРК (митогенактивированной протеинкиназы). Ингибитор р38-МАРК оказывает влияние на транскрипцию генов, кодирующих синтез многих провоспалительных цитокинов, включая ФНО-а, ИЛ-4, ИЛ-5, ИЛ-8, RANTES и эотаксин, и тем самым на патогенез астмы.
Некоторые проявления стероидорезистентности могут быть нивелированы малыми дозами теофиллина. В качестве перспективных направлений рассматривается и применение антиоксидантов.
- Создание пропрепаратов (по типу цикпесонида, превращаемого в легких в его активную форму — С21 — деметилпропионил-циклесонид, что сопровождается низкой орально-глоточной абсорбцией), а также препаратов с высоким сродством к глюкокортикостероидным рецепторам, что позволяет вводить препараты 1 раз в день (циклесонид, флутиказона фуроат, мометазона фуроат).
- Разработка диссоциированных ГКС, которые оказывали бы различные по силе эффекты на процессы трансрепрессии и трансактивации генов, что позволило бы модулировать и нежелательные побочные эффекты данных препаратов.
Одним из способов повышения эффективности ингаляционных ГКС и преодоления стероидорезистентности при БА является использование комбинированной терапии. Наибольшее практическое применение в этой связи получили фиксированные комбинации ГКС и бета-2-агонистов длительного действия: флутиказона пропионат и сальметерола ксинафоат (Серетид, Тевакомб), будесонид и формотерола фумарат (Симбикорт), беклометазона дипропионат и формотерола фумарат (Фостер).
Комбинированная терапия сочетаниями препаратов такого рода является более эффективным методом лечения детей с тяжелым и среднетяжелым течением БА по сравнению с изолированным использованием ингаляционных ГКС.
Флутиказона пропионат + сальметерола ксинафоат (оригинальная комбинация — Серетид, GlaxoSmithKline, Великобритания) выпускается в форме порошкового ингалятора — Серетид Мультидиск, каждая доза которого содержит 50 мкг сальметерола ксинафоата и 100, 250 и 500 мкг флутиказона пропионата, и в форме дозированного аэрозольного ингалятора (без фреона), каждая доза которого содержит 25 мкг сальметерола ксинафоата и 50, 125 и 250 мкг флутиказона пропионата.
Применяется в режиме стабильного дозирования с четырех лет жизни. Доза Серетида определяется возрастом ребенка и тяжестью БА. Эффективность лечения проявляется уменьшением симптомов и обострений БА, достижением у ряда больных клинической ремиссии. Отмечается хорошая переносимость препарата.
Будесонид + формотерола фумарат (оригинальная комбинация — Симбикорт Турбухалер, Astra Zeneca, Швеция) — препарат для ингаляционного применения у детей с 6 лет жизни. Больным 6-12 лет препарат рекомендован в режиме 80/4,5 мкг/дозу по 2 ингаляции 2 раза в сутки, детям 12 лет и старше — 160/4,5 мкг/дозу по 1-2 ингаляции 2 раза в сутки.
При терапии Симбикортом Турбухалером возможен гибкий режим дозирования с увеличением дозы в период обострения (до 2 ингаляций 2 раза в сутки) и снижением до поддерживающей дозы (по 1 ингаляции 1 раз в сутки) при стабильном состоянии больных. Наблюдается хорошая переносимость препарата.
Беклометазона дипропионат + формотерола фумарат (оригинальная комбинация — Фостер, Chiesi, Италия) представляет собой фиксированную комбинацию 100 мкг экстрамелкодисперсного беклометазона дипропионата и 6 мкг формотерола фумарата в разовой дозе в дозированном аэрозольном ингаляторе технологии «Модулит». Препарат применяется у детей старше 12 лет по 1-2 ингаляции 2 раза вдень. Лечение способствует уменьшению частоты симптомов БА и количества ее обострений, отмечена хорошая переносимость препарата.
Флутиказона фуроат + вилантерола трифенатат— это комбинация ингаляционного ГКС и бета-агониста ультрадлительного действия (оригинальная комбинация — Breo Ellipta, GlaxoSmithKline, Великобритания) с введением один раз в день. Проведены клинические исследования III фазы у подростков в возрасте от 12 лет и старше и у взрослых пациентов с астмой. Эффективность однократного применения 100/25 мкг препарата вдень сопоставима с результатами применения 250/50 мкг флутиказона пропионата + сальметерол дважды в день у больных с персистирующей астмой, не контролируемой ингаляционными ГКС в средних дозах после 24 нед лечения.
Мометазона фуроат + формотерола фумарат — оригинальная комбинация Зенхейл, ЗМ Health Саге Ltd. (США); Organon (Ирландия). В дозировках 100/5 и 200/5 мкг 2 раза в день рекомендован для лечения БА у подростков и взрослых.
Флутиказона пропионат + формотерола фумарат— оригинальная комбинация Flutiform, SkyePharma (Швейцария). Продемонстрировано, что в дозе 250/10 мкг обеспечивает более высокую эффективность по сравнению с монотерапией флутиказоном пропионатом для контролирования среднетяжелой и тяжелой БА, с профилем безопасности, аналогичным монотерапии флутиказоном пропионатом.
Назначение ингаляционных ГКС и комбинированных препаратов целесообразно прежде всего при персистирующей среднетяжелой или тяжелой БА. Их применение при легкой персистирующей форме астмы эффективно, но не всегда является столь необходимым, поскольку достичь контроля течения можно и нестероидной противовоспалительной терапией (кромоны, антагонисты лейкотриеновых рецепторов).
Предполагают, что в некоторых случаях альтернативой бета-2-агонистам длительного действия при БА могут быть антихолинергические средства длительного действия, в том числе в сочетании с ингаляционными ГКС. Данная идея в настоящее время вызывает большой интерес. В этой связи активно изучаются антихолинергические средства длительного действия.
- Тиотропия бромид, в том числе в сочетании с ингаляционными ГКС, находится в III фазе клинических исследований возможностей применения для лечения детской и подростковой астмы. У взрослых пациентов с астмой введение в терапию данного препарата было связано со значительным снижением частоты развития обострений.
- Умеклидиниума бромид находится в настоящее время на этапе II фазы клинических исследований возможности использования для лечения астмы в качестве как монотерапии, так и варианта, комбинированного с ингаляционными ГКС лечения.
- Аклидиниума бромид — проводимые исследования свидетельствуют о бронходилатирующем и противовоспалительном эффекте.
Антагонисты лейкотриеновых рецепторов имеют широкое применение в лечении БА у детей.
Монтелукаст натрия (Сингуляр, Монтелар, Монте- ласт, Синглон) ингибирует цистеиниловые лейкотриеновые рецепторы, применяется у детей с 2 лет. Доза его в 2-5 лет составляет 4 мг в жевательной таблетке, в 6-14 лет — 5 мг в жевательной таблетке 1 раз в сутки, для детей 15 лет и старше — 1 таблетка, покрытая оболочкой, 10 мг в сутки.
Этот препарат предупреждает возникновение дневных и ночных симптомов БА, снижает частоту ее обострений приаспириновой, вирус-индуцированной астме и астме физического усилия, уменьшает проявления сопутствующего аллергического ринита, персистирующего и интермиттирующего.
Монтелукаст натрия используется в качестве монотерапии для контроля легкой астмы; в комбинации с ингаляционными ГКС может быть эффективным при среднетяжелой и тяжелой астме, позволяя снизить дозу ГКС. Препарат также применяется на этапе отмены или снижения дозы ГКС для сохранения достигнутого контроля БА. Переносимость монтелукаста натрия хорошая, сравнительно редко отмечаются головная боль, тошнота.
Теофиллин используется для лечения заболеваний дыхательных путей уже более 100 лет. Первоначально он применялся как бронхолитическое средство, но относительно высокие дозы, необходимые для купирования бронхиальной обструкции данным препаратом, вызывают нежелательные побочные эффекты, поэтому его использование с данной целью сократилось.
Однако при более низких концентрациях для теофиллина свойственны противовоспалительные эффекты, обусловленные ингибированием PDE4 и активацией гистондезацетилазы-2, в результате чего происходит выключение активированных воспалительных генов. Благодаря этому механизму теофиллин уменьшает стероидорезистентность, что может иметь особое значение у пациентов с тяжелой астмой.
Препараты метилксантинового ряда ингибируют А1-рецепторы к аденозину, вызывая бронходилатирующий эффект, тормозят высвобождение тучными клетками и базофилами медиаторов воспаления, усиливают апоптоз эозинофилов, ингибируя развитие воспаления в дыхательных путях.
В настоящее время в терапии БА используются преимущественно небольшие дозы медленно высвобождаемых теофиллинов (Неотеопек А, Теопэк, Вентакс, Теотард, Этифиллин и др.). У детей с БА пролонгированные теофиллины могут быть назначены с противовоспалительной целью в невысоких дозах как компонент базисной терапии в течение 1-2 мес.
Терапия дюрантными теофиллинами способствует урежению приступов астмы, повышению толерантности к физической нагрузке, снижению у некоторых больных дозы ингаляционных ГКС. Переносимость теофиллинов в данных дозах у большинства детей хорошая. В единичных случаях отмечаются нарушение сна, тахикардия, тошнота, рвота, головные боли из-за ингибирования фосфодиэстеразы, при более высоких концентрациях наблюдаются сердечные аритмии.
У детей с тяжелым течением БА при недостаточной эффективности лечения ингаляционными ГКС и длительного действия бета-2-агонистами дополнительное назначение монтелукаста натрия и дюрантных теофиллинов позволяет повысить эффективность терапии и достичь контроля заболевания.
Рофлумиласт — ингибитор фосфодиэстеразы 4 — одобрен для применения у пациентов с хронической обструктивной болезнью легких. Его потенциальные противовоспалительные эффекты были продемонстрированы в небольшом рандомизированном плацебоконтролируемом клиническом исследовании у пациентов с мягкой аллергической астмой.
Кромоны (кромоглициевая кислота и недокромил натрия) способны при экспозиции с причинно-значимым аллергеном предотвращать развитие бронхоспазма, ранней и поздней фазы аллергической реакции, тормозить повышение реактивности бронхов, эффективны преимущественно у детей с легким течением БА. Данная группа препаратов мало влияет на уже развившееся обострение заболевания.
Кромогликат натрия выпускается как в виде дозированных аэрозолей, так и в виде 2% раствора по 2 мл для ингаляций через небулайзер. Кратность ингаляций препаратов кромоглициевой кислоты составляет 4 раза в день. Для базисной терапии целесообразно длительное, не менее 3 мес применение препарата.
При легкой астме кромогликат натрия используют для профилактики сезонных обострений заболевания и для предупреждения обострений БА при физическом напряжении. Препарат хорошо переносится. Побочные явления редки, проявляются в основном местной реакцией в виде раздражения верхних дыхательных путей, кашля, редко — бронхоспазма.
Недокромил натрия (Тайлед) подавляет высвобождение медиаторов воспаления из тучных клеток, эозинофилов, нейтрофилов, моноцитов, макрофагов и тромбоцитов, тормозит развитие бронхоспазма, поздние аллергические реакции, снижает неспецифическую гиперреактивность бронхов и частоту обострений БА. Препарат выпускается в виде дозированного аэрозоля, применяется у детей старше 2 лет по 2 мг (1 ингаляционная доза) 2-4 раза в сутки.
При тяжелом, рефрактерном к традиционной фармакотерапии течении БА эффективной может быть анти-IgE-терапия, основанная на парентеральном введении анти-IgE-антител в виде препарата омализумаб (Ксолар).
Омализумаб связывает свободноциркулирующие в крови IgE, снижает продукцию высокоаффинных рецепторов на мембране тучных клеток и базофилов, что приводит к уменьшению экскреции медиаторов, выраженности аллергического воспаления и обратному развитию обострения БА.
Перед началом лечения рассчитывается индивидуальная доза омализумаба с учетом уровня общего IgE в периферической крови и массы тела ребенка, препарат вводится подкожно. Омализумаб способствует снижению частоты обострений БА, количества госпитализаций и обращений за неотложной помощью, уменьшению объема базисной терапии с достижением в большинстве случаев полного контроля болезни.
После начала терапии в отдельных случаях может отмечаться головная боль, а в месте его подкожного введения — возникновение отека, эритемы, зуда. Основным показанием к назначению омализумаба является тяжелая БА у детей 6 лет и старше, рефрактерная к проводимой фармакотерапии.
Основываясь на традиционных сведениях о Тh2-зависимом генезе астмы и эозинофильном воспалении дыхательных путей при данном заболевании, мишенями антицитокиновой терапии помимо IgE следует рассматривать также интерлейкины ИЛ-5, ИЛ-13, ИЛ-4, ИЛ-9.
Анти-интерлейкин-5-антитела. ИЛ-5 задействован в активации и созревании эозинофилов. Меполизумаб анти-ИЛ-5-антитела — в ходе III фазы клинического исследования DREAM, включавшем пациентов в возрасте 12-74 лет с рецидивирующим тяжелым течением БА и признаками эозинофильного воспаления, продемонстрировал эффективность терапии, в том числе в виде снижения обострений БА на 52% в год.
В настоящее время в рамках III этапа клинических исследований проводится изучение антител к рецептору ИЛ-5 (Benralizumab), эффекты истощения эозинофилов наблюдаются в течение нескольких месяцев после одной инъекции данного препарата.
Анти-интерлейкин-13-антитела. ИЛ-13 является важным медиатором БА и воспроизводит большинство ее характеристик в экспериментальных моделях, в том числе ремоделирование, гиперпродукцию слизи, синтез IgE, рекрутирование эозинофилов и базофилов.
Для оценки эффективности анти-ИЛ-13-терапии используется новый сывороточный биомаркер астмы периостин, который является компонентом внеклеточного матрикса, полученного из эпителиальных клеток дыхательных путей в ответ на воздействие ИЛ- 13 и ИЛ-4, высвобождение его подавляется ГКС. Содержание сывороточного периостина позволяет дифференцировать пациентов с «выраженным» и с «невыраженным» Тh2-фенотипом БА.
Специфические анти-ИЛ-13-антитела — препараты Lebrikizumab, Tralokinumab, Anrukinzumab Lebrikizumab вводят подкожно один раз в месяц. В рандомизированном многоцентровом исследовании (219 пациентов) препарат был эффективнее у пациентов с исходным более высоким уровнем периостина в сыворотке крови.
Анти-интерлейкин-4-антитела. ИЛ-4 участвует в дифференцировке ТЬ2-клеток, переключении на синтез IgE, рекрутировании эозинофилов и тучных клеток.
Altrakincept — растворимые рекомбинантные человеческие рецепторы к ИЛ-4, предназначенные для ингаляционной терапии. Данный препарат нейтрализует активацию иммунных и иных клеток, вызываемую ИЛ-4. Однократная ингаляция этого препарата у взрослых с умеренной астмой приводит к улучшению функции легких и снижению уровня выдыхаемого оксида азота.
Pitrakinra — антагонист гетеродимерного рецепторного комплекса — ИЛ-4R-ИЛ-13Ра — разработан для преодоления биологической избыточности ИЛ-4 и ИЛ-13, что, возможно, компенсирует неэффективность стратегий, направленных только на учет ИЛ-4. Pitrakinra ингибирует аллергениндуцированные аллергические реакции и обострение заболевания у взрослых с эозинофильной астмой. AMG 317 является моноклональным антителом, направленным на рецепторы к ИЛ-4, оно блокирует связывание ИЛ-4 с его рецептором, а также ингибирует сигнал трансдукции ИЛ-13. У взрослых с умеренной и тяжелой астмой AMG 317 производит значительное клиническое улучшение только в подгруппе с отсутствием контроля заболевания.
Dupilumab — одна из последних разработок анти-ИЛ-4-терапии, воздействует на альфа-субъединицу рецептора ИЛ-4. Его применение у больных с эозинофильной астмой вследствие ингибирования как ИЛ- 4 и ИЛ-13 сопровождается значительным сокращением обострений БА и улучшением функции легких у взрослых с персистирующей астмой, отменой бета-агонистов и уменьшением дозы ингаляционных ГКС.
ОС000459 — оральный антагонист CRTH2 (хемоаттрактант рецептор-гомологичной молекулы Th2-xeлпeров). В рандомизированном двойном слепом исследовании (фаза II клинических исследований) у взрослых с умеренной персистирующей астмой применение орального антагониста CRTH2 сопровождалось улучшением функции легких, купированием ночных симптомов и улучшением качества жизни по сравнению с плацебо.
MEDI-528 — анти-ИЛ-9-антитела. Применение данного препарата продемонстрировало тенденцию к улучшению показателей контроля у взрослых с легкой и умеренной астмой, а также протективный эффект против бронхоспазма.
Возможными мишенями при разработке новых подходов в лечении БА являются молекулы TSLP, ИЛ-25 и ИЛ-33, которые продуцируются эпителиальными клетками дыхательных путей в ответ на воздействие аллергенов или вирусных триггеров, поэтому рассматриваются в качестве возможных мишеней при создании новых подходов влечении астмы.
Терапия, ориентированная на нейтрофильное воспаление. Нейтрофильное воспаление при БА ассоциировано с интерлейкинами ИЛ-17 и ИЛ-23. Secukinumab — анти-ИЛ-17-антитела — в настоящее время проходит II этап клинических исследований.
Следует отметить, что национальные и международные согласительные документы рекомендуют ступенчатый подход для достижения и поддержания контроля БА. Переход на следующую или предыдущую ступень может быть осуществлен через определенное время в зависимости от тяжести БА, на фоне оценки уровня контроля заболевания при регулярном наблюдении врача.
Достижению контроля при атопической БА способствует проведение аллерген-специфической иммунотерапии причинно-значимыми аллергенами и снижение их уровня в окружении больного.
Осуществление мониторинга, выполняемого при БА у детей, включает исследование функций внешнего дыхания и концентрации оксида азота в выдыхаемом воздухе, оценку реактивности бронхов.
Достижению и поддержанию контроля астмы способствует реализация образовательных программ для родителей и больных астмой детей.
В случае возникновения приступов БА проводится ингаляционная терапия бета-2-агонистами короткого действия или комбинированными препаратами (Беродуал), дозированными ингаляторами или через небулайзер. При тяжелых приступах проводится лечение ингаляционными и системными ГКС (per os или парентерально). При астматическом статусе эффективна инфузионная терапия Эуфиллином и ГКС.
Несмотря на наличие широкого спектра препаратов для базисной противовоспалительной терапии и препаратов для неотложной помощи, сохраняется проблема неконтролируемого или плохо контролируемого течения бронхиальной астмы, что обусловливает потребность в разработке дополнительных диагностических и терапевтических подходов.
В этой связи для оптимизации патогенетической терапии бронхиальной астмы в настоящее время проводится работа по совершенствованию противовоспалительных препаратов имеющихся классов и их сочетаний. Кроме того, ведется поиск принципиально новых подходов к терапии астмы, в том числе с учетом фенотипов и эндотипов болезни, включая создание и внедрение в практику лекарственных препаратов антицитокинового и антимедиаторного действия.
Есть надежда, что по мере детализации знаний о молекулярных характеристиках эндотипов астмы и внедрения в практику биомаркеров, позволяющих диагностировать фенотипы и эндотипы болезни, а также мониторировать уровень контроля, будет реализован персонализированный подход в назначении индивидуальной терапии каждому конкретному пациенту.
источник