Более 300 миллионов человек во всем мире страдают астмой, большинство из которых имеют легкое или умеренное течение заболевания, которое контролируется ингаляционными кортикостероидами, как самостоятельно, так и в сочетании с ингаляционными бронхолитиками длительного действия. Тем не менее значительная часть пациентов с тяжелым и среднетяжелым течением астмы, имеют слабо контролируемые симптомы и подвергаются повышенному риску обострений. Около 10% всех пациентов с бронхиальной астмой требуют дополнительной терапии для достижения контроля астмы.
Бронхиальная астма имеет много подтипов, которые называются фенотипы и проявляются в результате специфических клеточных и молекулярных механизмов, называемых эндотипами. Определение фенотипа астмы помогает врачам аллергологам и пульмонологам принимать рациональные терапевтические решения, в то время как понимание эндотипов приводит к разработке прецизионных (таргетных) препаратов.
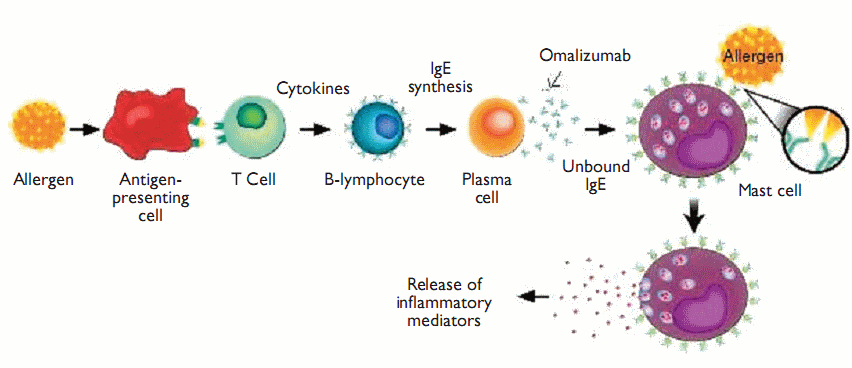
Тяжелая астма возникает в 5-10% от астматической популяции, из них более 50% имеют аллергическую IgE-опосредованную астму. Аллергическая или атопическая бронхиальная астма является одним из примеров фенотипа астмы, ключевую роль в патогенезе которой играет иммуноглобулин E (IgE).
Отличительной чертой аллергической астмы от других фенотипов является взаимосвязь приступов с триггерным фактором. Специфический IgE связывается с высокоаффинными рецепторами (FCɛRI) на тучных клетках и базофилах для индукции аллергической реакции путем высвобождения широкого спектра воспалительных медиаторов, таких как метаболиты гистамина, триптазы и арахидоновой кислоты.
Триггеры аллергической астмы
Для определения аллергического фенотипа бронхиальной астмы врач аллерголог или пульмонолог оценивает:
- Анамнез жизни и заболевания
- Связь между симптомами астмы и триггерными факторами
- Данные физического осмотра пациента
- Тесты на аллергию:кожные пробы и анализы на аллергены
- Обследование функции внешнего дыхания и другие функциональные исследования
Идентификация триггеров астмы может помочь получить точный диагноз, подобрать эффективное лечение и разработать рекомендации по элиминационным мероприятиям.
- Тенденция к проявлению в раннем детском возрасте и чаще у мальчиков.
- Бронхоспазм, вызванный физическими упражнениями, обычно встречается и более выражен у пациентов с аллергической астмой по сравнению с другими фенотипами.
- Тяжесть симптомов может меняться в течение года, таким образом, указывая на сенсибилизацию человека к определенным пыльцевым аллергенам.
- Аллергическая астма часто сопровождается другими аллергическими заболеваниями, включая конъюнктивит, пищевую аллергию, атопический дерматит и ринит, а также в некоторых случаях полипоз носа и хронический синусит.
Омализумаб — биологическое лечение аллергической астмы
Омализумаб — это моноклональное антитело, которое нейтрализует сывороточный иммуноглобулин (Ig) E и представляет собой специфическое таргетное лечение, которое было разработано в результате понимания эндотипа аллергической астмы. Omalizumab широко используется в клинической практике в Европе, более десяти лет, в качестве дополнительной терапии для лечения пациентов с тяжелой и среднетяжелой рефрактерной аллергической астмой.
Омализумаб снижает IgE-опосредованное воспаление дыхательных путей. Недавние долгосрочные клинические испытания подтверждают преимущества омализумаба в снижении обострений и симптомов у взрослых и у детей с умеренной и тяжелой аллергической астмой. Лечение омализумабом также снижает регуляцию рецепторов FCɛRI на тучных клетках и базофилах.
Таким образом, омализумаб уменьшает воспаление аллергических дыхательных путей путем снижения экспрессии высокоаффинных IgE-рецепторов на воспалительных клетках и числа эозинофилов в дыхательных путях. В настоящее время ведутся исследования, чтобы помочь определить, способствует ли долгосрочное лечение омализумабом ремоделированию дыхательных путей.
источник
Несмотря на расширение понимания патофизиологии астмы и постоянные успехи в борьбе с болезнями, небольшая подгруппа пациентов остается частично контролируемой или не соответствующей стандартным методам лечения. При идентификации иммуноглобулина Е и других воспалительных медиаторов исследования и разработки целевых агентов процветают. Омализумаб представляет собой гуманизированное моноклональное антитело, которое специфически нацеливается на циркулирующий иммуноглобулин E, который, в свою очередь, препятствует и уменьшает последующие выбросы провоспалительных медиаторов. В последнее десятилетие омализумаб оказался эффективным и хорошо переносимым при лечении астмы от умеренной до тяжелой степени как в исследованиях, так и в реальных исследованиях, в первую очередь в снижении уровня обострения и использования кортикостероидов. В то время как растущие данные свидетельствуют о том, что омализумаб может быть потенциально полезен при лечении других аллергических заболеваний, его показания остаются ограниченными при лечении тяжелой аллергической астмы и хронической идиопатической крапивницы. Будущие усилия могут быть сфокусированы на определении оптимальной длины лечения омализумабом, поиске биомаркеров, которые могли бы лучше прогнозировать реакцию на лечение, а также распространять свои показания.
В соответствии с растущим пониманием патофизиологии астмы концепции болезни и определение тяжести заболевания развивались в течение последних двух десятилетий.1-4 Хотя астму можно охарактеризовать и определить с помощью проявления симптомов коллективных респираторных заболеваний, гетерогенное заболевание с участием сложных патофизиологических механизмов. В последнем отчете о глобальной астме в 2014 году отмечается заметное увеличение распространенности астмы и, по оценкам, затронуто 334 миллиона человек во всем мире, что свидетельствует о наличии глубокого социально-экономического бремени5.
Согласно последней Глобальной стратегии по борьбе с астмой и профилактике от Глобальной инициативы по борьбе с астмой (GINA), степень тяжести астмы оценивается на основе уровня лечения, необходимого для достижения и поддержания контроля симптомов.6 В то время как большинство астмы можно контролировать с помощью лечения с низкой интенсивностью , меньшинство пациентов, вероятно, составляющих 5% от общей популяции астмы, могло только достичь субоптимального контроля симптомов с оптимизированным лечением.2,7,8 Тяжелая астма определяется как пациенты, у которых симптомы или обострения требуют применения высокодозной ингаляции кортикостероид (ICS) плюс второй контролер или у которого болезнь сохраняется, несмотря на использование этого лечения, и те, кто только частично реагирует на лечение сопутствующих заболеваний.6
Несмотря на то, что тяжелая астма влияет на относительно небольшое население, его связанное воздействие на использование и расход ресурсов здравоохранения и качество жизни пациента (QoL) являются существенными.9 Дополнительные методы лечения, такие как пероральные кортикостероиды (OCS), тиотропийбромид, бронхиальная термопластика (ВТ) и молекулярно-целевые агенты были предложены для этой подгруппы пациентов.6 В последние годы было показано, что добавление тиотропийбромида к ICS и агонистам β-адренорецепторов длительного действия (LABA) значительно улучшает функцию легких, снизить уровень обострения у пациентов с плохо контролируемой астмой.10 Кроме того, данные в реальном времени свидетельствуют о том, что добавление тиотропия может быть полезным с точки зрения сокращения числа посещений и госпитализаций в случае чрезвычайных ситуаций.11 BT — это новый инвазивный подход, разработанный для снижения плавного движения дыхательных путей мышцы, которая вызывает бронхоспазм. Хотя систематические обзоры показали умеренное улучшение QoL пациента и устойчивые эффекты через 5 лет, роль БТ в лечении тяжелой астмы остается ограниченной, поскольку недостаточное понимание в ее механизме действия, окончательные преимущества и потенциальный вред.2,12- 14 В свете достижений в области молекулярных технологий парадигма лечения астмы была направлена в сторону индивидуального управления15. Благодаря идентификации медиаторов, которые участвуют в астматическом воспалительном процессе, растет число новых целевых агентов, таких как омализумаб ( анти-иммуноглобулин E [IgE]), меполизумаб (анти-IL-5) и лебрикизумаб (анти-IL-13). Таким образом, клиническая реализация этих биологических целевых терапий требует тщательного отбора пациентов, чтобы обеспечить наиболее удовлетворительный outcome.17
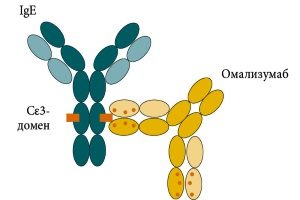
Большой объем доказательств показал, что воспалительный каскад может быть активирован связыванием IgE с FcRI, высокоаффинными рецепторами, которые присутствуют на поверхности тучных клеток и базофилов.18-20 Кроме того, было установлено, что присутствие IgE могло бы регулировать экспрессию FcεRI на эффекторных клетках.21 Признание IgE как основного медиатора в воспалительном каскаде впоследствии спровоцировало развитие агентов, которые направлены на селективную нейтрализацию IgE. Омализумаб представляет собой рекомбинантное гуманизированное моноклональное антитело, которое специфически связывается с циркулирующим IgE. Род занятий Cε3-области свободного IgE впоследствии ингибирует его связывание с высокоаффинными рецепторами или наоборот. Снижение концентрации IgE, в свою очередь, снижает экспрессию FcRI на тучные клетки и базофилы, тем самым прерывая воспалительный каскад и высвобождая провоспалительные медиаторы.22-24
Используя гуманизированные анти-IgE-моноклональные антитела (rhuMab-E25) у 15 пациентов, MacGlashan и др. 23 сообщили о 99% и 97% снижении уровней IgE и FcRI в сыворотке соответственно. Хотя проблемы с анафилактической реакцией с омализумабом были первоначально вызваны, многочисленные исследования фармакокинетики (ПК) показали, что он хорошо переносится как педиатрическими, так и взрослыми пациентами с астмой. 25-27. Основываясь на многообещающих данных и благоприятном профиле безопасности, омализумаб сначала получил одобрение от австралийских органов здравоохранения для лечения взрослых и подростков с умеренной аллергической астмой в 2002 году. Он был одобрен в США и ЕС в 2003 и 2005 годах, соответственно, в качестве дополнительной терапии для лечения стойкой аллергической астмы от умеренной до тяжелой степени. Ввиду более широкого признания неудовлетворенной потребности в тяжелой астме, Гумберт и др. 28 запустили международное ключевое исследование (ИННОВАЦИЯ) для оценки преимуществ омализумаба в качестве дополнительной терапии исключительно у пациентов, которые недостаточно контролируются с помощью ICS plus LABA с высокой дозой терапии (шаг GINA 2002 г.). Было показано, что во время 28-недельного лечения было продемонстрировано, что омализумаб эффективно снижает уровень клинически значимого обострения астмы, а также серьезное обострение и экстренный визит на 26%, 50% и 44% соответственно по сравнению с плацебо.28 Также был обнаружен омализумаб чтобы значительно улучшить связанный с астмой QoL, пока не был обнаружен сигнал безопасности, за исключением более высокой частоты реакций на месте инъекции.28 В Кокрановском обзоре 2006 года были собраны и проанализированы 14 плацебо-контролируемых исследований, в общей сложности 3 143 пациента с легкой до тяжелой аллергическая астма. Авторы пришли к выводу, что добавление омализумаба может уменьшить обострения астмы и привести к снижению или прекращению доз ICS29.
Совсем недавно эффективность омализумаба была дополнительно оценена и установлена в реальных условиях среди пациентов с астмой средней и тяжелой степени. Французское историко-проспективное исследование показало, что терапевтическое использование омализумаба может снизить степень обострения, дозу OCS, посещений в случае чрезвычайных ситуаций и госпитализаций по сравнению с их данными за предыдущий год30. Увеличение и накопление омализумаба в обычной практике с течением времени способствовало расследованию его долгосрочных выгод. Наблюдения из исследования PERSIST показали, что 52-недельное лечение омализумабом может значительно улучшить функцию легких и QoL пациентов и снизить уровень обострения.31 Более того, сокращение использования медико-санитарной помощи отразилось на снижении темпов посещений и госпитализации в чрезвычайных ситуациях в течение лечения.31 Согласованная или даже превосходная эффективность омализумаба была отмечена в обширных реальных долгосрочных исследованиях по сравнению с рандомизированными контролируемыми исследованиями (РКИ). 30-33 Недавний международный наблюдательный регистр (eXpeRience) дополнительно подтвердили вышеупомянутые преимущества, а также уменьшили или прекратили лечение OCS в течение 12 и 24 месяцев у 943 пациентов с неконтролируемой стойкой астмой.34 Характеристики пациента и клинические результаты вышеупомянутых рандомизированных исследований суммированы в таблице 1.23,28,35,36
источник
Селективный иммунодепрессант. Представляет собой рекомбинантные гуманизированные моноклональные IgG1κ антитела, которые селективно связываются с IgЕ человека. Получают по технологии рекомбинантной ДНК в системе для экспрессии, представленной клетками яичников китайского хомячка.
Белый лиофилизированный порошок. Молекулярная масса примерно 149 кДа.
Астма. Омализумаб ингибирует связывание IgE с высокоаффинными рецепторами IgE (FcεRI), расположенными на поверхности тучных клеток и базофилов. Снижение количества поверхностно-связанного IgE на клетках, имеющих рецепторы FcεRI, лимитирует степень высвобождения медиаторов аллергического ответа. При лечении омализумабом пациентов с атопической бронхиальной астмой отмечается уменьшение количества FcεRI-рецепторов на поверхности базофилов.
Хроническая идиопатическая крапивница. Омализумаб связывается с IgE и снижает уровень свободного IgE. Впоследствии происходит down-регуляция клеточных IgE-рецепторов (FcεRI). Механизм, с помощью которого реализуются эффекты омализумаба в отношении снижения симптомов хронической идиопатической крапивницы, неизвестен.
Астма. В клинических исследованиях содержание свободного IgE в сыворотке дозозависимо уменьшалось в течение 1 ч после введения первой дозы омализумаба и поддерживалось на достигнутом уровне в периоды между введениями последующих доз. При применении в рекомендуемых дозах среднее уменьшение свободного IgE в сыворотке составляло более 96%. Общий уровень IgE (связанного и несвязанного) в сыворотке крови повышался после первой дозы вследствие образования комплекса омализумаб-IgE, характеризующегося более медленной скоростью выведения по сравнению со свободным IgE. На 16-й неделе после введения первой дозы омализумаба средний уровень общего IgE в сыворотке был в 5 раз выше по сравнению с таковым до лечения. После отмены омализумаба обусловленное его действием увеличение общего IgE и уменьшение свободного IgE были обратимыми, не было отмечено увеличение концентрации IgE в сыворотке крови после полного выведения препарата из организма. Содержание общего IgE оставалось повышенным в течение 1 года после отмены омализумаба.
Хроническая идиопатическая крапивница. В клинических исследованиях у пациентов с хронической идиопатической крапивницей лечение омализумабом приводило к дозозависимому уменьшению содержания свободного IgE и увеличению уровня общего IgE в сыворотке крови, аналогично наблюдениям у больных бронхиальной астмой. Максимальное снижение свободного IgE наблюдалось через 3 дня после п/к введения первой дозы. После повторного введения омализумаба 1 раз каждые 4 нед содержание свободного IgE в сыворотке перед введением очередной дозы поддерживалось на достигнутом уровне в период между 12 и 24 нед лечения. Уровень общего IgE в сыворотке крови возрастал после первой дозы вследствие образования комплекса омализумаб-IgE, который имеет более низкую скорость выведения по сравнению со свободным IgE. После повторного введения 1 раз каждые 4 нед в дозе от 75 до 300 мг средние уровни общего IgE в сыворотке перед введением очередной дозы на 12-й нед лечения были в 2–3 раза выше по сравнению с уровнями до лечения и оставались стабильными в период между 12 и 24 нед лечения. После отмены омализумаба, в течение 16 нед последующего наблюдения, уровни свободного IgE увеличивались, а уровни общего IgE снижались по отношению к исходным.
После п/к введения абсолютная биодоступность омализумаба составляет в среднем 62%. После однократного п/к введения взрослым и подросткам с бронхиальной астмой всасывание омализумаба происходит медленно, Cmax достигается в среднем через 7–8 дней. У пациентов с хронической идиопатической крапивницей после однократного п/к введения Cmax в сыворотке крови достигается примерно в то же время. При применении в дозах более 0,5 мг/кг фармакокинетика омализумаба имеет линейный характер. После многократного введения омализумаба в течение периода до 14 сут пациентам с астмой величина AUC в равновесном состоянии была в 6 раз выше, чем после введения однократной дозы.
In vitro омализумаб с IgE образует комплекс определенного размера. In vitro или in vivo не наблюдалось образования преципитирующих комплексов и комплексов, молекулярная масса которых превышала 1 млн дальтон. После п/к введения омализумаба пациентам с астмой кажущийся Vd составлял (78±32) мл/кг. На основании популяционной фармакокинетической модели было показано, что распределение омализумаба у пациентов с хронической идиопатической крапивницей было сходно с таковым у пациентов с атопической бронхиальной астмой.
Клиренс омализумаба включает как собственно клиренс IgG, так и клиренс путем специфического связывания и образования комплексов с лигандом-мишенью — свободным IgE сыворотки крови. Печеночная элиминация IgG включает деградацию в ретикулоэндотелиальной системе печени и эндотелиальных клетках печени. Интактный IgG также выводится с желчью. У пациентов с бронхиальной астмой T1/2 омализумаба из сыворотки составлял в среднем 26 дней, кажущийся клиренс в среднем составлял (2,4±1,1) мл/кг/сут. Кроме того, при увеличении массы тела вдвое отмечалось приблизительно двукратное увеличение кажущегося клиренса. Основываясь на данных популяционной фармакокинетики, показано, что у пациентов с хронической идиопатической крапивницей T1/2 из сыворотки в равновесном состоянии — в среднем 24 дня, кажущийся клиренс — около 240 мл/сут (что соответствует 3 мл/кг/сут для пациента массой тела 80 кг).
Фармакокинетика в особых клинических случаях
Не обнаружено различий в фармакокинетике у пациентов разного возраста (12–76 лет), пола, расовой или этнической принадлежности.
Фармакокинетические и фармакодинамические параметры омализумаба у пациентов с нарушениями функции почек или печени не изучены.
Длительных исследований по оценке канцерогенного действия омализумаба у животных не проведено.
Не обнаружено мутагенной активности в тесте Эймса с использованием шести различных штаммов бактерий, с/без метаболической активации при концентрациях омализумаба до 5000 мкг/мл.
Лечение персистирующей атопической бронхиальной астмы среднетяжелого и тяжелого течения, симптомы которой недостаточно контролируются применением ГКС , у пациентов 6 лет и старше; лечение хронической идиопатической крапивницы, резистентной к терапии блокаторами H1-гистаминовых рецепторов, у пациентов 12 лет и старше.
Больные с нарушениями функции печени и/или почек, с аутоиммунными заболеваниями или заболеваниями, связанными с накоплением иммунных комплексов.
В экспериментальных исследованиях омализумаб не оказывал отрицательное влияние на течение беременности, развитие эмбриона и плода, на течение родов и развитие новорожденных.
Адекватных и строго контролируемых исследований по применению омализумаба у беременных женщин не проводилось. Известно, что молекулы IgG проникают через плацентарный барьер. Применение омализумаба при беременности возможно только в тех случаях, когда ожидаемая польза для матери превышает потенциальный риск для плода.
Категория действия на плод по FDA — B.
Неизвестно, выделяется ли омализумаб с грудным молоком у человека. Человеческий IgG выделяется с грудным молоком. Учитывая возможность выделения с грудным молоком и возможное отрицательное воздействие омализумаба на плод, следует соблюдать осторожность при назначении омализумаба в период грудного вскармливания.
Фертильность. Отсутствуют данные о влиянии омализумаба на фертильность у человека. Исследования на животных продемонстрировали отсутствие нарушения мужской и женской фертильности при повторяющемся применении омализумаба в дозах, превышающих 75 мг/кг.
Опыт клинических исследований
Поскольку клинические исследования проводятся с различным набором условий, частота встречаемости побочных реакций, наблюдаемых в этих исследованиях, не может непосредственно сравниваться с частотой в других клинических испытаниях и прогнозировать возникновение побочных эффектов в клинической практике.
Побочные реакции в клинических исследованиях у пациентов с атопической бронхиальной астмой
Наиболее частыми нежелательными явлениями при применении омализумаба были реакции в месте инъекции (45%), вирусные инфекции (23%), инфекции верхних дыхательных путей (20%), синусит (16%), головная боль (15%) и фарингит (11%). Эти неблагоприятные эффекты наблюдались со сходной частотой при лечении пациентов омализумабом и в контрольной группе пациентов.
Представленные ниже данные получены при лечении омализумабом 2076 взрослых и подростков старше 12 лет, включая 1687 пациентов, получавших лечение в течение 6 мес, и 555 пациентов — в течение 1 года и более, как в плацебо-контролируемых, так и при проведении других контролируемых исследований у пациентов с астмой. Средний возраст пациентов составлял 42 года, 134 пациента были в возрасте 65 лет и старше, 60% обследованных — женщины, 85% — европеоидной расы. Пациенты получали омализумаб в дозах 150–375 мг каждые 2 или 4 нед или стандартную терапию с/без плацебо (пациенты контрольных групп).
Побочные эффекты, которые встречались с частотой ≥1% более часто у взрослых и подростков старше 12 лет, получавших омализумаб (n=738), чем у получавших плацебо (n=717), при проведении плацебо-контролируемых исследований у пациентов с астмой (классифицированы преимущественно с использованием терминов из словаря International Medical Nomenclature — IMN, в скобках — % встречаемости в группе плацебо):
Организм в целом: боль — 7 (5)%, ощущение усталости — 3 (2)%.
Со стороны опорно-двигательного аппарата: артралгия — 8 (6)%, перелом — 2 (1)%, боль в ноге — 4 (2)%, боль в руке — 2 (1)%.
Со стороны нервной системы и органов чувств: головокружение — 3 (2)%, боль в ухе — 2 (1)%.
Со стороны кожных покровов: зуд — 2 (1)%, дерматит — 2 (1)%.
Местные реакции. Реакции в месте инъекции любой степени тяжести отмечались с частотой 45% у пациентов при применении омализумаба по сравнению с 43% у пациентов, принимавших плацебо. Местные реакции включали эритему, ощущение тепла, покалывание, жжение, зуд, боль, уплотнение, воспаление и отечность в месте инъекции.
Тяжелые инъекционные реакции наблюдались более часто на фоне введения омализумаба (12%) по сравнению с введением плацебо (9%). Большинство инъекционных реакций наблюдалось в пределах 1 ч после инъекции, длилось менее чем 8 дней, и обычно частота их снижалась при последующих инъекциях.
В клинических исследованиях у детей 6–12 лет были отмечены следующие нежелательные явления.
Со стороны нервной системы: очень часто (≥1/10) — головная боль.
Со стороны ЖКТ : часто (≥1/100, нед (испытание 2) и 24 нед ( испытания 1 и 3). В испытаниях 1 и 2 пациенты получали омализумаб в дозах 75, 150 или 300 мг или плацебо каждые 4 нед в дополнение к Н1-антигистаминной терапии на протяжении всего периода лечения. В испытании 3 пациенты были рандомизированы на получение омализумаба в дозе 300 мг или плацебо каждые 4 нед в дополнение к Н1-антигистаминной терапии. Представленные ниже данные отражают экспозицию омализумаба у 733 пациентов, участвовавших в трех клинических испытаниях и получивших по меньшей мере одну дозу омализумаба, включая 684 пациента, получавших лечение в течение 12 нед , и 427 пациентов — 24 нед . Средний возраст пациентов, получавших омализумаб в дозе 300 мг, составлял 43 года, 75% — женщины, 89% — пациенты европеоидной расы. Демографические профили пациентов, получавших омализумаб в дозе 75 и 150 мг, были схожи.
Побочные эффекты, которые встречались с частотой ≥2% у пациентов, получавших омализумаб (n=738), и более часто, чем у пациентов, получавших плацебо (с 1-го дня по 12-ю нед , n=717) в испытаниях 1, 2 и 3. Побочные эффекты приведены в соответствии с предпочтительными терминами и классификацией систем органов MedDRA. Результаты представлены следующим образом: рядом с названием побочного эффекта, через / указано количество пациентов, у которых был зафиксирован данный эффект (в скобках указана частота встречаемости этого эффекта в процентах) при применении омализумаба в дозе 150 мг (n=175), 300 мг (n=412) и плацебо (n=242).
Желудочно-кишечные расстройства: тошнота 2 (1,1%)/ 11 (2,7%)/ 6 (2,5%).
Инфекции и инвазии: назофарингит 16 (9,1%)/ 27 (6,6%)/ 17 (7%); синусит 2 (1,1%)/ 20 (4,9%)/ 5 (2,1%); инфекции верхних дыхательных путей 2 (1,1%)/ 14 (3,4%)/ 5 (2,1%); вирусные инфекции верхних дыхательных путей 4 (2,3%)/ 2 (0,5%)/ (0%).
Со стороны скелетно-мышечной системы и соединительной ткани: артралгия 5 (2,9%)/ 12 (2,9%)/ 1 (0,4%).
Со стороны нервной системы: головная боль 21 (12%)/ 25 (6,1%)/ 7 (2,9%).
Со стороны дыхательной системы, органов грудной клетки и средостения: кашель 2 (1,1%)/ 9 (2,2%)/ 3 (1,2%).
Дополнительные реакции, о которых сообщалось в период 24-недельного периода лечения в испытании 1 и испытании 3 (у ≥2% пациентов, получавших омализумаб в дозе 150 или 300 мг, и более часто, чем у пациентов, получавших плацебо), включали следующие: зубная боль, грибковые инфекции, инфекции мочевыводящих путей, миалгия, боль в конечности, скелетно-мышечная боль, периферические отеки, повышение температуры тела, мигрень, синусовая головная боль, тревога, боль в ротоглотке, астма, крапивница, алопеция.
Следующие побочные реакции были выявлены в ходе постмаркетингового использования омализумаба у взрослых и подростков старше 12 лет. Поскольку сообщения об этих реакциях поступают добровольно от популяции неопределенного размера, как правило, не представляется возможным достоверно оценить их частоту или установить причинно-следственную связь с действием ЛС .
Анафилаксия. Основываясь на спонтанных сообщениях и предположительной экспозиции омализумаба примерно у 57300 пациентов, частота анафилаксии на фоне его применения была оценена как не менее 0,2%. О симптоматике со стороны легочной системы было сообщено в 89% случаев, о гипотензии или обмороке — 14%. К госпитализации привели 15% зарегистрированных случаев. О предшествующих анафилактических реакциях, не связанных с применением омализумаба, сообщалось у 24% пациентов.
Из зарегистрированных случаев анафилаксии на фоне омализумаба 39% отмечались после первой дозы, 19% — после второй, 10% — после третьей, остальные — после последующих доз. Один случай зафиксирован после 39 дозы (случай анафилаксии произошел, когда лечение было возобновлено после 3-месячного перерыва, до этого было проведено непрерывное лечение в течение 19 мес). Время начала развития анафилактической реакции в этих случаях составляло до 30 мин — 35%, 30–60 мин — 16%, 60–90 мин — 2%, 90–120 мин — 6%, 2–6 ч — 5%, 6–12 ч — 4%, 12–24 ч — 8%, больше 24 ч и до 4 дней — 5%. В 9% случаев время было неизвестно.
Эозинофилия. В редких случаях у больных бронхиальной астмой на фоне терапии омализумабом может возникать выраженная системная эозинофилия, иногда с клиническими признаками васкулита, соответствующими синдрому Чарга-Стросса — состоянию, при котором часто проводится терапия системными кортикостероидами. Эти случаи как правило, но не всегда, были связаны со снижением пероральной терапии кортикостероидами.
Лихорадка, артралгия и сыпь: сочетание симптомов, включая артрит/артралгию, сыпь (крапивница или другие формы), лихорадку и лимфаденопатию. Симптомы были аналогичны тем, которые наблюдаются у пациентов с сывороточной болезнью, и развивались с 1-го по 5-й день после первой или последующих инъекций омализумаба. У некоторых пациентов эти симптомы повторялись после дополнительных доз. При развитии таких симптомов инъекции омализумаба необходимо прекратить.
Со стороны крови: тяжелая тромбоцитопения.
Со стороны кожи и подкожных тканей: выпадение волос.
Поскольку ферменты цитохрома Р450, механизмы системы энергетического выброса (эффлюксные насосы) и связывания с белками не играют роли в клиренсе омализумаба, омализумаб обладает небольшим потенциалом для лекарственного взаимодействия с другими препаратами. Специальных исследований по взаимодействию омализумаба с лекарственными препаратами, включая вакцины, не проводилось. Взаимодействие омализумаба с лекарственными препаратами, используемыми для лечения бронхиальной астмы, маловероятно.
В клинических исследованиях у больных с атопической бронхиальной астмой омализумаб широко применяли в комбинации с ингаляционными и пероральными ГКС , ингаляционными β-агонистами короткого и длительного действия, антагонистами ЛТ , теофиллином и антигистаминными препаратами. Вышеуказанные ЛС не влияют на безопасность применения омализумаба. В настоящее время данные по применению омализумаба в комбинации со специфической иммунотерапией (гипосенсибилизирующей терапией) ограничены.
В клинических исследованиях у пациентов с хронической идиопатической крапивницей омализумаб применяли в комбинации с антигистаминными средствами (блокаторами Н1— и H2-гистаминовых рецепторов), антагонистами ЛТ-рецепторов. Не выявлено влияние вышеуказанных средств на профиль безопасности омализумаба. В результате популяционного фармакокинетического анализа также не выявлено влияние блокаторов H2-гистаминовых рецепторов и антагонистов ЛТ-рецепторов на фармакокинетику омализумаба. Применение омализумаба в комбинации с иммунодепрессивными средствами не изучалось.
Омализумаб не следует смешивать с какими-либо другими ЛС или растворителями кроме воды для инъекций.
О случаях передозировки омализумаба до настоящего времени не сообщалось. Максимальная переносимая доза омализумаба до настоящего времени не определена. При однократном в/в введении доз до 4000 мг дозолимитирующей токсичности не отмечалось. При введении пациентам в течение 20 нед наивысшей кумулятивной дозы препарата (44000 мг) не наблюдалось развитие каких-либо тяжелых острых нежелательных явлений.
Оценку эффективности терапии омализумабом следует проводить по крайней мере через 12 нед лечения.
Омализумаб предназначен для длительной терапии. Отмена препарата, как правило, приводит к возврату повышенного уровня свободного IgE и развитию соответствующих симптомов.
Общий уровень IgE возрастает в ходе лечения и остается повышенным в течение 1 года после прекращения терапии. Таким образом, уровень IgE при повторном определении на фоне терапии омализумабом не может служить ориентиром для подбора дозы. Чтобы установить дозу препарата после прерывания лечения на период менее 1 года, следует ориентироваться на концентрацию IgE в сыворотке крови, установленную до введения начальной дозы препарата. Если лечение омализумабом прерывалось на 1 год или более, то для установления дозы препарата следует определить общую концентрацию IgE в сыворотке крови повторно. Дозы омализумаба следует корректировать при значительных изменениях массы тела.
Анафилаксия. При применении омализумаба могут возникать местные или системные аллергические реакции, включая анафилактические.
О развитии анафилаксии после введения омализумаба сообщалось как в премаркетинговых клинических испытаниях, так и в постмаркетинговых отчетах. Признаки и симптомы, отмеченные в этих случаях, включали бронхоспазм, гипотензию, обморок, крапивницу и/или отек горла или языка. Некоторые из этих случаев носили жизнеугрожающий характер. Анафилаксия была отмечена у 3 из 3507 (0,1%) пациентов с астмой, участвовавших в премаркетинговых клинических испытаниях (при использовании первой дозы — у двух пациентов, четвертой — у одного пациента). Время начала анафилактической реакции — 90 мин (в двух случаях) и 2 ч (один случай) после введения.
Ретроспективное исследование случай-контроль показало, что среди применявших омализумаб пациентов те из них, у кого в анамнезе была зафиксирована анафилаксия на пищевые продукты, лекарства или в связи с другими причинами, имели повышенный риск анафилаксии, связанной с применением омализумаба.
В постмаркетинговых исследованиях частота анафилаксии, связанной с применением омализумаба, была оценена как по меньшей мере 0,2%. Случаи анафилаксии наблюдались как после первой дозы омализумаба, так и спустя год регулярного применения. Перед введением омализумаба необходимо заранее приготовить соответствующее реанимационное оборудование и ЛС , необходимые для купирования реакций гиперчувствительности. Следует проинформировать пациентов о возможности развития анафилактических реакций и обеспечить соответствующее медицинское наблюдение за больными. В случае развития у пациента выраженной реакции гиперчувствительности применение омализумаба необходимо прекратить.
Иммуногенность. Так же, как при применении всех гуманизированных моноклональных антител — производных рекомбинантной ДНК — в редких случаях возможно образование антител к омализумабу. Низкий титр антител к омализумабу при проведении клинических исследований определялся у 1/1723 ( in vitro реактивностью на круглогодичный аэроаллерген 5007 пациентов получали лечение омализумабом, и 2829 пациентов не применяли его, пациенты находились под наблюдением в течение 5 лет. В этом исследовании частота возникновения первичных злокачественных новообразований (на 1000 пациенто-лет) была сходной у пациентов, применявших омализумаб (12,3) и пациентов, не применявших его (13).
У детей 6–12 лет случаев развития злокачественных новообразований в группе пациентов, получавших омализумаб, зарегистрировано не было.
Тромбоэмболические осложнения (ТЭО). В контролируемых клинических исследованиях у пациентов, получавших лечение омализумабом, отмечалось развитие ТЭО, включая инсульт, транзиторные ишемические атаки, инфаркт миокарда, нестабильную стенокардию, смерть от сердечно-сосудистых причин ( в т.ч. летальный исход по неустановленным причинам). При анализе основных факторов сердечно-сосудистого риска соотношение рисков составило 1,32.
Гельминтные инфекции. В одногодичном клиническом испытании, проведенном в Бразилии, у 53% (36/68) пациентов с высоким риском гельминтных инфекций, получавших омализумаб, были диагностированы гельминтозы, в группе плацебо — 42% (29/69). При терапии омализумабом рекомендуется мониторинг пациентов с высоким риском развития гельминтных инфекций.
Омализумаб не следует применять для лечения острых приступов бронхиальной астмы, острого бронхоспазма или астматического статуса.
Не изучалось применение омализумаба у пациентов с синдромом повышенного содержания IgЕ, с аллергическим бронхолегочным аспергиллезом, для профилактики анафилактических реакций, при атопическом дерматите, аллергическом рините или пищевой аллергии.
Опыт применения омализумаба у пациентов старше 65 лет ограничен. Однако данных, свидетельствующих о необходимости коррекции дозы препарата у пациентов этого возраста, нет.
Влияние на способность управлять автотранспортом и работать с механизмами. Пациентам, у которых на фоне применения омализумаба возникает головокружение или другие нарушения со стороны ЦНС , следует воздержаться от управления автотранспортом или работы с механизмами в период применения препарата.
источник
Показания к применению, инструкция по приему Омализумаба при бронхиальной астме, хронической крапивнице
Благодаря долгим исследованиям в области медицины был разработан новый лекарственный препарат против астмы – Омализумаб. На основе проведенных экспериментов было доказано, что лекарство отлично справляется с такими проявлениями аллергической реакции, как астма или зуд. Более подробно о препарате далее в статье.
Благодаря данному средству множество больных астмой или крапивницей сможет почувствовать себя лучше на протяжении долгого времени.
Особенно если соблюдать дозировку и частоту применение препарата.
Омализумаб относится к препаратам, оказывающим иммунодепрессивное фармакологическое действие. При употреблении препарата Омализумаб механизм действия заключается в следующем и зависит от типа заболевания:
При астме Омализумаб связывает обычные действующие рецепторы с другими. Они называются высокаффинные. Располагаются на поверхностях тучных клеток. Таким образом, снижение введение препарата в организм уменьшает количество высокоаффинных рецепторов и приводит к ограничению поступления медиаторов, вызывающих аллергическую реакцию.
При крапивнице препарат связывает обычные рецепторы IgE, тем самым уменьшая количество свободных. Это приводит к снижениям симптомов крапивницы и улучшению состояния пациента. Более подробного описания действия этого препарата при крапивнице на данный момент еще не выявлено, но специалисты продолжают искать ответ на этот вопрос.
- Омализумаб – 150 мг;
- Дополнительные вещества;
- Вода.
Препарат выглядит обычно в виде порошка. Для применения из него необходимо сделать раствор, который впоследствии станет инъекцией. Для одной инъекции будет достаточно 150 мг порошка. Продается он в комплекте с растворителем. Количество растворителя 2 мл.
В аптеке можно встретить Омализумаб, торговое название «Omalizumab» или «Xolar».
Использование препарата зависит от того, какие симптомы с его помощью необходимо остановить или прекратить вовсе. Главная его цель – облегчить состояние пациента и продлить эффект на долгое время. Существует два основных вида заболеваний, которые может вылечить Омализумаб и два способа его применения и дозировки.
Данное средство позволяет справиться с симптомами аллергической бронхиальной астмы у взрослых, подростков и детей в возрасте от 6 до 12 лет.
В случае бронхиальной астмы препарат нужно использовать только как вспомогательную терапию.
Препарат в случае крапивницы применим, как вспомогательное средство для улучшения состояния пациента и лечения заболевания. Должен применяться только взрослым или подростками.
Нормируемая доза лекарства – 300 мг раз в четыре недели.
Процедура осуществляется подкожно: ставится инъекция. После каждого систематического применения лекарства больному в любом случае стоит посетить врача, чтобы он мог дать оценку действию препарата. Если результат будет положительным, то можно продолжить лечение Омализумабом. Если же будут выявлены какие-то отрицательные реакции организма, то врач сможет вовремя это обнаружить и заменить препарат.
Что касается дозирования препарата при бронхиальной астме, то зависит она от концентрации рецепторов в организме пациента, а также от его массы. Таким образом объем инъекции может варьироваться в пределах от 75 до 600 мг. И частота применения препарата возможна один раз в течение двух или четырех недель.
При применении Омализумаба стоит учесть, что на фоне терапии может возникнуть эозинофилия с некоторыми признаками васкулита. Такие случаи редки, но к употреблению препарата стоит отнестись ответственно.

До сих пор непонятно, выделяется ли препарат вместе с грудным молоком кормящей женщины. Поэтому риск причинения вреда малышу во время вскармливания на всякий случай стоит учитывать. И либо остановить процесс лактации, либо прекратить на некоторое время употреблять Омализумаб.
Особых противопоказаний выявлено не было. Единственное, что стоит учесть: препарат не рекомендуется принимать гиперчувствительным пациентам. Лучше найти другое средство.
Согласно клиническим исследованиям, которые проводились не один год, были выявлены следующие побочные действия препарата:
- Неприятные реакции на месте, где была введена инъекция;
- Вирусные заболевания;
- Головная боль;
- Проблемы с дыхательными путями;
- Синусит;
- Фарингит.
Помимо этого, у наблюдавшихся пациентов была отмечена повышенная усталость, сонливость, а также появлялись различные боли в организме.
У детей наблюдалось повышение температуры тела, головная боль и боль в верхней части живота.

Также были взяты данные после того, как международный препарат поступил в продажу. И побочное действие было выражено в виде:
Аналогичное антитело Омализумаба – это Ксолар. Под таким названием средство можно встретить в аптеке.
Врачи рекомендуют принимать непосредственно Омализумаб, аналоги имеются лишь косвенные, которые будут называться:
- Кромглициевая кислота;
- Кетотифек;
- Оксатомид.
Этот список заменителей похож на описываемое средство действием, но отличаются составом. Кроме того, может попасться и непатентованный препарат.
Специалистами не проводилось специальных исследований, чтобы выявить возможность взаимодействия препарата с другими лекарствами. Все потому, что оно в принципе маловероятно, и нет смысла проверять то, что практически не может случиться.

То же касается и крапивницы. Применение препарата один раз проверили в совместном действии с антигистаминными средствами. И тоже результат остался нейтральным. То есть никаких негативных эффектов от применения выявлено не было.
Применение какого-либо гуманизированного препарата с алкоголем категорически запрещено. То же самое относится и к Омализумабу. Единственная жидкость, в которой можно растворять этот порошок – вода.
Много людей принимали и при возникновении бронхиальной астмы Омализумаб, отзывы при крапивнице весьма разнообразны.
Светлана: «Уже несколько лет ребенок получает Ксолар. И на протяжении всего этого времени он чувствует себя отлично, результат исключительно положительный. Особенно если сравнивать с препаратами, которые мы принимали до Ксолара».
Елена: «Боялись соглашаться на Ксолар, потому что не понятно, как на него может отреагировать ребенок. Тем более в интернете прочитала об огромном количестве возможных побочных эффектов. Однако после того, как получила полный обзор препарата от врача, все-таки решили рискнуть и до сих пор довольны результатом. Ребенку гораздо легче, что не может не радовать».
Омализумаб способен помочь при проблемах, связанных с аллергической бронхиальной астмой и крапивницей. Медикамент заметно облегчает аллергическую реакцию и позволяет уменьшить, а то и совсем прекратить появление приступов.
источник
Настоящая статья посвящена современному пониманию тяжелой бронхиальной астмы, подходам к ее верификации, выявленным фенотипам и эндотипам тяжелой астмы. Рассматриваются существующие возможности терапии этой формы заболевания, а также наиболее изученные варианты будущего лечения тяжелой астмы.
Бронхиальная астма (БА) – гетерогенное по природе и вариабельное по течению заболевание, имеющее высокую распространенность среди всех возрастных групп во всем мире. Большинство пациентов, страдающих БА, хорошо отвечают на традиционную терапию и при условии соблюдения оптимальной приверженности и правильной техники ингаляции достигают и поддерживают контроль заболевания. Однако существует не очень большая (5−10%) часть больных [1], которые имеют т. н. трудную БА. Эти пациенты, как правило, рефрактерны к традиционной терапии, у них отмечается высокая частота обострений, незапланированных визитов к врачу и обращений за неотложной медицинской помощью, госпитализаций. Именно трудная, тяжелая БА поглощает 50% всех экономических затрат, предназначенных на заболевание в целом.
Термины «трудная для лечения» и «тяжелая БА» часто используются как синонимы, однако не все пациенты с астмой, трудно поддающейся лечению, имеют тяжелую БА. В случае неконтролируемых симптомов, частых обострений БА, персистирующей фиксированной обструкции, несмотря на максимальную стандартную терапию, необходимо ответить на следующие вопросы:
• Действительно ли пациент имеет БА?
• Устранены ли (или минимизированы) все возможные триггеры?
• Учтены ли все коморбидные состояния?
• Привержен ли пациент назначенному лечению и правильная ли у него техника ингаляции?
И только при утвердительном ответе на все вышеозначенные вопросы можно думать о тяжелой БА у пациента, ибо систематизированная оценка больных с «трудной» БА зачастую выявляет альтернативные диагнозы, коморбидные состояния, плохую приверженность лечению и неадекватную терапию.
Современное определение тяжелой бронхиальной астмы
Ранние рекомендации Европейского респираторного общества (ERS) [2] и Американского торакального общества (ATS) [3] предлагали применять термин «тяжелая БА» для тех пациентов, которые имеют рефрактерную, неконтролируемую БА, несмотря на всесторонний пересмотр диагноза и лечения, и длительный период наблюдения (по крайней мере, 6 мес.) врачом-специалистом по БА. В 1999 г. ERS определило тяжелую БА как БА, которая остается неконтролируемой, несмотря на высокие дозы ингаляционных кортикостероидов (ИГКС) с или без системных ГКС (неконтролируемая = персистирующие симптомы или повторяющиеся обострения) [2]. В 2000 г. ATS, используя то же определение тяжелой БА, представило главные и второстепенные признаки рефрактерной БА (табл. 1) [3].
За последние 10 лет было проведено несколько крупных клинических исследований по изучению тяжелой БА, в частности европейское исследование ENFUMOSA [4] и американское исследование TENOR [5]. Результаты этих исследований позволили лучше охарактеризовать этих пациентов и послужили основой для унифицированного определения тяжелой БА, предложенного группой мировых экспертов по инициативе ВОЗ в 2009 г. [1]. Это определение тяжелой БА основывается не только на определении уровня клинического контроля и получаемой терапии, но также на определении ответа на терапию и оценке будущего риска. Соответственно данному подходу выделяется три типа тяжелой БА:
o Нелеченая тяжелая БА.
o БА, трудно поддающаяся лечению вследствие плохой приверженности лечению или неадекватной терапии (или коморбидностей).
o Резистентная тяжелая БА.
• БА, контроль которой может поддерживаться только на максимально высоком уровне терапии.
• БА, контроль которой не достигается, несмотря на максимально высокий уровень терапии: рефрактерная БА и ГКС-резистентная БА.
На рисунке 1 представлен алгоритм определения тяжелой и трудно поддающейся терапии БА, предложенный в этом же документе [1].
Таким образом, истинно тяжелая БА – это та астма, контроль которой может быть достигнут только на максимально высоком уровне терапии, т. е. лечении, соответствующем 4-й или даже 5-й ступени терапии БА по GINA (Глобальная инициатива по лечению и профилактике БА), или не достигается, несмотря на максимально возможный уровень терапии (табл. 2) [6]. При этом важным условием верификации тяжелой БА является исключение низкой приверженности назначенной терапии и неправильной техники ингаляции.
Фенотипы и эндотипы тяжелой бронхиальной астмы
Тяжелая БА, как, впрочем, и вся БА, неоднородна. Среди пациентов с тяжелой БА можно выделить больных с частыми, остро развивающимися обострениями; больных с фиксированной персистирующей обструкцией бронхов (ОФВ1 3%, при нейтрофильном – нейтрофилов > 61%, при малогранулоцитарном – эозинофилы и нейтрофилы обнаруживаются в нормальном процентном содержании [7].
Идентификация фенотипов БА с помощью кластерного анализа, проведенная в нескольких исследованиях за последнее время, также позволяет выделить несколько фенотипов тяжелой БА [8–10]. Например, ранняя атопическая БА, характеризующаяся тяжелым течением изначально, или поздняя БА с выраженным эозинофильным воспалением и высоким риском развития тяжелых обострений, или поздняя БА, ассоциированная с ожирением (табл. 3).
Вместе с тем все эти фенотипы, выделенные на основании кластерного анализа или клинических/биологических характеристик, не отражают патобиологического механизма, приводящего к их формированию, тогда как знание этого механизма позволит создавать и проводить патогенетическую целевую терапию БА. Выявление патобиологических механизмов, лежащих в основе формирования фенотипов БА, или т. н. эндотипов БА, является самой насущной задачей в оптимизации терапии тяжелой БА [11]. Согласно определению Anderson G.P., эндотип заболевания – это субтип болезни, определяемый уникальным или отличительным функциональным или патофизиологическим механизмом [12]. Один эндотип БА может включать несколько фенотипов и специфический фенотип может присутствовать в нескольких эндотипах. В недавней публикации Wenzel S. была представлена интегральная характеристика эндотипов тяжелой БА (табл. 4) [11].
Характеристика эндотипов БА была дана в консенсусе PRACTALL (PRACtical ALLergy), созданном европейскими и американскими экспертами [13]. Было предложено 6 эндотипов БА, 4 из которых имеют отношение к тяжелой БА и совпадают с предложенными S. Wenzel: тяжелая аллергическая БА; поздняя БА с персистирующей эозинофилией; респираторные заболевания, обострения которых связаны с аспирином (аспириновая триада); аллергические бронхолегочные микозы. И хотя в большинстве случаев истинный патобиологический механизм этих эндотипов малопонятен, а некоторые характеристики, предложенные для описания патобиологического механизма, совпадают с характеристиками, присущими фенотипу БА, тем не менее этот подход может в последующем способствовать определению молекулярных основ энлотипов тяжелой БА и совершенствованию патогенетической терапии.
Современная терапия тяжелой бронхиальной астмы
Довольно большое количество молекул и лекарственных препаратов изучаются в настоящее время в качестве противоастматических средств для терапии тяжелой БА, однако не так много лекарственных препаратов доступно для реальной клинической практики. Согласно международным рекомендациям, терапия, одобренная на 4-й и 5-й ступенях (табл. 2), включает применение средних или высоких доз ИГКС в комбинации с длительно действующими β2-агонистами (ДДБА) и/или антилейкотриеновыми препаратами и теофиллином замедленного высвобождения, системные ГКС и единственный биологический препарат, одобренный в настоящее время для клинического применения, гуманизированные антитела против IgE (омализумаб).
Ингаляционные глюкокортикостероиды (ИГКС)
ИГКС составляют основу базисной терапии персистирующей БА, обеспечивающей длительный контроль заболеваний. При тяжелой БА рекомендуются высокие, а иногда ультравысокие (>2 000 мкг флутиказона пропионата или эквивалентные дозы других ИГКС) дозы ИГКС. Однако проведенные исследования не продемонстрировали преимуществ таких высоких дозировок в отношение эффективности терапии [14], зато существуют обширные доказательства роста нежелательных побочных эффектов, как локальных, так и системных, с увеличением дозы ИГКС [15, 16]. Поэтому более приемлимой является стратегия добавления к ИГКС препаратов другого класса (ДДБА, антилейкотриеновых препаратов или теофиллина замедленного высвобождения), что зачастую позволяет достичь контроль даже тяжелой БА, не применяя сверхвысокие дозы ИГКС.
Практически все существующие молекулы ИГКС доступны и применяются в нашей стране: беклометазона дипропионат, будесонид, флутиказона пропионат, циклесонид и мометазона фуроат. Два последних (циклесонид и мометазона фуроат) являются наиболее современными ИГКС, обладающими высокой эффективностью при благоприятном профиле безопасности при персистирующей, в т. ч. тяжелой, БА [17–19]. Особенность молекулы циклесонида заключается в том, что она неактивна, т. е. является пролекарством и активируется в фармакологически активный метаболит – дезциклесонид эстеразами легких, что позволяет избежать как локальных, так и системных побочных эффектов [20], тем самым делая возможным применение высоких доз у больных тяжелой БА. Мометазона фуроат обладает самой высокой аффинностью к глюкокортикоидному рецептору при сравнении с другими ИГКС, что обуславливает выраженный противовоспалительный эффект препарата при низкой свободной концентрации в плазме крови за счет 98%-ного связывания с альбумином [21]. Фармакологические и фармакокинетические свойства мометазона фуроата предполагают возможность и эффективность применения высоких доз у больных тяжелой БА.
Длительно действующие β2-агонисты (ДДБА)
Два ДДБА одобрены для лечения БА: салметерол и формотерол. Длительность их бронхолитического эффекта составляет 12 ч в отличие от ультра ДДБА – индакатерола, продолжительность эффекта которого составляет 24 ч, но его применение одобрено только при ХОБЛ. Важно то, что монотерапия ДДБА категорически не применяется при БА из-за риска развития тяжелых жизнеугрожающих обострений БА вследствие активации персистирующего неконтролируемого воспаления [22]. Поэтому ДДБА применяют только в комбинации с ИГКС.
Комбинированные препараты ИГКС + ДДБА
Эффективность комбинированной терапии ИГКС и ДДБА среднетяжелой и тяжелой БА доказана многочисленными обширными рандомизированными клиническими исследованиями. Применение комбинации ИГКС и ДДБА снижает риск тяжелых обострений БА и способствует лучшему контролю заболевания [23–26]. Комбинация ИГКС и ДДБА положительно влияет на соотношение «эффективность – безопасность», ибо практически в два раза увеличивает клиническое действие ГКС без увеличения частоты нежелательных побочных эффектов, что особенно убедительно показано для подростков и взрослых, страдающих персистирующей БА [27].
В нашей стране доступно абсолютное большинство существующих фиксированных комбинаций ИГКС и ДДБА: флутиказона пропионат/салметерол (ФП/САЛ), будесонид/формотерол (БУД/ФОР), беклометазона дипропионат/формотерол (БДП/ФОР) и новый препарат мометазона фуроат/формотерол (МФ/ФОР). Кроме фиксированных комбинаций, доступна свободная комбинация будесонида и формотерола. Подавляющее большинство пациентов с тяжелой БА подучают базисную постоянную терапию этими комбинированными препаратами, к которым при необходимости добавляют антагонисты лейкотриеновых рецепторов, системные ГКС или омализумаб.
Наиболее изученными и широко применяемыми препаратами из этой группы являются антагонисты лейкотриеновых рецепторов (монтелукаст, зафирлукаст и пранлукаст). Монтелукаст давно и успешно применяется в нашей стране для лечения БА и аллергического ринита у детей и взрослых. Вместе с тем клинических исследований по изучению эффективности этих препаратов при тяжелой БА очень немного. В одном небольшом рандомизированном исследовании не было отмечено значимого позитивного эффекта антагониста ЛТ-рецепторов у больных тяжелой БА, получавших ИГКС и ДДБА [28]. Возможно, необходимы более высокие дозы антилейкотриеновых препаратов [29], либо, что более вероятно, требуется строгая стратификация больных и определение пациентов с БА, в патогенезе которой цис-ЛН доминируют. У больных аспириновой тяжелой БА и поздней БА, ассоциированной с ожирением, скорее всего, возможно ожидать эффект аддитивной терапии антагонистами лейкотриеновых рецепторов. К сожалению, отсутствуют рандомизированные исследования по эффективности антилейкотриеновых препаратов при данных фенотипах БА, в т. ч. тяжелой.
Моноклональные антитела против IgE (омализумаб), по сути, являются единственным видом терапии, одобренным именно для лечения тяжелой аллергической БА. Омализумаб, связываясь с Fc-фрагментом IgE, препятствует таким образом активации высокоаффинных рецепторов к IgE (FcεRI) на тучных клетках, базофилах и дендритных клетках, а также низкоаффинных рецепторов к IgE (FcεRII), экспрессированных на иммунных и воспалительных клетках, таких как макрофаги, Т- и В-лимфоциты, эозинофилы. Таким образом, связывая молекулы свободно циркулирующего IgE, омализумаб снижает экспрессию специфических, прежде всего высокоаффинных, рецепторов к IgE на воспалительных клетках, тем самым предотвращая их активацию и развитие ранней и поздней фаз аллергической реакции.
Эффективность омализумаба при тяжелой аллергической БА продемонстрирована в целом ряде обширных рандомизированных клинических исследований [30−35]. Во всех исследованиях показано снижение (на 19–58%) частоты тяжелых обострений БА, улучшение качества жизни пациентов, снижение гормональной нагрузки за счет уменьшения дозы кортикостероидных препаратов, уменьшение симптомов и потребности в скоропомощных препаратах. Омализумаб, как правило, хорошо переносится, и частота побочных эффектов на омализумаб не отличается от плацебо. Однако в нескольких исследованиях зарегестрирована анафилактическая реакция, развившаяся в ответ на инъекцию омализумаба [33, 36], что обуславливает необходимость проведения терапии подготовленным персоналом в условиях медицинского учреждения.
Терапия омализумабом в настоящее время показана взрослым больным и детям с 6 лет, страдающим тяжелой IgE-обусловленной аллергической БА, неконтролируемой высокими дозами ИГКС в сочетании с ДДБА, и имеющим уровень общего IgE в сыворотке от 30 до 1 500 МЕ/мл до начала терапии.
Перспективы терапии тяжелой бронхиальной астмы
Создание т. н. диссоциированных ГКС, в которых сохраняется противовоспалительная активность и отсутствуют побочные эффекты, позволит применять эти препараты в высоких дозах и даже per os без риска развития осложнений. Теоретическим обоснованием создания таких стероидов является то, что побочные эффекты ГКС опосредуются трансактивацией и связыванием ГК-рецепторов с ДНК (геномный эффект), тогда как противовоспалительный эффект преимущественно обусловлен трансрепрессией транскрипционных факторов, т. е. внегеномным эффектом [37]. Поэтому создание селективного агониста ГК-рецептора (ZK 216348), индуцирующего преимущественно трансрепрессию с отсутствием или минимальным влиянием на трансактивацию, может позволить безопасное применение высоких доз препарата [38]. В стадии клинических разработок находятся нестероидные селективные активаторы ГК-рецепторов [39].
ДДБА и комбинация ИГКС/ДДБА
Несколько новых ультраДДБА, включая уже применяющийся при ХОБЛ индакатерол, исследуются в отношение эффективности при БА: кармотерол (carmoterol), вилантерол (vilanterol), олодатерол (olodaterol), прежде всего в составе комбинированных с ИГКС препаратах. Такие фиксированные комбинации, как флутиказона фуроат/вилантерол и мометазона фуроат/индакатерол для однократного применения в день, активно изучаются в клинических исследованиях для терапии персистирующей БА различной степени тяжести [40].
Антихолинергические препараты длительного действия (тиотропия бромид)
Антихолинергические (антимускариновые) препараты короткого действия (ипратропия бромид и окситропия бромид) применяются в качестве бронхолитических средств у больных БА, как правило, в случаях непереносимости β2-агонистов либо в комбинации с короткодействующими β2-агонистами. Последняя комбинация особенно эффективна при обострении БА.
Тиотропия бромид является антихолинергическим препаратом длительного (24 ч) действия и одним из основных бронхолитических препаратов в терапии ХОБЛ. На сегодняшний день тиотропий не одобрен для лечения БА. Однако за последние несколько лет было проведено несколько рандомизированных клинических исследований по изучению эффективности тиотропия бромида при БА (табл. 5). Обоснованием для их проведения являлись результаты in vitro-исследований и испытаний на животных, продемонстрировавшие бронхолитический и противовоспалительный эффект тиотропия, причем последний как в отношении эозинофильного, так и нейтрофильного воспаления [41].
Как видно из таблицы 5, добавление тиотропия бромида (ТИО) к ИГКС и ДДБА у больных тяжелой неконтролируемой БА приводит к улучшению функции легких и снижению риска обострений при благоприятном профиле безопасности. У пациентов с Arg16/Arg16-генотипом β2-адренорецептора (ген ADRB2), которые имеют сниженный ответ на β2-агонисты, применение тиотропия один раз в день оказалось не менее эффективным, чем применение салметерола (САЛ) 2 раза в день.
Таким образом, результаты проведенных клинических исследований свидетельствуют, что добавление тиотропия бромида к терапии ИГКС и ДДБА у больных тяжелой неконтролируемой БА может быть эффективной стратегией, особенно у пожилых пациентов; пациентов, страдающих одновременно БА и ХОБЛ; у больных с персистирующей фиксированной обструкцией, а также у курящих больных.
Несколько основных цитокинов Тh2-профиля активно изучаются в качестве цели терапии при резистентной тяжелой БА: ИЛ-4, ИЛ-5, ИЛ-13.
ИЛ-5 – ключевой цитокин, определяющий эозинофильное воспаление при БА, уровень которого коррелирует с активностью воспаления и тяжестью БА [42]. Эффективность гуманизированных моноклональных антител к ИЛ-5 (меполизумаб) была изучена в нескольких плацебо-контролируемых рандомизированных клинических исследованиях [43–47], оценивавших влияние меполизумаба на эозинофилию крови и легких, частоту обострений БА, функцию легких, контроль БА и качество жизни больных. Во всех исследованиях отмечено значимое уменьшение эозинофилии крови и числа эозинофилов в мокроте, однако клинические эффекты оказались не столь выражены и однозначны.
Анализ результатов исследований показывает, что не все пациенты с резистентной БА одинаково отвечают на меполизумаб. По-видимому, пациенты с определенным фенотипом/эндотипом «БА – поздняя БА с персистирующей эозинофилией» (табл. 4) будут иметь оптимальный ответ на антиИЛ-5-терапию. В исследованиях Nair P. et al. [45] и Haldar P. et al. [46] показано, что меполизумаб уменьшает частоту обострений БА среди строго выбранных пациентов с персистирующей эозинофилией, несмотря на высокие дозы ИГКС, хотя заметного улучшения в симптомах, легочной функции и бронхиальной гиперреактивности (БГР) не отмечалось. В обширном исследовании DREAM [47], в которое были включены только пациенты с тяжелой эозинофильной БА, все изучаемые дозы меполизумаба (75, 250 и 750 мг) привели к значимому снижению частоты обострений БА, а мультивариантный анализ выявил только два признака, связанных с эффективностью препарата: эозинофилия крови и частота обострений БА в предыдущий год. Другой препарат моноклональных антител против ИЛ-5 (reslizumab) проявляет аналогичные эффекты [48].
ИЛ-13 и ИЛ-4 – Тh2-цитокины, включающие В-лимфоциты в продукцию IgE. ИЛ-13 способствует выживаемости и миграции эозинофилов, а также влияет на гладкие мышцы бронхов, повышая их сократимость в ответ на ацетилхолин и снижая бронходилатационный ответ β2-агонистов [49]. Продукция ИЛ-13 повышена у больных БА, а у пациентов с тяжелой резистентной БА повышенный уровень ИЛ-13 в мокроте и биопсийном материале бронхов определяют, несмотря на ГКС-терапию [50]. ИЛ-13 влияет на различные клетки, в т. ч. эпителиальные, стимулируя их к секреции матриклеточных протеинов, одним из которых является периостин. Периостин стимулирует эпителиальные клетки и фибробласты, снижает эластичность бронхиального эпителия и, по-видимому, является важным фактором в развитии ремоделирования дыхательных путей [51]. Гуманизированные моноклональные антитела против ИЛ-13 (лебрикизумаб) изучаются в настоящее время в терапии БА, но опубликованы результаты пока только двух исследований [52, 53]. В исследовании II фазы, включавшем 219 взрослых больных БА неконтролируемой ИГКС и ДДБА, был получен эффект препарата в отношении влияния на функцию легких (ОФВ1) (рис. 2) [52]. Причем пациенты, имеющие высокий уровень периостина в плазме крови до начала терапии, проявляли значимо больший эффект в ответ на лебрикизумаб (рис. 2), что позволяет предположить значение периостина в качестве биомаркера для определения популяции больных, у которых эффективность лечения антителами против ИЛ-13 будет наиболее эффективной. В настоящее время продолжаются клинические исследования III фазы по изучению эффективности лебрикизумаба у больных БА.
Несколько молекул, влияющих на ИЛ-4, изучаются в настоящее время в качестве возможной терапии БА. Питракинра (рitrakinra) представляет собой мутантную форму IL-4, который блокирует IL-4 рецептор α, общий рецептор для IL-4 и IL-13, а также значительно снижает поздний ответ на ингаляционные аллергены у пациентов со среднетяжелой БА при введении подкожно или ингаляционно [54]. Недавно опубликованные результаты клинического исследования эффективности дупилумаба (Dupilumab) – моноклональных антител к α-субъединице IL-4-рецептора у больных среднетяжелой и тяжелой эозинофильной БА – продемонстрировали обнадеживающие результаты [55]. Частота обострений БА, улучшение функции легких и редукция Th2-воспаления были значимо более выражены у пациентов, получавших дупилумаб, по сравнению с больными, принимающими плацебо.
Как известно, не все пациенты с тяжелой БА имеют эозинофильное воспаление в основе клинических симптомов, а у некоторых отмечается хроническое воспаление, обусловленное атипичными бактериями Mycoplasma pneumoniae и Chlamydia pneumonia [56]. Макролидные антибиотики, к которым чувствительны атипичные бактерии, кроме того обладают противовоспалительными и иммуномодулирующими свойствами [57, 58], что давно привлекает к ним внимание со стороны исследователей, в т. ч. в качестве терапии резистентной БА. Было проведено довольно много клинических исследований эффективности макролидов при БА. В только что опубликованный метаанализ эффективности макролидных антибиотиков, применявшихся на протяжении 3 и более недель при БА, было включено 12 исследований, в т. ч. при тяжелой БА [59]. Показано значимое улучшение пиковой скорости выдоха, симптомов, качества жизни и БГР в результате терапии макролидами по сравнению с плацебо, но значимого влияния на ОФВ1 отмечено не было. В исследовании эффективности азитромицина у больных тяжелой БА с частыми обострениями было выявленно снижение частоты обострений у пациентов с неэозинофильным фенотипом БА [60].
Резистентность к ГКС и эффективность теофиллина
Резистентность к ГКС может приводить к формированию тяжелой БА. Несколько молекулярных механизмов лежат в основе этой резистентности: повышенная экспрессия неактивной изоформы ГК-рецептора (ГКР-β), повышенная продукция фактора ингибирующего миграцию макрофагов (MIF), высокая активность р38 митоген-активированной протеинкиназы (р38 МАРК) и сниженная экспрессия деацетилазы гистонов (HDAC2) [41]. Последний механизм, по-видимому, является наиболее важным, ибо молекулярной основой торможения кортикостероидами экспрессии воспалительных генов является активация фермента деацетилазы, которая отвечает за уплотнение структуры хроматина, тем самым ограничивая доступ к ДНК факторов транскрипции. Сигаретный дым и оксидативный стресс снижают активность деацетилазы гистонов, что было показано в биопсийном материале бронхов и альвеолярных макрофагах больных ХОБЛ и курящих пациентов с БА. Это снижение делает ДНК доступной для факторов транскрипции, коррелирует с усилением индукции провоспалительных цитокинов и снижением ответа на ГКС in vitro [61].
Препараты, способные преодолеть ГКС-резистентность у больных тяжелой БА, могут оказаться эффективной стратегией терапии этих пациентов. Ингибиторы р38 МАРК находятся в стадии клинической разработки.
Как показали исследования, теофиллин вызывает 6-кратное увеличение активности деацетилазы гистонов альвеолярных макрофагов, полученных от больных ХОБЛ, и значительно усиливает супрессивную активность дексаметазона в отношении ИЛ-8 [62] . У больных тяжелой БА добавление низких доз орального теофиллина к средним дозам ИГКС оказалось эффективнее увеличения ИГКС до максимально возможных доз [63], а отмена теофиллина приводит к потере контроля заболевания у пациентов с тяжелой БА [64]. У курящих больных БА отмечается сниженный ответ на ГКС и низкие дозы теофиллина оказываются эффективными, когда добавляются к ИГКС [65]. Механизм действия теофиллина на HDAC2 не связан с ингибицией фосфодиэстеразы, а обусловлен подавлением активированной в результате оксидативного стресса фосфоинозитид-3-киназы (PI3Kδ) [66].
Резистентная тяжелая БА занимает от 5 до 10% в общей структуре заболевания, но ее медико-социальное значение существенно, а экономическое бремя составляет половину всех затрат на заболевание в целом. К резистентной тяжелой БА следует относить астму, контроль которой может поддерживаться только на максимально высоком уровне терапии либо контроль которой не достигается, несмотря на максимально высокий уровень терапии. Тяжелая БА гетерогенна, выделяют несколько клинических и биологических фенотипов, однако для создания патогенетической терапии необходимо выявление эндотипов тяжелой БА. Существующая терапия тяжелой БА включает применение высоких доз ИГКС в сочетании с ДДБА и/или антагонистами лейкотриеновых рецепторов и теофиллином замедленного высвобождения. При отсутствии контроля добавляют пероральные ГКС в минимально возможных дозах. Применение антиIgE-терапии (омализумаб) является в настоящее время единственной фенотип-специфической терапией, одобренной для тяжелой IgE-обусловленной аллергической БА. Будущая терапия тяжелой БА требует строгой стратификации пациентов на основании биологических (эозинофилы крови и мокроты, периостин, IgE и, возможно, др.), генетических (выявление полиморфизма генов β2-адренорецепторов, ГК-рецепторов, рецепторов цис-ЛН и, возможно, др.) и клинико-функциональных маркеров с целью определения фенотипов/эндотипов заболевания и проведения персонализированного лечения.
источник