Патогенез неаллергической бронхиальной астмы
Патогенез инфекционно-зависимой бронхиальной астмы
Респираторные инфекции рассматриваются как факторы, способствующие возникновению или обострению течения бронхиальной астмы.
Патогенез глюкокортикоидного варианта бронхиальной астмы
Глюкокортикоидная недостаточность может быть одной из причин развития или обострения БА. Глюкокортикоидные гормоны оказывают следующее влияние на состояние бронхов :
повышают количество и чувствительность β-адренорецепторов к адреналину и, следовательно, увеличивают его бронходилатирующий эффект;
тормозят дегрануляцию тучных клеток и базофилов и выделение гистамина, лейкотриенов и других медиаторов аллергии и воспаления;
являются физиологическими антагонистами бронхоконстрикторных веществ, тормозят продукцию эндотелина-1, обладающего бронхоконстрикторным и провоспалительным эффектом, а также вызывающим развитие субэпителиального фиброза;
тормозят образование метаболитов арахидоновой кислоты — бронхоконстрикторньгх простагландинов;
В связи с наличием вышеуказанных свойств глюкокортикоиды тормозят развитие воспаления в бронхах, снижают их гиперреактивность, оказывают противоаллергическое и антиастматическое действие. Напротив, глюкокортикоидная недостаточность может в ряде случаев лежать в основе развития бронхиальной астмы.
Известны следующие механизмы формирования глюкокортикоидной недостаточности при бронхиальной астме:
нарушение синтеза кортизола в пучковой зоне коры надпочечников под влиянием длительной интоксикации, гипоксии;
нарушение соотношения между основными глюкокортикоидными гормонами (уменьшение синтеза кортизола и увеличение — кортикостерона, обладающего менее выраженными по сравнению с кортизолом противовоспалительными свойствами);
уменьшение в бронхах количества или чувствительности мембранных рецепторов к кортизолу, что, естественно, уменьшает воздействие глюкокортикоидов на бронхи (состояние кортизолорезистентности);
повышение порога чувствительности клеток гипоталамуса и гипофиза к регулирующему воздействию (по принципу обратной связи) уровня кортизола в крови, что на начальных этапах заболевания приводит к стимуляции синтеза глюкокортикоидов корой надпочечников, а при прогрессировании бронхиальной астмы — истощению резервных возможностей глюкокортикоидной функции;
подавление глюкокортикоидной функции надпочечников вследствие длительного лечения больных глюкокортикоидными препаратами.
Глюкокортикоидная недостаточность способствует развитию воспаления в бронхах, их гиперреактивности и бронхоспазма, приводит к формированию кортикозависимости (кортикозависимая бронхиальная астма).
Различают кортикочувствительную и кортикорезистентную кортикозависимую бронхиальную астму.
При кортикочувствительной бронхиальной астме для достижения ремиссии и ее поддержания требуются малые дозы системных или ингаляционных глюкокортикоидов. При кортикорезистентной бронхиальной астме ремиссия достигается большими дозами системных глюкокортикоидов.
Патогенез дизовариальной формы бронхиальной астмы
В настоящее время хорошо известно, что у многих женщин резко ухудшается течение бронхиальной астмы (возобновляются и ухудшаются приступы удушья) перед или во время менструации, иногда в последние дни менструации. Установлено влияние прогестерона и эстрогенов на тонус бронхов и состояние бронхиальной проходимости:
прогестерон стимулирует β2-адренорецепторы бронхов и синтез простагландина Е, что обусловливает бронходилатирующий эффект;
эстрогены повышают уровень ацетилхолина, что стимулирует ацетилхолиновые рецепторы бронхов и вызывают бронхоспазм;
эстрогены стимулируют активность бокаловидных клеток, слизистой оболочки бронхов и вызывают их гипертрофию, что приводит к гиперпродукции слизи и ухудшению бронхиальной проходимости;
эстрогены усиливают высвобождение гистамина и других биологических веществ из эозинофилов и базофилов, что обусловливает появление бронхоспазма;
эстрогены снижают активность β2-адренорецепторов бронхов.
Таким образом, эстрогены способствуют бронхоконстрикции, прогестерон — бронходилатации.
При дизовариальном патогенетическом варианте бронхиальной астмы наблюдается снижение в крови уровня прогестерона во IIфазе менструального цикла и повышение — эстрогенов. Указанные гормональные сдвиги приводят к развитию гиперреактивности бронхов и бронхоспазму.
Патогенез выраженного адренергического дисбаланса
Адренергический дисбаланс — это нарушение соотношения между β- и α-адренорецепторами бронхов с преобладанием активности а-адренорецепторов, что вызывает развитие бронхоспазма. В патогенезе адренергического дисбаланса имеет значение блокада β2-адренорецепторов и повышение чувствительности а-адренорецепторов. Развитие адренергического дисбаланса может быть вызвано врожденной неполноценностью адренорецепторов, их нарушением под влиянием вирусной инфекции, аллергической сенсибилизации, гипоксемии, изменений кислотно-щелочного равновесия (ацидоза), избыточного применения симпатомиметиков.
Патогенез нервно-психического варианта БА
О нервно-психическом патогенетическом варианте бронхиальной астмы можно говорить в том случае, если нервно-психические факторы являются причиной заболевания, а также достоверно способствуют его обострению и хронизации. Психоэмоциональные стрессы оказывают влияние на тонус бронхов через вегетативную нервную систему. Под влиянием психоэмоционального стресса повышается чувствительность бронхов к гистамину и ацетилхолину. Кроме того, эмоциональное
напряжение вызывает гипервентиляцию, стимуляцию ирритативных рецепторов бронхов внезапным глубоким вдохом, кашлем, смехом, плачем, что ведет к рефлекторному спазму бронхов.
А. Ю. Потоцкий (1996) выделяет 4 вида нервно-психического механизма патогенеза бронхиальной астмы: истероподобный, неврастеноподобный, психастеноподобный, шунтовой.
При истероподобном варианте развитие приступа бронхиальной астмы является определенным способом привлечь внимание окружающих и освободиться от ряда требований, условий, обстоятельств, которые больной считает неприятными для себя и обременительными.
При неврастеноподобном варианте формируется внутренний конфликт вследствие несоответствия возможностей пациента как личности и повышенных требований к себе (т.е. своего рода недостижимому идеалу). В этом случае приступ бронхиальной астмы становится как бы оправданием своей несостоятельности.
Психастенический вариант характеризуется тем, что приступ бронхиальной астмы появляется при необходимости принять серьезное, ответственное решение. Больные при этом тревожны, неспособны к самостоятельным решениям. Развитие приступа астмы в этой ситуации как бы избавляет больного от чрезвычайно сложной и ответственной для него ситуации.
Шунтовой вариант характерен для детей и позволяет им избегать конфронтации с конфликтами в семье. При ссоре родителей развитие приступа астмы у ребенка уводит родителей от выяснения отношений, так как переключает их внимание на болезнь ребенка, который при этом получает максимум внимания и заботы к себе.
Патогенез холинергического варианта
Холинергический вариант бронхиальной астмы — это форма заболевания, возникающая вследствие повышенного тонуса блуждающего нерва на фоне нарушений обмена холинергического медиатора — ацетилхолина. Этот патогенетический вариант наблюдается приблизительно у 10% больных. При этом в крови больных наблюдается увеличение уровня ацетилхолина и снижение ацетилхолинэстеразы — фермента, инактивирующего ацетилхолин; это сопровождается дисбалансом вегетативной нервной системы с преобладанием тонуса блуждающего нерва. Следует заметить, что высокий уровень ацетилхолина в крови наблюдается у всех больных бронхиальной астмой в периоде обострения, однако у больных холинергическим вариантом заболевания ацетилхолинемия значительно более выражена, и вегетативный и биохимический статус (в том числе уровень ацетилхолина в крови) не нормализуется даже в фазе ремиссии.
Патогенез «аспириновой» бронхиальной астмы
«Аспириновая» бронхиальная астма — это клинико-патогенетический вариант бронхиальной астмы, обусловленный непереносимостью ацетилсалициловой кислоты (аспирина) и других нестероидных противовоспалительных препаратов.
В основе «аспириновой» астмы лежит нарушение метаболизма арахидоновой кислоты под влиянием аспирина и других нестероидных противовоспалительных средств. «Аспириновую» астму вызывают аспирин, нестероидные противовоспалительные средства (индометацин, бруфен, вольтарен и др.), баралгин, другие лекарственные средства, в состав которых входит ацетилсалициловая кислота (цитрамон, асфен, аскофен), а также продукты, содержащие салициловую кислоту (огурцы, цитрусовые, томаты, различные ягоды).
Установлена также большая роль тромбоцитов в развитии «аспириновой астмы». У больных «аспириновой» астмой наблюдается повышенная активность тромбоцитов, что усугубляется в присутствии ацетилсалициловой кислоты.
Активация тромбоцитов сопровождается повышенной их агрегацией, увеличением выделения из них серотонина и тромбоксана. Оба эти вещества вызывают развитие спазма бронхов. Под
влиянием избытка серотонина усиливается секреция бронхиальных желез и отек слизистой оболочки бронхов, что способствует развитию бронхиальной обструкции.
Первично-измененная реактивность бронхов
Первично-измененная реактивность бронхов — это клинико-патогенетический вариант бронхиальной астмы, не относящийся к вышеперечисленным вариантам и характеризующийся появлением приступов удушья при физической нагрузке, вдыхании холодного воздуха, перемене погоды, от резких запахов.
Как правило, приступ бронхиальной астмы, возникающий при вдыхании холодного воздуха, раздражающих и резко пахнущих веществ, обусловлен возбуждением чрезвычайно реактивных ирритативных рецепторов
Патогенез астмы физического усилия
Астма физического усилия — клинико-патогенетический вариант бронхиальной астмы, характеризующийся появлением приступов удушья под влиянием субмаксимальной физической нагрузки; при этом отсутствуют признаки аллергии, инфекции, нарушений функции эндокринной и нервной систем.
Основными патогенетическими факторами астмы физического усилия являются:
гипервентиляция в ходе физической нагрузки; вследствие гипервентиляции происходят респираторная потеря тепла и жидкости, охлаждение слизистой оболочки бронхов, развивается гиперосмолярность бронхиального секрета; имеет место также механическое раздражение бронхов;
раздражение рецепторов блуждающего нерва и повышение его тонуса, развитие бронхоконстрикции;
дегрануляция тучных клеток и базофилов с выделением медиаторов (гистамина, лейкотриенов, хемотаксических факторов и других), вызывающих спазм и воспаление бронхов.
Наряду с указанными бронхоконстрикторными механизмами функционирует также и бронходилатирующий механизм — активация симпатической нервной системы и выделение адреналина. Физическая нагрузка оказывает два противоположных действия, направленных на гладкую мускулатуру бронхов: расширение бронхов в результате активации симпатической нервной системы и гиперкатехоламинемии и сужение бронхов в результате выброса медиаторов из тучных клеток и базофилов. В период физической нагрузки симпатические бронходилатирующие влияния преобладают. Однако бронходилатирующее действие непродолжительно — 1-5 мин, и вскоре после окончания нагрузки на первый план выступает действие медиаторов, и развивается бронхоспазм. Приблизительно через 15-20 мин происходит инактивация медиаторов.
При высвобождении медиаторов тучные клетки резко снижают свою способность к дальнейшему их выделению — наступает рефрактерность тучных клеток. Полупериод восстановления тучных клеток к синтезу половинного количества медиаторов в них составляет около 45 минут, а полное исчезновение рефрактерности наступает через 3-4 ч.
Патогенез аутоиммунного варианта бронхиальной астмы
Аутоиммунная бронхиальная астма — это форма заболевания, развивающаяся вследствие сенсибилизации к антигенам бронхопульмональной системы. Как правило, этот вариант является этапом дальнейшего прогрессирования и усугубления течения аллергической и инфекционнозависимой бронхиальной астмы. К патогенетическим механизмам этих форм присоединяются аутоиммунные реакции. При аутоиммунной бронхиальной астме выявляются антитела (антиядерные, противолегочные, к гладкой мускулатуре бронхов, к β-адренорецепторам мышц бронхов). Формирование иммунных комплексов (аутоантиген+аутоанитело) с активацией комплемента приводят к иммунокомплексному повреждению бронхов и β-адренергической блокаде.
Интегральная схема патогенеза БА
Роль вегетативной нервной системы в регуляции тонуса бронхов и развитии бронхоспазма
В регуляции тонуса бронхов и развитии бронхоспазма большую роль играют следующие отделы вегетативной нервной системы:
холинергическая (парасимпатическая) нервная система;
адренергическая (симпатическая) нервная система;
неадренергическая нехолинергическая нервная система (НАНХ).
Роль холинергической (парасимпатической) нервной системы
Блуждающий нерв играет большую роль в развитии бронхоспазма. На окончаниях блуждающего нерва выделяется нейромедиатор ацетилхолин, который взаимодействует с соответствующими холинергическими (мускариновыми) рецепторами, и происходит сокращение гладкой мускулатуры, развивается бронхоспазм. Обусловленная блуждающим нервом бронхоконстрикция имеет наибольшее значение для крупных бронхов.
Роль адренергической (симпатической) нервной системы
Известно, что у человека симпатические нервные волокна не определяются в гладкой мускулатуре бронхов, их волокна выявляются в сосудах и железах бронхов. Нейромедиатором адренергических (симпатических) нервов является норадреналин, образующийся в адренергических синапсах. Адренергические нервы непосредственно не контролируют гладкую мускулатуру бронхов. Принято считать, что существенную роль в регуляции бронхиального тонуса играют циркулирующие в крови катехоламины — адреномиметики (норадреналин и образующийся в надпочечниках адреналин).
Они проявляют свое влияние на бронхи через α — и β-адренорецепторы.
Активация α-адренорецепторов вызывает следующие эффекты:
сокращение гладкой мускулатуры бронхов;
уменьшение гиперемии и отека слизистой оболочки бронхов;
сокращение кровеносных сосудов.
Активация β2-адренорецепторов приводит к:
расслаблению гладкой мускулатуры бронхов;
увеличению мукоцилиарного клиренса;
расширению кровеносных сосудов.
Роль неадренергической нехолинергической нервной системы
В бронхах наряду с холинергической (парасимпатической) и адренергической (симпатической) нервной системой существует неадренергическая нехолинергическая нервная система (НАНХ), которая является частью вегетативной нервной системы. Волокна НАНХ-нервов проходят в составе блуждающего нерва и высвобождают ряд нейромедиаторов, влияющих через активацию соответствующих рецепторов на тонус бронхиальной мускулатуры.
Важнейшим бронходилатирующим медиатором НАНХ-системы является вазоактивный интестинальный полипептид (VIP). Бронходилатирующий эффектVIPосуществляюется посредством повышения уровня цАМФ.
В развитии приступа БА различают три периода — предвестников, разгара (удушья) и обратного развития.
Период предвестников наступает за несколько минут, часов, иногда дней до приступа и проявляется следующими симптомами: вазомоторными реакциями со стороны слизистой оболочки носа (обильным отделением водянистого секрета), чиханием, зудом глаз и кожи, приступообразным кашлем, одышкой, головной болью, усталостью, чрезмерным диурезом, нередко изменениями настроения (раздражительность, психическая депрессия, мрачные предчувствия).
Период разгара (удушья) имеет следующую симптоматику. Появляется ощущение нехватки воздуха, сдавление в груди, выраженная экспираторная одышка. Вдох становится коротким, выдох медленный, в 2-4 раза длиннее вдоха, сопровождается громкими, продолжительными, свистящими хрипами, слышимыми на расстоянии. Больной принимает вынужденное положение, сидит, наклонившись вперед, опираясь локтями на колени, или оперевшись руками о край стола, кровати, ловя ртом воздух. Речь почти невозможна, больной обеспокоен, испуган. Лицо бледное, с синюшным оттенком, покрыто холодным потом. Крылья носа раздуваются при вдохе. Грудная клетка в положении максимального вдоха, в дыхании участвуют мышцы плечевого пояса, спины, брюшной стенки.
Межреберные промежутки и надключичные ямки втягиваются при вдохе. Шейные вены набухшие. Во время приступа наблюдается кашель с очень трудно отделяемой вязкой, густой мокротой. После отхождения мокроты дыхание становится более легким. Над легкими перкуторный звук с тимпаническим оттенком, нижние границы легких опущены, подвижность легочных краев ограничена, на фоне ослабленного дыхания во время вдоха и особенно на выдохе слышно много сухих свистящих хрипов. Пульс учащен, слабого наполнения, тоны сердца приглушены. Приступ удушья может перейти в астматический статус , который может закончиться комой и даже смертью больного.
Период обратного развития приступа имеет разную продолжительность. У одних больных приступ заканчивается быстро без осложнений, у других — может продолжаться несколько часов и даже суток с сохранением затрудненного дыхания, недомогания, слабости. После приступа больные хотят отдохнуть, некоторые из них испытывают голод, жажду.
При анализе клинической картины бронхиальной астмы следует помнить о так называемом кашлевом варианте заболевания . При этой форме БА нет типичной клиники
приступа удушья, а при аускультации легких отсутствуют сухие хрипы или определяются очень скудные физикальные признаки. Единственным характерным признаком заболевания является приступообразный удушливый кашель, особенно часто возникающий по ночам. Во время приступа кашля возможно появление головокружения, наблюдается потливость, возможен цианоз лица. Для диагностики кашлевого варианта БА следует проводить мониторинг пиковой скорости выдоха, а также учитывать положительный эффект вечернего (профилактического) приема бронходилататоров.
Большое значение имеет определение степени тяжести приступа бронхиальной астмы. Это учитывается при оказании помощи больному и определении его трудоспособности.
источник
Аллергия, безусловно, является предметом иммунологии, ведь она связана с гиперчувствительностью иммунной системы. Под иммунитетом подразумевается невосприимчивость организма антигенам (чужеродным болезнетворным организмам, инфекционным агентам).
Глюкокортикоиды оказывают влияние на иммунитет, подавляя фагоцитарную активность лимфоцитов и снижая их количество в крови. Поэтому синтетические аналоги кортизола используют для лечения аллергических заболеваний, так как они могут оказывать противоаллергическое и противовоспалительное воздействие.
Аллергические реакции могут быть немедленными (Е-зависимыми) и иммуноцитотоксическими. Большую роль в формировании аллергической реакции играют тучные клетки, которые в большом количестве содержатся в полости носа, верхних и нижних дыхательных путях, а также в коже. Тучные клетки имеют на своей поверхности специальные рецепторы, которыми они могут связываться с иммуноглобулинами Е. Когда молекулы аллергена взаимодействуют с антителами иммуноглобулина Е, из гранул тучных клеток начинают выделяться особые вещества — медиаторы.
Первым из них стал открыт учеными гистамин (наверное, даже людям, далеким от мира медицины знаком термин «антигистаминный препарат» — лекарство, подавляющее аллергические реакции). Следствием деятельности тучных клеток также является выделение арахидоновой кислоты — предшественника простагландинов и лейкотриенов. Простагландины — это активные биологические вещества, которые образуются из жирных кислот, они влияют на кровообращение, работу легких, регулируют обмен веществ в клетках.
Наиболее распространенными аллергическими заболеваниями являются:
- аллергический ринит — аллергическое заболевание полости носа
- бронхиальная астма — аллергическое заболевание нижних дыхательных путей
- аллергический дерматит — аллергическое поражение кожи
Самые известные синтетические аналоги кортизола: дексаметазон и преднизолон. Они являются эффективным средством против аллергических заболеваний, так как имеют способность подавлять иммунитет. Как же взаимосвязаны кортизол и иммунная система?
Иммунитет может быть врожденным (например, все люди невосприимчивы к собачьей чумке) и приобретенным (после перенесенной скарлатины вероятность заболеть снова ничтожно мала). Приобретенный иммунитет может быть естественным (после болезни) и искусственным (после введения вакцины). Аллергия — это иммунная реакция, при которой организм человека вырабатывает иммуноглобулины Е, которые служат антителами для определенных белков.
| Иммунитет: | ||||
| Антиген | ⇒ | Антитела | ⇒ | Повышение сопротивляемости организма |
| Аллергия: | ||||
| Антиген | ⇒ | Антитела | ⇒ | Повышение чувствительности организма |
Основными клетками иммунной системы являются лейкоциты.
Человека окружает огромное множество неблагоприятных факторов — без механизмов защиты он просто не смог бы противостоять огромному множеству вирусов, бактерий и простейших, атакующих его организм. Иммунная система человека защищает его организм от заболеваний, обнаруживая и уничтожая потенциально угрожающие ему вещества.
Иммунитет — это целостная система защиты организма от различных заболеваний и неблагоприятных факторов внешней среды.
Неблагоприятные факторы внешней среды:
- Бактерии
- Вирусы
- Простейшие микроорганизмы
- Соматические мутации: злокачественное перерождение
Несмотря на то, что все эти факторы очень далеки друг от друга и имеют разное происхождение, у них есть общее — генетически все они являются чужеродными для человеческого организма. Угрожающие человеку вещества в науке называют антигенами. Антиген — потенциально опасное для организма вещество определенной структуры.
Основные органы иммунной системы:
- Костный мозг
- Селезенка
- Лимфатические узлы
- Тимус (зобная железа)
Лимфоциты — это одна из разновидностей лейкоцитов, главные клетки иммунной системы. Главная функция лимфоцитов — участие в работе иммунитета. Можно смело утверждать, что лимфоциты составляют костяк иммунной системы человека, ведь они являются ее защитниками, уничтожая чужеродные структуры.
| Лимфоциты | Функции лимфоцитов |
| B-лимфоциты Обеспечение гуморального иммунитета (кровь и жидкости организма) B-лимфоциты выделяют иммуноглобулины и интерфероны | |
| Т-лимфоциты Развиваются в тимусе, главная функция — обеспечение клеточного иммунитета | Играют важную роль в обеспечении клеточно-опосредованного иммунитета |
| К-лимфоциты | Клетки-киллеры. Разрушают вирусы и бактерии |
| NK-лимфоциты | Активны против опухолевых клеток |
В ходе эволюции был сформирован универсальный механизм защиты человека от губительных факторов внешней среды — иммунитет. Главными клетками иммунной системы являются лимфоциты (одна из разновидностей лейкоцитов).
- Распознавание чужеродных агентов
- Обезвреживание их с помощью специальных защитных белков
Изменение количества лимфоцитов в крови свидетельствует о начале воспалительного процесса — организм борется с «захватчиком» посредством повышения числа лимфоцитов. Лимфоциты синтезируют защитные белки-антитела, которые участвуют в обеспечении иммунитета.
Антитела — это защитные белки-иммуноглобулины (lgG, lgM, lgA, lgD, lgE). Антитела производятся B-лимфоцитами. Помимо иммуноглобулинов иммунная система активирует и другие биологические вещества: интерфероны, лизоцим и др.
Основное в развитии воспаления — это фагоцитоз, который осуществляют лимфоциты (биологическая теория И.И. Мечникова). Кортизол обладает свойством подавления иммунных реакций путем снижения фагоцитоза, в результате чего процесс образования защитных антител замедляется.
- подавляет клеточный и гуморальный иммунитет
- снижает количество лимфоцитов в крови, тем самым способствуя смягчению аллергической реакции и снимая воспаление.
Эти свойства кортизола широко используются в фармацевтической промышленности при изготовлении мазей для местного применения (синтетическими аналогами кортизола являются гидрокортизон и дексаметазон.)
Что качается аллергии, то ее образно называют гиперчувствительностью иммунной системы. Поскольку кортизол оказывает угнетающее действие на иммунную систему, он влияет и на выработку иммуноглобулина lgE, ответственного за аллергические реакции немедленного типа и блокирует процесс воспаления при аллергической реакции. Синтетические аналоги кортизола — это эффективное средство борьбы с аллергическими заболеваниями (бронхиальная астма, аллергический дерматит).
+7 (495) 50 254 50 — ГДЕ ЛУЧШЕ ЛЕЧИТЬ ОПУХОЛИ НАДПОЧЕЧНИКОВ
источник
Кортикостероиды — названия препаратов, показания и противопоказания, особенности применения у детей и взрослых, побочные эффекты
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Кортикостероиды выполняют много очень важных функций в организме.
Глюкокортикоиды относятся к стероидам, обладающим противовоспалительным действием, они участвуют в регуляции обмена углеводов, жиров и белков, контролируют половое созревание, функцию почек, реакцию организма на стресс, способствуют нормальному течению беременности. Инактивируются кортикостероиды в печени и выводятся с мочой.
Альдостерон регулирует обмен натрия и калия. Таким образом, под влиянием минералокортикоидов в организме задерживается Na+ и увеличивается выведение из организма ионов К+.
Практическое применение в медицинской практике нашли синтетические кортикостероиды, обладающие теми же свойствами, что и природные. Они способны на время подавлять воспалительный процесс, но на инфекционное начало, на возбудителей заболевания они действия не оказывают. После прекращения действия кортикостероидного препарата инфекция возобновляется.
Кортикостероиды вызывают в организме напряжение и стресс, а это приводит к снижению иммунитета, так как иммунитет обеспечивается на достаточном уровне только в расслабленном состоянии. Учитывая вышесказанное, можно сказать, что применение кортикостероидов способствует затяжному течению заболевания, блокирует процесс регенерации.
Кроме того, синтетические кортикостероиды подавляют функцию природных гормонов кортикостероидов, что влечет за собой нарушение функции надпочечников в целом. Кортикостероиды оказывают влияние на работу и других желез внутренней секреции, нарушается гормональный баланс организма.
Кортикостероидные препараты, устраняя воспаление, оказывают и обезболивающее действие. К синтетическим кортикостероидным препаратам относятся Дексаметазон, Преднизолон, Синалар, Триамцинолон и другие. Эти препараты обладают более высокой активностью и вызывают меньше побочных явлений, чем природные.
- Преднизолон;
- Целестон;
- Триамцинолон;
- Кенакорт;
- Кортинефф;
- Полькортолон;
- Кеналог;
- Метипред;
- Берликорт;
- Флоринеф;
- Медрол;
- Лемод;
- Декадрон;
- Урбазон и др.
- Преднизолон (мазь);
- Гидрокортизон (мазь);
- Локоид (мазь);
- Кортейд (мазь);
- Афлодерм (крем);
- Латикорт (крем);
- Дермовейт (крем);
- Фторокорт (мазь);
- Лоринден (мазь, лосьон);
- Синафлан (мазь);
- Флуцинар (мазь, гель);
- Клобетазол (мазь) и др.
Топические кортикостероиды подразделяются на более и менее активные.
Слабоактивные средства: Преднизолон, Гидрокортизон, Кортейд, Локоид;
Умеренно активные: Афлодерм, Латикорт, Дермовейт, Фторокорт, Лоринден;
Высокоактивные: Акридерм, Адвантан, Кутерид, Апулеин, Кутивейт, Синафлан, Синалар, Синодерм, Флуцинар.
Очень высокоактивные: Клобетазол.
- Ревматизм;
- ревматоидный и другие виды артритов;
- коллагенозы, аутоиммунные заболевания (склеродермия, системная красная волчанка, узелковый периартериит, дерматомиозит);
- болезни крови (миелобластный и лимфобластный лейкозы);
- некоторые виды злокачественных новообразований;
- кожные заболевания (нейродермит, псориаз, экзема, себорейный дерматит, красная дискоидная волчанка, атопический дерматит, эритродермия, красный плоский лишай);
- бронхиальная астма;
- аллергические заболевания;
- пневмонии и бронхиты, фиброзирующие альвеолиты;
- гломерулонефрит;
- язвенный колит и болезнь Крона;
- острый панкреатит;
- гемолитическая анемия;
- вирусные заболевания (инфекционный мононуклеоз, вирусный гепатит и другие);
- наружный отит (острый и хронический);
- лечение и профилактика шока;
- в офтальмологии (при неинфекционных заболеваниях: ирит, кератит, иридоциклит, склерит, увеит);
- неврологические заболевания (рассеянный склероз, острая травма спинного мозга, неврит зрительного нерва;
- при трансплантации органов (для подавления отторжения).
- Болезнь Аддисона (хроническая недостаточность гормонов коры надпочечников);
- миастения (аутоиммунное заболевание, проявляющееся мышечной слабостью);
- нарушения минерального обмена;
- адинамия и мышечная слабость.
- повышенная чувствительность к препарату;
- тяжелые инфекции (кроме туберкулезного менингита и септического шока);
- ветряная оспа;
- иммунизация живой вакциной.
С осторожностью следует применять глюкокортикостероиды при сахарном диабете, гипотиреозе, язвенной болезни желудка и 12-перстной кишки, язвенном колите, повышенном артериальном давлении, циррозе печени, сердечно-сосудистой недостаточности в стадии декомпенсации, повышенном тромбообразовании, туберкулезе, катаракте и глаукоме, психических заболеваниях.
Противопоказания для назначения минералокортикоидов:
- повышенное кровяное давление;
- сахарный диабет;
- пониженный уровень калия в крови;
- глаукома;
- почечно-печеночная недостаточность.
Кортикостероиды могут вызывать самые разнообразные побочные эффекты. При использовании слабоактивных или умеренно активных средств побочные реакции менее выражены и возникают редко. Высокие дозы препаратов и использование высокоактивных кортикостероидов, длительное их применение могут вызвать такие побочные эффекты:
- появление отеков в связи с задержкой натрия и воды в организме;
- повышение кровяного давления;
- повышение уровня сахара в крови (возможно даже развитие стероидного сахарного диабета);
- остеопороз в связи с усиленным выделением кальция;
- асептический некроз костной ткани;
- обострение или возникновение язвенной болезни желудка; желудочно-кишечные кровотечения;
- повышенное тромбообразование;
- увеличение массы тела;
- возникновение бактериальных и грибковых инфекций в связи со снижением иммунитета (вторичный иммунодефицит);
- нарушение менструального цикла;
- неврологические расстройства;
- развитие глаукомы и катаракты;
- атрофия кожи;
- повышенное потоотделение;
- появление угревой сыпи;
- подавление процесса регенерации тканей (медленное заживление ран);
- избыточный рост волос на лице;
- угнетение функции надпочечников;
- нестабильность настроения, депрессии.
Длительные курсы кортикостероидов могут привести к изменению внешнего вида пациента (синдром Иценко-Кушинга):
- избыточное отложение жира в отдельных участках туловища: на лице (так называемое «лунообразное лицо»), на шее («бычья шея»), груди, на животе;
- мышцы конечностей атрофированы;
- кровоподтеки на коже и стрии (полосы растяжения) на животе.
При этом синдроме отмечается также задержка роста, нарушения образования половых гормонов (нарушения менструаций и мужской тип роста волос у женщин, и признаки феминизации у мужчин).
Для снижения риска развития побочных реакций важно своевременно реагировать на их появление, проводить коррекцию доз (применение малых доз по возможности), контролировать массу тела и калорийность потребляемых продуктов, ограничить употребление поваренной соли и жидкости.
Режим дозирования назначает врач. Таблетированный препарат следует принимать с 6 часов утра (первая доза) и не позже 14 часов последующие. Такие условия приема необходимы для приближения к физиологическому поступлению глюкокортикоидов в кровь при выработке их корой надпочечников.
В некоторых случаях, при больших дозах и в зависимости от характера заболевания, доза распределяется врачом на равномерное поступление в течение суток за 3-4 приема.
Таблетки следует принимать во время еды или сразу после приема пищи, запивая небольшим количеством воды.
Выделяют такие разновидности терапии кортикостероидами:
- интенсивная;
- лимитирующая;
- альтернирующая;
- интермиттирующая;
- пульс-терапия.
При интенсивной терапии (в случае острой, угрожающей жизни патологии) препараты вводят внутривенно и по достижению эффекта отменяют одномоментно.
Лимитирующую терапию применяют при длительных, хронических процессах – применяются, как правило, таблетированные формы в течение нескольких месяцев или даже лет.
Для снижения угнетающего действия на функцию желез внутренней секреции применяются схемы прерывистого приема препаратов:
- альтернирующая терапия – применяют глюкокортикоиды с короткой и средней длительностью действия (Преднизолон, Метилпреднизолон) однократно с 6 до 8 часов утра каждые 48 часов;
- интермиттирующая терапия – короткие, 3-4- дневные курсы приема препарата с 4-дневными перерывами между ними;
- пульс-терапия – быстрое внутривенное введение большой дозы (не менее 1 г) препарата для оказания неотложной помощи. Препаратом выбора для такого лечения является Метилпреднизолон (он более доступен для введения в пораженные участки и дает меньше побочных эффектов).
Суточные дозы препаратов (в пересчете на Преднизолон):
- Низкие – меньше 7,5 мг;
- Средние – 7,5 -30 мг;
- Высокие – 30-100 мг;
- Очень высокие – выше 100 мг;
- Пульс-терапия – выше 250 мг.
Лечение кортикостероидами должно сопровождаться назначением препаратов кальция, витамина D для профилактики остеопороза. Диета пациента должна быть богата белками, кальцием и включать ограниченное количество углеводов и поваренной соли (до 5 г в сутки), жидкости (до 1.5 л в сутки).
Для профилактики нежелательного воздействия кортикостероидов на желудочно-кишечный тракт перед приемом таблеток можно рекомендовать употребление Алмагеля, киселей. Рекомендуется исключить курение, злоупотребление алкогольными напитками; умеренные занятия физическими упражнениями.
Системные глюкокортикоиды назначаются детям исключительно по абсолютным показаниям. При синдроме бронхообструкции, угрожающем жизни ребенка, применяется внутривенное введение преднизолона в дозе 2-4 мг на 1 кг массы тела ребенка (в зависимости от тяжести течения заболевания), и доза при отсутствии эффекта увеличивается на 20-50% каждые 2-4 часа до получения эффекта. После этого препарат отменяется сразу, без постепенного снижения дозировки.
Детей с гормональной зависимостью (при бронхиальной астме, например) после внутривенного введения препарата постепенно переводят на поддерживающую дозу преднизолона. При частых рецидивах астмы применяют Бекламетазона дипропионат в виде ингаляций – доза подбирается индивидуально. После получения эффекта доза снижается постепенно до поддерживающей (подобранной индивидуально).
Топические глюкокортикоиды (кремы, мази, лосьоны) применяются в детской практике, но дети имеют более высокую предрасположенность к системному действию препаратов, чем взрослые пациенты (задержка развития и роста, синдром Иценко-Кушинга, угнетение функции желез внутренней секреции). Это связано с тем, что у детей отношение площади поверхности тела к массе тела больше, чем у взрослых.
По этой причине применять топические глюкокортикоиды у детей необходимо только на ограниченных участках и коротким курсом. Особенно это касается новорожденных. Для детей первого года жизни можно применять только мази, содержащие не более 1% гидрокортизона или препарат четвертого поколения – Предникарбат (Дерматол), а в возрасте до 5 лет – Гидрокортизона 17-бутират или мази с препаратами средней силы.
Для лечения детей старше 2 лет может использоваться по назначению врача Мометазон (мазь, имеет пролонгированное действие, наносится 1 р. в сутки).
Существуют и другие препараты для лечения атопического дерматита у детей, с менее выраженным системным действием, например, Адвантан. Он может применяться до 4 недель, но его применение ограничено из-за возможности появления местных побочных реакций (сухость и истончение кожи). В любом случае выбор препарата для лечения ребенка остается за врачом.

Это отрицательное влияние глюкокортикоидов усиливается в результате того, что современные препараты длительного действия (Метипред, Дексаметазон) не дезактивируются ферментами плаценты и оказывают длительное действие на плод. Глюкокортикоиды, подавляя систему иммунитета, способствуют снижению сопротивляемости беременной женщины к бактериальным и вирусным инфекциям, которые также могут отрицательно воздействовать на плод.
Глюкокортикоидные препараты могут назначаться беременной только в том случае, когда результат их применения превышает в значительной степени риск возможных отрицательных последствий для плода.
Такими показаниями могут быть:
1. Угроза преждевременных родов (короткий курс гормонов улучшает готовность недоношенного плода к рождению); применение сурфактанта для ребенка после рождения позволило свести до минимума применение гормонов при этом показании.
2. Ревматизм и аутоиммунные заболевания в активной фазе.
3. Наследственная (внутриутробная) гиперплазия у плода коркового слоя надпочечников – трудно диагностируемое заболевание.
Ранее существовала практика назначения глюкокортикоидов для сохранения беременности. Но убедительных данных о эффективности такой методики не получено, поэтому в настоящее время она не применяется.
В акушерской практике чаще применяются Метипред, Преднизолон и Дексаметазон. Через плаценту они проникают по-разному: Преднизолон разрушается ферментами в плаценте в большей степени, а Дексаметазон и Метипред – всего лишь на 50%. Поэтому, если гормональные препараты используются для лечения беременной – предпочтительнее назначать Преднизолон, а если для лечения плода – Дексаметазон или Метипред. В связи с этим Преднизолон и побочные реакции у плода вызывает реже.
В грудное молоко глюкокортикоиды в малых дозах проникают плохо и не представляют для ребенка опасности.
Препараты в более высоких дозах и длительный курс лечения кормящей матери гормонами могут стать причиной задержки роста ребенка и угнетения у него функции желез внутренней секреции (гипофиза, гипоталамуса, надпочечников).
Для купирования приступа доза подбирается индивидуально. В США назначают Метилпреднизолон внутривенно по 40-60 мг через каждые 6 часов. В Великобритании применяют Преднизолон внутрь 30-40 мг 1 р. в сутки. Высокие дозы не более эффективны, чем обычные, а внутренний прием не менее эффективен, чем внутривенное введение.
Действие глюкокортикоидов наступает через 6 часов после приема. При быстром снижении дозы препарата может возобновиться приступ. Оптимальным вариантом является снижение дозы в 2 р. каждые 3-5 дней после купирования приступа.
При необходимости длительного применения глюкокортикоидов лучше использовать альтернативную схему лечения – принимать их через день. Это снизит риск развития побочных эффектов, что особенно важно при лечении детей, т.к. гормоны могут вызвать задержку роста. Глюкокортикоиды длительного действия не следует использовать для лечения бронхиальной астмы, так как они угнетают функцию гипофиз-надпочечниковой системы.
Для лечения бронхиальной астмы широко используются ингаляционные глюкокортикоиды. Они дают максимальный местный эффект и наименьшее число осложнений за счет минимального всасывания. Они применяются для облегчения отмены гормонального препарата после длительного его приема, снижения частоты приступов при физических нагрузках.
Ингаляционные препараты быстрого эффекта не дают – их надо применять несколько недель или даже месяцев. Дозу ингаляционного препарата можно повышать, но при этом возрастает риск возникновения побочных явлений. Их можно комбинировать с приемом глюкокортикоидов внутрь – потребность в препаратах для внутреннего приема при этом снижается.
Растворы глюкокортикоидов для ингаляций можно вводить с помощью распылителей – это обеспечит более глубокое проникновение препарата. При таком способе применения снижается риск развития побочных эффектов – кандидозного стоматита и нарушения голоса. С целью профилактики кандидозного стоматита следует после ингаляции хорошо прополоскать водой рот. После отмены внутреннего приема препарата ингаляционное лечение продолжается в качестве поддерживающей терапии.
Подробнее о бронхиальной астме
Глюкокортикоиды широко применяются при лечении аллергических реакций на введение анестетиков для наркоза во время операции. При тяжелых аллергических проявлениях хороший эффект дает внутривенное введение глюкокортикоидов, но начало их действия отсрочено на 2-8 часов. Поэтому, во избежание выраженного бронхоспазма параллельно необходимо немедленно вводить Эпинефрин.
Глюкокортикоиды при тяжелой форме аллергии назначаются и системные (инъекции или таблетки), и местные (мази, гели, капли, ингаляции). Они оказывают мощное противоаллергическое действие. В основном используются такие препараты: Гидрокортизон, Преднизолон, Дексаметазон, Бетаметазон, Беклометазон.
Из топических глюкокортикоидов (для местного лечения) в большинстве случаев применяются интраназальные аэрозоли: при поллинозе, аллергическом рините, заложенности носа (чихании). Обычно они оказывают хороший эффект. Широкое применение нашли Флютиказон, Дипропионат, Пропионат и другие.
При аллергических конъюнктивитах в связи с более высоким риском развития побочных эффектов глюкокортикоиды применяются редко. В любом случае, при аллергических проявлениях применять гормональные лекарственные средства самостоятельно нельзя во избежание нежелательных последствий.
Подробнее об аллергии
Глюкокортикоиды для местного применения (мази, кремы) используют обычно 2 р. в день: кремы в течение дня без повязок, а на ночь вместе с каменноугольным дегтем или антралином с использованием окклюзионной повязки. При обширных поражениях на обработку всего тела используется примерно 30 г препарата.
Выбор глюкокортикоидного препарата по степени активности для местного применения зависит от тяжести течения псориаза и его распространенности. По мере уменьшения в процессе лечения очагов псориаза следует менять препарат на менее активный (или реже использовать) для минимизации возникновения побочных эффектов. При получении эффекта примерно через 3 недели лучше заменить гормональный препарат смягчающим средством на 1-2 недели.
Применение глюкокортикоидов на больших площадях в течение длительного периода может усугублять процесс. Рецидив псориаза после прекращения применения препарата наступает раньше, чем при лечении без применения глюкокортикоидов.
Подробнее о псориазе
- Антациды (препараты, снижающие кислотность желудочного сока) снижают всасывание глюкокортикоидов, принимаемых внутрь.
- Барбитураты, Дифенин, Гексамидин, Карбамазепин, Рифампицин, Димедрол ускоряют метаболизм (превращения) глюкокортикоидов в печени, а Эритромицин и Изониазид замедляют его.
- Глюкокортикоиды ускоряют выведение из организма Бутадиона, салицилатов, барбитуратов, Дигитоксина, Дифенина, Пенициллина, Изониазида, Хлорамфеникола.
- Глюкокортикоиды при совместном приеме с Изониазидом могут вызывать нарушения психики; с резерпином – депрессивные состояния.
- Трициклические антидепрессанты (Амитриптилин, Коаксил, Имипрамин и другие) в комбинации с глюкокортикоидами могут вызвать повышение внутриглазного давления.
- Глюкокортикоиды (при длительном их приеме) усиливают эффективность адреномиметиков (Адреналин, Дофамин, Норадреналин).
- Теофиллин в сочетании с глюкокортикоидами способствует появлению кардиотоксического эффекта; усиливает противовоспалительный эффект глюкокортикоидов.
- Амфотерицин и мочегонные препараты в сочетании с кортикостероидами повышают риск возникновения гипокалиемии (снижение уровня калия в крови) и усиление мочегонного действия (а иногда задержка натрия).
- Совместное применение минералокортикоидов и глюкокортикоидов усиливает гипокалиемию и гипернатриемию. При гипокалиемии возможно появление побочных эффектов сердечных гликозидов. Слабительные средства могут усиливать гипокалиемию.
- Непрямые антикоагулянты, Бутадион, Этакриновая кислота, Ибупрофен в сочетании с глюкокортикоидами могут вызвать геморрагические проявления (кровоточивость), а салицилаты и Индометацин – образование язв в органах пищеварения.
- Глюкокортикоиды усиливают токсическое действие на печень парацетамола.
- Препараты Ретинола снижают противовоспалительный эффект глюкокортикоидов и улучшают заживление ран.
- Применение гормонов вместе с Азатиоприном, Метандростенолоном и Хингамином повышает риск развития катаракты и других побочных реакций.
- Глюкокортикоиды снижают действие Циклофосфана, противовирусное действие Идоксуридина, эффективность сахароснижающих препаратов.
- Эстрогены усиливают действие глюкокортикоидов, что может позволить снизить их дозировку.
- Андрогены (мужские половые гормоны) и препараты железа усиливают эритропоэз (образование эритроцитов) при комбинации их с глюкокортикоидами; снижают процесс выведения гормонов, способствуют появлению побочных эффектов (повышение свертывания крови, задержка натрия, нарушение менструального цикла).
- Начальная стадия наркоза при применении глюкокортикоидов удлиняется и сокращается продолжительность наркоза; дозы Фентанила уменьшаются.
При длительном приеме глюкокортикоидов отмена препарата должна быть постепенной. Глюкокортикоиды подавляют функцию коры надпочечников, поэтому при быстрой или внезапной отмене препарата может развиться надпочечниковая недостаточность. Унифицированной схемы для отмены кортикостероидов нет. Режим отмены и снижения дозы зависит от длительности предшествующего курса лечения.
Если длительность курса глюкокортикоида до нескольких месяцев, то можно снижать дозу Преднизолона на 2,5 мг (0,5 таблетки) каждые 3-5 дней. При большей продолжительности курса доза снижается более медленно – на 2,5 мг каждые 1-3 недели. С большой осторожностью снижается доза ниже 10 мг – по 0,25 таблетки каждые 3-5-7 дней.
Если исходная доза Преднизолона была высокой, то вначале снижение производят более интенсивно: на 5-10 мг каждые 3 дня. По достижению суточной дозы равной 1/3 исходной дозу снижают на 1,25 мг (1/4 таблетки) каждые 2-3 недели. В результате такого снижения пациент получает поддерживающие дозы в течение года и более.
Режим снижения препарата назначает врач, и нарушение этого режима может привести к обострению заболевания – лечение придется начинать снова с большей дозы.
источник
Бронхиальной астмой называют хроническое заболевание дыхательной системы, при котором отмечается сильное сужение бронхов. Гормоны при астме нужны для оказания противовоспалительного и антиаллергического эффекта.
В базисную терапию астмы включены глюкокортикостероиды. Если их не применять для лечения заболевания, сильно возрастает зависимость от симптоматических бронходилататоров. Это является признаком неконтролируемого течения астмы.
Глюкокортикостероиды — это гормоны, производимые корой надпочечников. В организме человека вырабатывается кортизол, кортикостерон.
Разностороннее воздействие на организм этих биологически активных веществ позволило активно использовать их в лечении различных заболеваний, в том числе астмы.
Сейчас существует ряд фторированных и нефторированных синтетических глюкокортикоидов. В отличие от природных, они обладают большей активностью, поэтому действуют более эффективно.
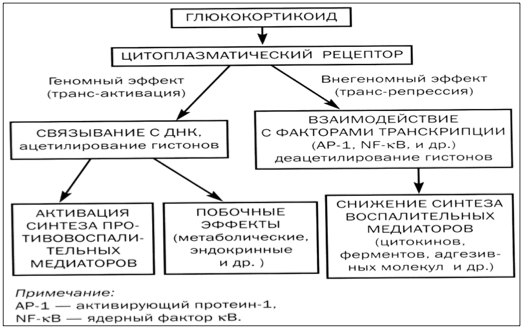
Для полного понимания, почему так активно используют гормоны от астмы, важно знать их механизм действия. В клетках человеческого организма существуют специальные рецепторы, с которыми глюкокортикостероиды связываются, проникая в цитоплазму.
Полученный в результате этого взаимодействия комплекс проникает внутрь ядра, где воздействует непосредственно на ДНК. Это позволяет активировать процесс образования различных белков:
- липокортин-1. Его действие направлено на торможение продукции арахидоновой кислоты, из которой синтезируются медиаторы воспаления;
- нейтральная эндопептидаза. Нужна для разрушения кининовых комплексов, принимающих участие в развитии воспалительного процесса;
- интерлейкин-10, оказывающий противовоспалительное действие;
- ингибитор ядерного фактора. Играет важную роль в торможении воспалительного процесса бронхов.
За счет действия комплекса гормон-рецептор наблюдается выраженное торможение образования активизирующих воспалительный процесс белков.
Глюкокортикоиды благодаря своим свойствам отлично помогают при бронхиальной астме, давая выраженный противовоспалительный эффект.
Применение глюкокортикоидов при бронхиальной астме является традиционным методом лечения данного заболевания. Их использование началось еще в середине 40-х годов ХХ века, после того, как Ф. Хенч и Э. Кендэлл смогли искусственно синтезировать ГКС.
Поняв, что глюкокортикостероиды помогают в контроле воспалительного процесса при гормональной астме, они начали активно тестировать их при лечении заболевания, однако отметили большое количество побочных эффектов и временно прекратили их использование.
В современной медицине астматикам назначается два типа гормональных препаратов: ингаляционные и системные ГКС.
Главные преимущества, объясняющие широкое применение ингаляционных глюкокортикостероидов (ИГКС) для лечения бронхиальной астмы, — высокая липофильность, малый период полувыведения, а также быстрая инактивация.
В клинической практике используются следующие ИГКС:
- беклометазона дипропионат;
- будесонид;
- мометазона фуроат;
- флутиказона пропионат;
- циклесонид.
Механизм действия ИГКС при бронхиальной астме основан на их высокой липофильности. Эпителий человеческих бронхов покрыт незначительным слоем жидкости.
Поэтому не все вещества могут быстро проникнуть сквозь этот барьер. Липофильность позволяет препарату быстро достичь слизистой оболочки бронхов и проникнуть в кровеносную систему.
Эффект от применения ингаляционных глюкокортикоидов напрямую зависит от того, каким методом они были доставлены в организм.
Так, при использовании ингаляторов с аэрозолями большая часть препарата оседает в ротовой полости либо проглатывается. Лишь 10% достигает непосредственно слизистой оболочки бронха.
При вдыхании препарата через спейсер — около 5%. В системный кровоток ИГКС попадают в виде неактивных продуктов обмена, за исключением беклометазона. Также применяется введение препаратов через небулайзер для определенных групп пациентов, а именно:
- дети;
- пожилые люди;
- люди с нарушениями сознания;
- больные с сильной бронхиальной обструкцией.
Согласно ряду клинических испытаний, ингаляционные глюкокортикостероиды крайне эффективны при бронхиальной астме.
Системные глюкокортикостероиды (СГКС) не являются препаратами экстренной помощи при бронхиальной астме, однако они крайне важны для проведения терапевтических мероприятий во время обострений. В целом они нужны для повышения качества жизни пациента и не обладают быстрым эффектом.
Согласно глобальной стратегии ВОЗ, крайне важно применять СГКС при всех обострениях астмы, за исключением самых легких. Особенно это касается следующих случаев:
- после введения ИГКС не отмечается улучшения состояния пациента;
- приступ начался, несмотря на прием ИГКС;
- требуется увеличение дозы ИГКС;
- состояние пациента постоянно ухудшается;
- снижение реакции организма на действие ИГКС;
- снижение пикфлоуметрических показателей (ПСВ ниже 60%)
Отмечается, что для длительной терапии лучше применять СГКС в форме таблеток, внутривенное введение чаще используется при приступе. Основные глюкокортикостероиды, использующиеся для системной терапии при бронхиальной астме, — это преднизолон и гидрокортизон.
При пероральном приеме отмечается крайне высокая биодоступность. Максимальная концентрация препаратов в крови при внутривенном введении достигается менее чем через час после попадания в организм.
В печени данные лекарственные средства метаболизируются, а затем выводятся вместе с мочой.
При лечении больных гормонозависимой бронхиальной астмой важно помнить, что ГКС обладают рядом побочных эффектов, которые можно разделить на две группы:
- Развивающиеся во время терапии заболевания.
- Развивающиеся после прекращения лечения (синдром отмены).
К первой группе можно отнести следующие последствия:
- метаболические нарушения;
- повышение артериального давления;
- снижение иммунного статуса;
- язвенная болезнь;
- миопатия;
- расстройства психики;
- нарушения роста у детей;
- кушингоид.
Метаболические нарушения проявляются в виде гипергликемии, нарушении жирового, а также водно-электролитного обмена. Повышение уровня сахара в крови связано с тем, что на фоне приема ГКС отмечается увеличение устойчивости тканей к действию инсулина.
При этом данное состояние наблюдается достаточно редко, и к нему более склонны люди, которые, помимо гормональной астмы, болеют сахарным диабетом.
Нарушение обмена жиров проявляется в том, что на лице и туловище наблюдается чрезмерное развитие жировой ткани. Развивается так называемый кушингоидный хабитус.
Нарушения водного и минерального обмена проявляются в виде задержки воды в организме и потери кальция и калия.
Артериальная гипертензия при приеме ГКС связана с их воздействием на стенки сосудов. Развивается при длительном лечении большими дозами препаратов.
Еще реже возникает язвенная болезнь. Именно поэтому, все больные, которые применяют в лечении астмы СГКС, должны проходить обследования на предмет наличия язв в желудке.
У некоторых больных, применяющих ГКС, может возникнуть мышечная слабость, вплоть до полной атрофии. Это напрямую связано с влиянием препаратов на минеральный обмен. Также миопатия может наблюдаться при кушингоиде, поэтому ее нельзя называть специфичным побочным эффектом.
Легкие нарушения психического состояния могут наблюдаться в самом раннем начале терапии ГКС. Так, у больных отмечаются нервозность, частая смена настроения, а также нарушения сна. Стероидные психозы развиваются крайне редко.
У детей при использовании СГКС может отмечаться нарушение роста. В особенности этому подвержены мальчики. Считается, что патология связана с нарушением продукции половых гормонов.
При синдроме отмены наблюдается повышенная утомляемость, отсутствие аппетита, лихорадка, тошнота, а также сильные головные боли. В некоторых случаях может проявиться недостаточность надпочечников. Крайне редко наблюдается клиника псевдоопухоли мозга.
Первое, что должны понимать люди, больные гормонозависимой бронхиальной астмой, — нельзя самостоятельно отказываться от применения ГКС. Лечение должно быть системным и проходить под контролем специалиста.
Если говорить о лечении астмы без гормональных препаратов, то нужно вспомнить о такой группе лекарств, как кромоны. Нужно понимать, что данные лекарственные средства в большей мере обладают профилактическим, а не лечебным эффектом.
Их рекомендуется применять в период ремиссии. Существует много форм кромонов, однако лучший эффект достигается при применении при помощи ингаляторов. Они обладают рядом преимуществ:
- простота применения;
- отсутствие привыкания;
- минимальный риск побочных эффектов.
Благодаря своим свойствам препараты кромоглициевой кислоты отлично подходят для профилактики приступов астмы у детей, страдающих легкой формой заболевания. В соответствии с глобальной стратегией ВОЗ, они являются препаратом выбора.
Согласно проведенным исследованиям, если при средней тяжести и тяжелом течении астмы применение ИГКС не вызывает вопросов, то на начальных стадиях их употребление не оправдано.
Лечение астмы без гормонов у взрослого человека, который уже длительное время применял стероиды, практически невозможно.
Медикаментозные средства, такие как ИГКС и СГКС, при лечении бронхиальной астмы важно применять под контролем лечащего врача. Препараты необходимо подбирать индивидуально, а само лечение должно носить системный характер.
При обострениях БА рекомендуется использовать ИГКС для снятия приступа, а затем, при необходимости подключать СГКС. Несмотря на риск развития побочных эффектов, данные средства являются оптимальным вариантом лечения астмы.
источник