Обострение бронхиальной астмы чаще всего возникает из-за воздействия на организм пациента раздражителя, т. е. аллергена. Аллергическая реакция является наиболее часто встречающейся причиной астмы.
Эта форма заболевания обычно выявляется у людей в возрасте от 30 лет. Доказано, что непереносимость нестероидных обезболивающих препаратов встречается приблизительно у 20% астматиков. Принятие обезболивающих при бронхиальной астме вызывает обострение заболевания.
Есть перечень средств, противопоказанных для применения во время астмы. Существует особая фенотипическая форма болезни респираторных путей, названная аспириновой бронхиальной астмой. Типичным симптомом является затруднение дыхания после использования НПВС. Заболевание обуславливается непереносимостью медикаментов и генетическими факторами.
В некоторых случаях у больных с патологиями дыхательной системы, без генетической предрасположенности, при терапии некоторыми группами препаратов также возникает гиперреактивность бронхов. Появляется она из-за различных механизмов действия препаратов и проявляется в виде нетипичного в нормальной ситуации ответа на раздражители.
Аспириновая бронхиальная астма – один из подвидов заболевания, при котором появление сильных сокращений гладкой мышечной ткани в бронхах и, как следствие, удушья связано с гиперчувствительностью к анальгетикам. Первый зафиксированный случай заболевания произошел в начале XX века с появлением на рынке медикаментов на основе ацетилсалициловой кислоты. Аллергическая реакция может возникать и из-за природных салицилатов.
При этом возникает нарушение обмена арахидоновой кислоты, что, в свою очередь, вызывает сокращение мышц, приводящее к сужению бронхов. Заболевание тяжело поддается лечению, практически не поддается воздействию медицинских препаратов, снимающих спазмы. Для расслабления мышц потребуется применение препаратов глюкокортикостероидной группы путем ингаляции. Использование синтетических гормонов нужно начинать на ранних стадиях болезни во избежание осложнений.
Появление заболевания обусловлено гиперчувствительностью иммунной системы к некоторым противовоспалительным нестероидным средствам. У больных часто наблюдается перекрестная реакция, т.е. если есть гиперчувствительность к ацетилсалициловой кислоте, появляется такая же проблема с другими нестероидными анальгетиками.
Естественные салицилаты также нередко приводят к возникновению аллергии. Они содержатся в томатах, огурцах, цитрусовых, яблоках, перце. Часть ягод также содержит соли салициловой кислоты – она содержится в малине, землянике, клубнике. Некоторые приправы, такие как корица и куркума, содержат вещества, приводящие к аллергической реакции.
Красители и консервированная пища, содержащие тартразин, производные салициловых и бензойных кислот, вызывают у людей с повышенной чувствительностью к салицилатам аллергическую реакцию.
Принцип возникновения спазма мышечной ткани базируется не на типичной аллергической реакции, а на нарушении обменных процессов арахидоновой кислоты. При этом в организме появляется избыток воспалительных медиаторов – цистеиновых лейкотриенов, усиливающих процесс воспаления в респираторном тракте.
Это приводит к возникновению спазма мышц бронхов, гиперсекреции слизи в бронхах, повышению проницаемости сосудов. Эти особенности позволяют причислять болезнь к псевдоатопии дыхательных путей, т. е. псевдоаллергии.
Аллергическую реакцию, возникающую при использовании НПВС, разделяют на три формы – чистая аспириновая астма, аспириновая триада и сочетание повышенной чувствительности с атопической астмой.
Появление болезни характерно для больных с хроническим воспалением пазух носа. Чаще всего появляется при инфекционных заболеваниях на фоне приема жаропонижающих.
Обычно после приема противопоказанных препаратов группы НПВ возникают следующие симптомы:
- обильные выделения из носа;
- повышенная активность слезных желез;
- прилив крови к коже лица и грудной клетки;
- затруднения дыхания;
- тошнота и рвота;
- боли в области подреберья;
- сильное понижение артериального давления;
Во время изолированного течения заболевания характерно появление приступов удушья через 15-30 минут после принятия противовоспалительных препаратов. Другие проявления практически не наблюдаются.
Для аспириновой триады характерно сочетание симптомов риносинусита (заложенность носовых пазух, выделения из носа, головная боль) с гиперчувствительностью к НПВП (сильная боль в висках, ринорея, обильное слезотечение, приступы чихания), а также тяжелого приступа астмы с дыхательной недостаточностью и развитием астматического статуса.
При различных сочетаниях аспиринового и атопического типа болезни вместе с типичными для триады симптомами появляются признаки аллергии спазмы мускулатуры бронхов, свойственные реакции на бытовые и природные аллергены.
При бронхиальной астме необходимо исключить не только прием НПВП, но и контакт с салицилатами, которые находятся как в продуктах, так и в косметике, средствах гигиены и т. д.
Список групп препаратов, от которых придется отказаться:
- ацетилсалициловая кислота;
- производные фенилуксусной кислоты;
- препараты производные пропионовой кислоты;
- средства производные индолуксусной кислоты;
- производные уксусной кислоты;
- оксикамы;
- анилиды;
- лекарства из группы бутилпиразолидонов.
К нестероидным противовоспалительным препаратам повышенная чувствительность фиксируется у приблизительно 20% пациентов. Эти медикаменты хорошо снимают воспаление, а также снижают температуру, поэтому часто применяются при лечении различных болезней.
При воспалениях и болях, возникших из-за патологических процессов в организме, переломов костей, травм суставов и мышц они практически незаменимы. Поэтому астматикам трудно подобрать лечение. При невозможности отказаться от данной группы препаратов нужно использовать их в комплексе с системными глюкокортикостероидами.
Для лечения заболевания можно использовать антилейкотриеновые вещества, блокирующие активность обезболивающих, вызывающую сужение просвета бронхов.
Одним из методов лечения является выработка толерантности к аспирину. Для этого он малыми порциями регулярно вводится в организм до исчезновения аллергической реакции на определенную концентрацию.
При аспириновой бронхиальной астме можно принимать обезболивающие препараты из других групп, например, частичных агонистов опиоидных рецепторов.
Из НПВС наименее опасен парацетамол. Однако и его следует принимать только под контролем врача.
Бронхиальная астма является одним из наиболее частых хронических заболеваний дыхательных путей. Аспириновая форма отличается нетипичной реакцией на лекарства, содержащие ацетилсалициловую кислоту, и препараты нестероидного противовоспалительного действия.
Принятие противопоказанных средств для снятия боли приводит к затруднениям с дыханием и другим симптомам.
источник
Бронхиальная астма – это одно из хронических заболеваний органов дыхания, также как эмфизема легких и пневмосклероз. Но в отличие от последних, заболевание бронхиальной астмой имеет ярко выраженную наследственную предрасположенность, генетически обусловленную иммунную недостаточность, сенсибилизацию организма и аллергизацию.
В России число больных астмой 5 -7 %, если болен астмой из этого числа один из родителей – могут заболеть до 30% рожденных от них детей, если оба – могут заболеть до 70 % детей.
Во всем мире наблюдается рост числа больных этим заболеванием. Этому способствует ухудшение условий жизни людей, появление ранее не существовавших химических соединений, загрязнение окружающей среды. Смертность от бронхиальной астмы, осложненной астматическим статусом, ежегодно растет.
Общий наркоз при бронхиальной астме существенно повышает риск возникновения осложнений, но в руках опытного анестезиолога всё проходит благополучно. Об особенностях наркоза и анестезии, механизме развития осложнений у таких пациентов мы решили рассказать в этой статье.
Бронхиальная астма характеризуется нарушением механизма дыхания, вследствие:
- сужения дыхательных путей, развивающимся в результате утолщения стенок бронхов и бронхиол;
- отека слизистой оболочки бронхов и бронхиол;
- мышечного спазма и накопления густого, вязкого, плохо отделяемого слизистого секрета.
Перечисленные особенности обуславливают риск проведения общего наркоза у больных астмой.
Перед плановой операцией необходима предоперационная подготовка, улучшающая дренажную функцию легких. Она включает в себя:
- применение антигистаминных преператов (димедрол, супрастин, тавегил и др.,
- гормональных (преднизолон, дексаметазон), бронхолитики, инфузионная терапия.
- на этом фоне максимально возможное уменьшение дозы адреномиметиков, то есть тех аэрозольных препаратов, которые обычно используют больные бронхиальной астмой.
Выбор препаратов и вида наркоза напрямую зависит от исходного состояния пациента.
Врач обращает внимание на следующие параметры:
- давно ли пациент страдает астмой,
- как часто случаются приступы удушья,
- продолжительность приступов,
- чем снимается приступ,
- частота использования адреномиметиков (аэрозольных ингаляторов),
- состояние сердечно сосудистой системы,
- сопутствующие хронические заболевания,
- аллергия на препараты,
- вид и сложность предстоящей операции, её экстренность.
Часто у пациентов с бронхиальной астмой наблюдается в разной степени выраженности, в зависимости от тяжести заболевания, дефицит ОЦК – объема циркулирующей крови. Это связано с потерей жидкости в организме из-за форсированного дыхания во время приступа и применением адреномиметиков. При этом развивается относительная гиповолемия, т.е. организм борется, чтобы обеспечить достаточное кровоснабжение сердца и головного мозга, происходит уменьшение объема сосудистого русла за счет сужения мелких периферических сосудов, этому еще способствуют адреномиметики.
Именно поэтому очень важна предварительная подготовка – инфузионная терапия, т.е. переливание жидкости (физраствора, глюкозы, гормонов — преднизолон или гидрокортизон). В противном случае на вводном наркозе, в ответ на введение препаратов для наркоза, возможно критическое падение давления вплоть до коллапса.
Общий наркоз при астме у хорошо подготовленного анестезиолога не вызывает особых затруднений, если подготовка пациента была проведена правильно и в нужном объёме.
При бронхиальной астме возможны:
- перидуральная или спинальная анестезия,
- внутривенный мононаркоз на 15 — 20 минут на спонтанном дыхании,
- многокомпонентный интубационный наркоз с релаксантами.
При любом виде обезболивания в операционной всегда в «боевой готовности» наркозно – дыхательная аппаратура, следящие системы, контроль газового состава крови, ЭКГ, пульсоксиметр.
Для ознакомления перечислим некоторые препараты, которые используются при работе с пациентам с астмой. Внутривенно чаще всего используется кетамин, реже пропофол. Кетамин имеет бронхорасширяющие свойства, расслабляет бронхи, и как следствие снижает риск возникновения бронхоспазма.
Отличный вариант: севофлюран, аналог севоран. Это средство для ингалационного наркоза, на вводный наркоз и поддержание наркоза. Пациент незаметно и быстро (примерно 2 минуты) засыпает, при этом пробуждение быстрое, без озноба и галлюцинаций. А вот, например, Гексенал и тем более тиопентал натрия противопоказаны. В химической формуле, в составе молекулы тиопентала натрия входит атом серы – Sna, который может вызвать ларинго и бронхо спазм. Можно использовать также фторотан, но «травить» пациента, себя и персонал операционной совсем не хочется, поэтому использование возможно в крайних случаях, когда нет выбора.
В норме у взрослого человека нормального телосложения, без сопутствующих заболеваний, площадь поверхности легких, альвеолярная, где собственно и происходит газообмен т.е. диффузия кислорода из вдыхаемого воздуха в кровь, достигает 100 – 120 м2 . Строение легких напоминает гроздь винограда, альвеолы –виноградины. Чтобы они не спадались в них присутствует вещество — сурфактант!
Я создал этот проект, чтобы простым языком рассказать Вам о наркозе и анестезии. Если Вы получили ответ на вопрос и сайт был полезен Вам, я буду рад поддержке, она поможет дальше развивать проект и компенсировать затраты на его обслуживание.
источник
Астма – одна из главных проблем здравоохранения, уровень распространенности, заболеваемости и смертности которой возрастает [1, 2]. Результаты исследований показывают, что распространенность астмы среди взрослых составляет 11%, среди детей – значительно больше [3, 4]. Эти данные требуют внести изменения в лечение астмы и предотвращение побочных эффектов в анестезиологической практике.
Во избежание развития осложнений во время операции следует хорошо знать патогенез астмы, провести адекватную оценку и коррекцию состояния пациента в предоперационный период, а также обеспечить хорошую медикаментозную и техническую подготовку.
Патогенетическим признаком астмы является уменьшение диаметра дыхательных путей в связи с сокращением гладкой мускулатуры, сосудистым застоем, оте-ком стенки бронха и секрецией вязкой слизи [5]. Хронический воспалительный процесс повреждает ткани и приводит к последующим изменениям. Для характеристики структурных изменений широко используется термин «ремоделирование дыхательных путей» – слущивание эпителия, субэпителиальный фиброз, увеличение количества и объема слизистых клеток в эпителии, гиперплазия и гипертрофия гладкомышечной ткани в дыхательных путях, обильная васкуляризация стенки бронха [6, 7, 8]. Такие изменения во внеклеточном матриксе, гладкомышечной ткани, слизистых железах влияют на функцию дыхательных путей и реактивность пациентов с астмой, проявляются снижением объема форсированного выдоха в 1 сек (FEV1) и бронхиальной гиперреактивностью [9].
Бронхоспазм и обильное выделение слизи закрывают дыхательные пути, делая невозможными вдох и выдох. При сопротивлении появляется положительное давление в альвеолах в конце выдоха, что в свою очередь задерживает воздух и способствует перерастяжению легких и грудной клетки, учащенному дыханию, изменениям функции дыхательных мышц. Закупорка дыхательных путей возникает не всегда, несовпадение объема вентиляции и перфузии вызывает изменение в газовом составе артериальной крови [10, 11].
Определение астмы за последние десять лет изменилось. Сегодня считается, что астма – клинический синдром, который характеризуется воспалительным процессом в дыхательных путях, изменениями в паренхиме легких, закупоркой и гипереактивностью мелких дыхательных путей [12-14].
Проведен поиск литературы по базе данных PubMed (1995-2005) по терминам «закупорка дыхательных путей», «астма», «бронхиальная гиперреактивность», «анестезия» и «анестетики». Просмотрены библиографии оригинальных исследований и симпозиумов, комментарии, дополнительные ссылки. Публикации были оформлены в форме таблиц по виду исследований, 222 статьи отобраны для более тщательного рассмотрения. Большинство статей, которые не использовались в дальнейшем, содержали информацию об анафилактических реакциях, бронхиальной гиперреактивности, бронхоспазме у пациентов без астмы.
Работа анестезиолога в предоперационном периоде начинается с оценки функции легких пациента. Warner и коллеги обнаружили, что частота развития бронхо- и ларингоспазма во время оперативного вмешательства значительно меньше у пациентов с астмой. Они определили три фактора, связанные с возникновением бронхоспазма во время операции: антибронхоспастические препараты, симптоматическое обострение болезни, недавний визит в медицинское учреждение для лечения астмы. В связи с этим были сделаны следующие выводы:
- у пациентов с астмой без характерных выраженных симптомов низкий уровень риска развития осложнений при анестезии;
- у пациентов с проявлениями астмы – более высокий риск;
- неблагоприятные последствия после перенесенного бронхоспазма возникают у пациентов без астмы [16].
Подготовка пациента с астмой должна включать в себя детализированный сбор информации о повышенной реактивности дыхательных путей:
- инфекции верхних дыхательных путей;
- аллергии;
- возможные предрасполагающие факторы развития астмы;
- использование медикаментов, которые могут вызвать или предотвратить приступ;
- диспноэ ночью или рано утром.
В дальнейшем для определения реактивности бронхов у больных выясняли, есть ли у них реакция на холодный воздух, пыль, дым, проводилась ли эндотрахеальная интубация при общем наркозе [17]. Наличие в анамнезе аст-матического статуса с необходимостью интубации осложняет ведение пациента [10].
Некоторые препараты могут инициировать острые приступы астмы, поэтому очень важно распознать сужение бронхов, поскольку даже селективные антагонисты β1-адренорецепторов вызывают обструкцию дыхательных путей [5].
Триада – бронхиальная астма, полипоз носа и непереносимость аспирина – объединены терминами «астма, индуцированная аспирином» и «синдром Самтера». У таких пациентов наблюдаются перекрестная чувствительность к нестероидным противовоспалительным препаратам, которые могут быть причиной острого бронхоспазма, и другие реакции, поэтому их следует направлять в аллергологическое отделение для определения непереносимости или наличия перекрестной чувствительности к анестетикам [18].
При объективном обследовании легких может не наблюдаться никаких патологических изменений, выслушиваться стерторозное дыхание или другие дополнительные шумы. Наличие стерторозного дыхания перед операцией может значительно осложнить ее течение. Если у пациента отягощенная история болезни (наличие острых приступов астмы в анамнезе), обнаружено стерторозное дыхание при первичном обследовании, необходимо обратиться за консультацией к пульмонологу. При активной астме следует провести лабораторные исследования (газовый состав артериальной крови) и исследования функций легких, для того чтобы определить степень повреждения дыхательной системы [19]. Предоперационная спирометрия – простой способ оценить наличие и серьезность закупорки дыхательных путей и реакцию бронхиального дерева на проводимую бронхорасширяющую терапию. Увеличение на 15% форсированного объема выдоха в 1 сек считается клинически значимым [20]. Рентгенограмма грудной клетки даже при острых приступах астмы зачастую не показывает никаких нарушений [17].
Пациентам с обратимой обструкцией дыхательных путей и повышенной бронхиальной реактивностью перед операцией следует назначить агонисты β2-адренорецепторов, ослабляющие рефлекторную бронхоконстрикцию при эндотрахеальной интубации, и кортикостероиды, однако даже при этих назначениях могут появиться бронхоконстрикция и стерторозное дыхание [17, 21, 22].
Комбинированное назначение кортикостероидов и агонистов β2-адренорецепторов улучшает функцию легких, уменьшает риск возникновения стерторозного дыхания после эндотрахеальной интубации [21, 23]. Предположение о том, что назначение кортикостероидов в предоперационный период вызывает инфицирование раны и длительное заживление, не нашло подтверждения в исследованиях. В них продемонстрировано, что у данных пациентов при назначении кортикостероидов снижается риск развития послеоперационных осложнений [24]. Кортикостероиды метилпреднизолон 40 мг/сут перорально и сальбутамол уменьшают бронхоконстрикцию, вызванную интубацией, у пациентов с обратимой обструкцией дыхательных путей и отягощенным анамнезом [17, 21].
Согласно Enright при предоперационной подготовке пациентов с астмой следует иметь ввиду следующее.
источник
Из этой статьи Вы узнаете:
- анестезия в стоматологии – препараты,
- лучшая анестезия при лечении зубов,
- анестезия зубов при беременности и грудном вскармливании.
Статья написана хирургом-стоматологом со стажем более 19 лет.
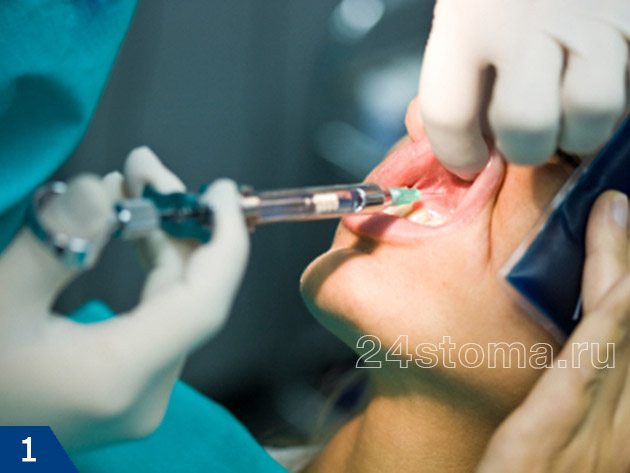
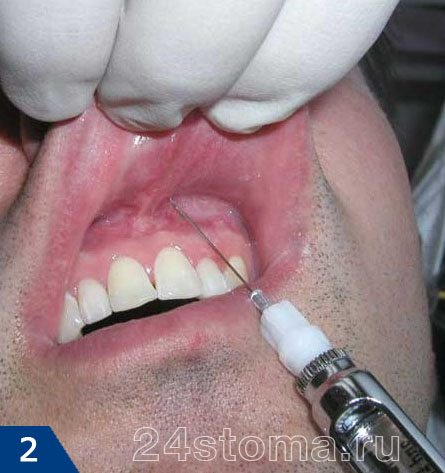
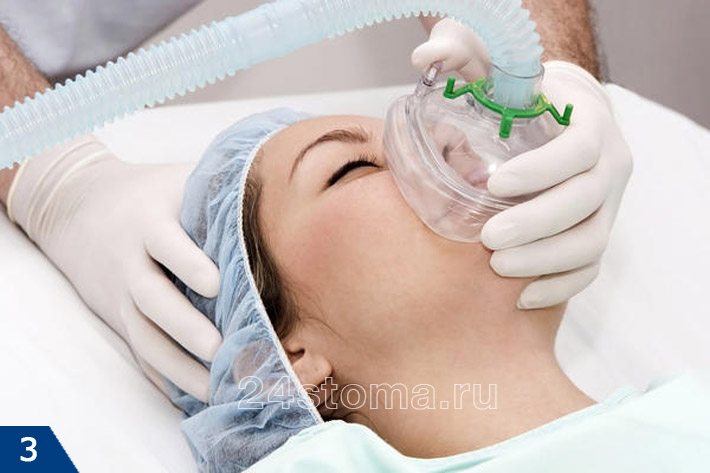
Анестезия в стоматологии бывает местной и общей. Местная анестезия – это когда обезболивается только та область, где планируется вмешательство, а пациент при этом пациент находится в сознании (рис.1-2). А вот общая анестезия в стоматологии или другими словами общий наркоз – проводится при помощи наркотических анальгетиков, вводимых в организм больного ингаляционно (рис.3) или внутривенно. При общем наркозе сознание у пациента выключается.
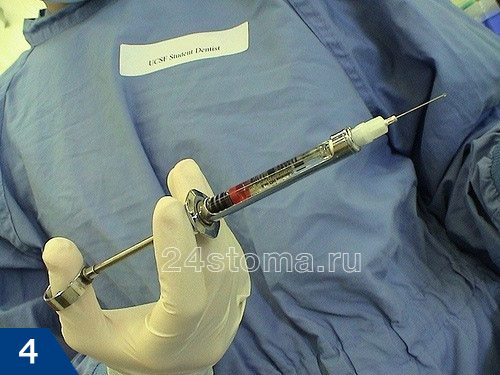
Для проведения местной анестезии сейчас используются карпульные шприцы и карпулы, в которые заключен раствор анестетика (рис.4-5). Качество проведения анестезии таким шприцом значительно выше, чем обычным одноразовым шприцем. Кроме того, иглы для карпульной анестезии во много раз тоньше, чем у обычных одноразовых шприцов (рис.6), а это значит, что укол будет не таким болезненным.
Стоимость анестетиков и анестезии –
себестоимость одной карпулы анестетика (будь то ультракаин, убистезин, септанест или другие) составляет около 30 рублей. Стоимость одной анестезии в стоматологической клинике составит в среднем 250 рублей.
Действительно, укол анестетика может быть болезненным. Болезненность будет зависеть как от порога болевой чувствительности самого пациента, так и от техники проведения анестезии врачом. По правилам одну карпулу анестетика (1,7 мл) нужно вводить в течении 40-45 секунд. Если же врач экономит время и вводит анестетик быстро, то логично, что это вызовет боль.

Препараты для снятия страха и тревожности –
также существуют препараты, которые позволяют уменьшить страх и тревогу перед предстоящим походом к стоматологу. Из безрецептурных препаратов можно выделить препарат Афобазол, который особенно удобен для тех, кому нужно совершить несколько походов к стоматологу, т.к. это препарат пьется курсом (1 упаковка на 20 дней). Препарат обладает хорошим успокаивающим/ противотревожным действием, но при этом он не вызывает сонливости. Начинать пить Афобазол нужно за 5-7 дней до визита к стоматологу – в этом случае эффект препарата будет выше.
Также можно воспользоваться настойками валерианы, пустырника, корвалолом, валокардином. Однако принимать эти препараты также желательно курсом, начиная за несколько дней до визита к врачу. Плюс эти препараты помимо успокоительного эффекта обладают снотворным эффектом, что не очень хорошо для автомобилистов и работающих людей.
Наиболее современными считаются анестетики на основе Артикаина. Это действующее вещество использовано в таких анестетиках, как Ультракаин, Убистезин, Септанест и других. Анестетики артикаинового ряда превосходят по эффективности Лидокаин – в 1,5-2 раза, а Новокаин – в 5-6 раз.
Большим плюсом анестетиков на основе артикаина является и то, что они действуют и тогда, когда нужно обезболить область воспаления. Ведь при гнойном воспалении новокаин вообще практически перестает действовать, а активность лидокаина заметно снижается.
Большинство анестетиков помимо основного обезболивающего компонента (например, артикаина) также содержат сосудо-суживающие вещества, например, адреналин или эпинефрин. Последние компоненты за счет сужения сосудов в очаге инъекции позволяют уменьшить вымывание анестетика, а это приводит к увеличению силы и продолжительности анестезии.
1. Ультракаин –
Ультракаин выпускается французской компанией «Санофи Авентис» в 3-х возможных вариантах, которые будут отличаться наличием/отсутствием эпинефрина в составе, а также его концентрацией:
-
«ультракаин ДС форте» – с концентрацией эпинефрина 1:100.000,
- «ультракаин ДС» – с концентрацией эпинефрина 1:200.000,
- «ультракаин Д» – без эпинефрина, без консервантов.
Этому самому популярному анестетику посвящена отдельная статья: «Ультракаин – особенности применения, инструкция производителя»
Подробное описание анестетика и его показания к применению читайте тут:
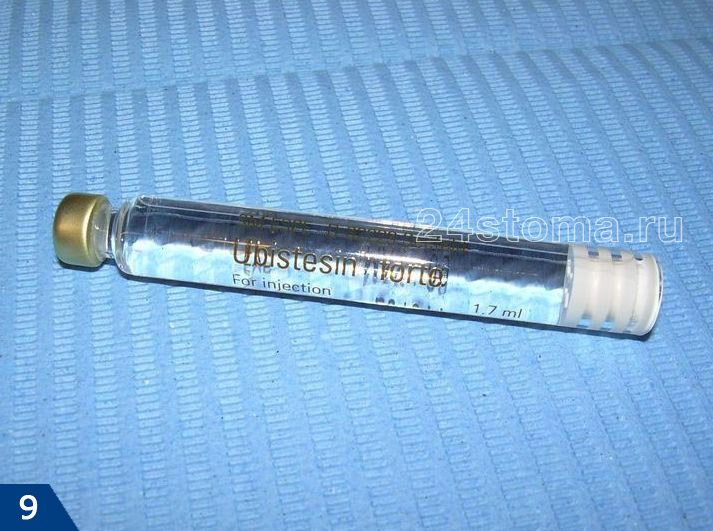
→ «Убистезин форте – инструкция по применению»
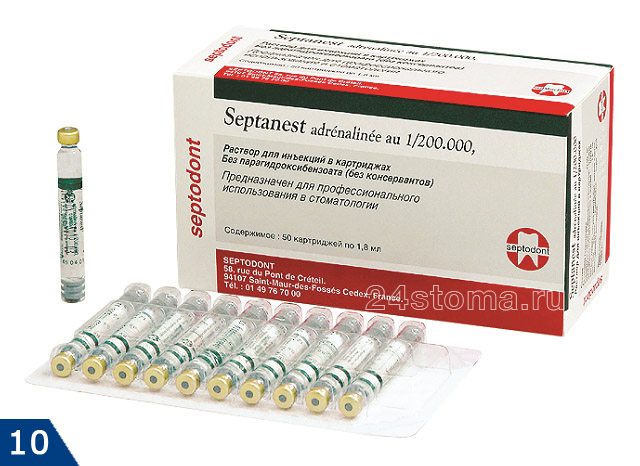
(в отличие Ультракаина и Убистезина) имеет в составе большее количество консервантов (и натрияметабисульфит, и ЭДТА), которые обладают мощным аллергизирующим действием.
Подробное описание анестетика и его показания к применению читайте тут:
→ «Септанест 1:100000 – инструкция по применению»
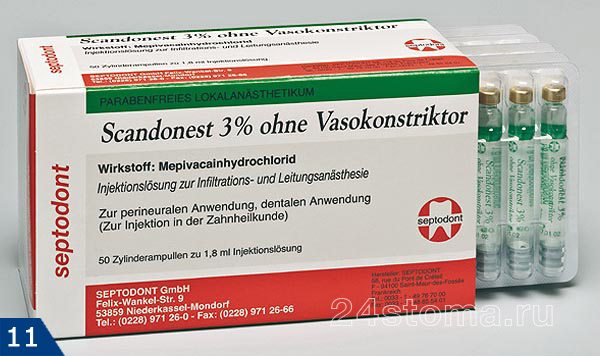
Подробное описание анестетика и показания к применению читайте тут:
→ «Скандонест – инструкция по применению»
- Если у Вас бронхиальная астма или очень высокая аллергичность –
здесь нужен анестетик без консервантов (обычно в анестетиках используется дисульфит натрия, который нужен для стабилизации эпинефрина или адреналина). Поэтому лучше всего таким пациентам подойдет анестетик «Ультракаин Д», который совсем не содержит консервантов.
- Если у вас есть заболевания щитовидной железы, сахарный диабет –
в этом случае Вам также нежелательно использовать анестетики, содержащие сосудо-суживающие компоненты – адреналин, эпинефрин. Препарат выбора, например, «Ультракаин Д», «Скандонест» или «Мепивастезин». Но, выбирая между этими тремя анестетиками, я бы отдал предпочтение первому.
- Если у вас повышенное давление и заболевание сердца –
при умеренной гипертонической болезни и компенсированных заболеваниях сердца оптимальный выбор – это анестетики, содержащие концентрацию эпинефрина (адреналина) – 1:200000. Это может быть анестетики «Ультракаин ДС» или «Убистезин 1:200000».При выраженной гипертонической болезни, декомпенсированных заболеваниях сердца – необходимо применять анестетики, которые полностью не содержат адреналина и эпинефрина. Подойдет тогда, например, «Ультракаин Д».
- Если вы здоровый человек –
если у вас нет вышеперечисленных заболеваний, то вам можно смело ставить анестетики с содержанием эпинефрина/адреналина в концентрации 1:100000. Причем человеку весом около 70 кг можно поставить до семи карпул анестетика включительно. Примером таких анестетиков может служить «Ультракаин ДС форте», «Убистезин форте» и аналоги.
Важно : но хорошее обезболивание перед вмешательством это только половина дела, ведь после лечения зубы частенько болят. О том, какие препараты лучше всего позволяют обезболить в домашних условиях – читайте в статье:
→ «Лучшие анальгетики от зубной боли»
Оптимальным выбором для проведения стоматологических вмешательств при беременности, а также при грудном вскармливании – является «Ультракаин DS» (с содержанием эпинефрина 1:200000), либо «Убистезин 1:200000». Убистезин при беременности настолько же безопасен как и ультракаин. Концентрация эпинефрина 1:200000, которая присутствует в этих анестетиках не влияет на плод, не проникает через плаценту, а также не определяется в грудном молоке.
Полностью отказаться от содержания адреналина в анестетике у беременных и кормящих пациенток ни в коем случае нельзя, т.к. адреналин сужает сосуды в области инъекции и следовательно замедляет всасывание самого анестетика в кровь, а это в свою очередь приводит к заметному снижению концентрации анестетика в крови. А вот чем выше будет концентрация анестетика в крови, тем больше шансов у анестетика проникнуть через плаценту.
Некоторые врачи используют для обезболивания у беременных анестетики Скандонест или Мепивастезин (они не содержат ни адреналина, ни эпинефрина). Однако, как Вы уже поняли – применять такие анестетики у беременных и кормящих нежелательно, т.к. из-за отсутствия сосудосуживающего компонента они всасываются в кровь очень быстро, а это означает, что в крови будет высокая концентрация анестетика, которая позволит препарату проникнуть через плаценту. Кроме того и Скандонест, и Мепивастезин по токсичности превышает новокаин в 2 раза.
Автор: стоматолог Каменских К.В., стаж 19 лет.
источник
К наиболее частым хроническим заболеваниям дыхательных путей относятся обструктивные заболевания. В последние годы число больных с данной патологией увеличивается.
К обструктивным заболеваниями дыхательных путей относятся в основном хронический обструктивный бронхит и эмфизема легких, которые объединены в группу ХОБЛ (COPD — Chronic Obstructive Pulmonary Disease), а также бронхиальная астма.
Бронхиальная астма — хроническое воспалительное заболевание дыхательных путей, характеризующееся гиперреактивностью и вариабельной (обратимой) обструкцией дыхательных путей. Различают две формы — аллергическую и не аллергическую (эндогенная).
Бронхиальная астма одно из наиболее частых хронических заболеваний, ее распространенность в последние 10-летия увеличилась и достигла максимальной величины в Новой Зеландии (15,1%). В Германии наибольшая распространенность в детском возрасте — 10%, a в зрелом возрасте — 5%.
Как правило, хроническое воспаление слизистой оболочки бронхов поддерживает гиперреактивность, поэтому лечение воспалительного процесса имеет основное значение в терапии. При анестезии большую роль играет профилактика и лечение рефлекторного сужения бронхов, триггером которого является в первую очередь эндотрахеальная интубация.
Для ХОБЛ характерно сочетание хронического кашля, гиперпродукции мокроты, одышки с обструкцией дыхательных путей и нарушением газообмена. Применение бронхолитиков и кортикостероидов не устраняет полностью обструкцию дыхательных путей. ХОБЛ может проявляться в виде хронического бронхита, эмфиземы легких и смешанной формы.
Согласно критериям ВОЗ, хронический бронхит устанавливают при кашле с мокротой, длящемся более 3 мес. и повторением этих периодов не менее 2 лет подряд. При хроническом обструктивном бронхите имеется постоянная обструкция дыхательных путей. При эмфиземе легких происходит необратимое расширение и разрушение мелких дыхательных путей.
Заболеваемость ХОБЛ ориентировочно составляет 10—15% взрослого населения. Во всем мире ХОБЛ является 4-й причиной смерти с тенденцией к увеличению. При анестезии проблемами являются, с одной стороны, рефлекторное сужение бронхов, как при бронхиальной астме, с другой — опасность послеоперационных осложнений со стороны легких.
Различают 2 механизма обструкции дыхательных путей: активный и пассивный. Активный механизм — спазм гладкой мускулатуры бронхов, который может быть вызван гуморально через медиаторы (аллергическая реакция) или стимуляцией нейрона в виде рефлекторного сужения бронхов при их гиперреактивности.
Длительное протекание болезни ведет к гипертрофии гладких мышц и при соответствующей стимуляции к усилению обструкции. Это сужение может в сочетании с отеком привести к полному закрытию крупных бронхов, которые не восстанавливаются при ИВЛ с положительным давлением. После введения бронхолитиков обструкция может полностью пройти и больные вне приступа при обследовании функции легких имеют нормальные показатели внешнего дыхания.
Пассивный механизм включает потерю эластичности паренхимы легких в результате хронического воспаления. Последнее чаще всего вызывается и поддерживается многолетним курением. При обследовании функции легких особенно обращает на себя внимание снижение объема форсированного выдоха за 1-ю секунду (ОФB1) — проявление нестабильности бронхов в результате их сдавления повышенным внутригрудным давлением. Плетизмография при поверхностном учащенном дыхании, где сила выдоха снижена, показывает меньшее сопротивление дыхательных путей.
Учитывая, что эти механизмы не связаны с сокращением мышц выдоха, небольшое сопротивление последнему может уменьшить обструкцию. Поэтому у многих больных при задержке выдоха губами внутрилегочное давление повышается, что ведет к улучшению состояния.
В далеко зашедших случаях часто при искусственно созданном положительном давлении (инвазивная и неинвазивная вентиляция) можно добиться значительного улучшения газообмена. Во время общей анестезии при ИВЛ газообмен мало нарушен и управляемое дыхание обычно эффективно.
Основные жалобы в послеоперационном периоде возникают при затрудненном откашливании секрета. Это может привести к задержке слизи, обострению ХОБЛ и развитию пневмонии. Эти 2 механизма могут сочетаться: у больных с бронхиальной астмой превалирует активный, легко поддающийся фармакотерапии механизм, в то время как при ХОБЛ превалирует пассивный механизм, плохо поддающийся коррекции в связи с необратимыми изменениями паренхимы легких.
- Анамнез (частота и степень выраженности приступов одышки, лечение, сопутствующие заболевания).
- Клиническое обследование.
- Исследование функции легких: спирометрия (жизненная емкость легких, ОФВ1, реакция обструкции на введение β2-симпатомиметика, например, сальбутамола), тотальная плетизмография (Raw, FRC, TCL), анализ газового состава крови.
- Рентген легких в двух плоскостях.
- Выяснение нагрузки правых отделов сердца (ЭКГ, эхокардиография).
Примечание. Raw — измерение сопротивления дыхательных путей, FRC — функциональная остаточная емкость, TLC — общая емкость легких.
Для оценки риска анестезии и определения тактики ведения этих больных основными являются сбор анамнеза, осмотр и аускультация легких. Необходимо учесть субъективное состояние, вопрос о переносимости физической нагрузки, прием лекарственных средств, когда был последний приступ бронхиальной астмы или последнее обострение ХОБЛ, частоту острой инфекции и были ли ранее наркозы. Кроме этого, надо уточнить тяжесть дыхательной недостаточности при приступе, была ли необходимость в интенсивной терапии и какие лекарственные препараты в этой ситуации были эффективны.
Дальнейшее обследование зависит как от субъективных жалоб, анамнеза предыдущего наркоза, так и от объема планового оперативного вмешательства. При первичном осмотре пациента с бронхиальной астмой, у которого нет приступов удушья, субъективных жалоб, с нормальными аускультативными данными нет необходимости в дальнейшем диагностическом обследовании. То же самое относится к больным с ХОБЛ в стабильном состоянии без признаков инфекции.
При выраженной бронхиальной реактивности до вводного наркоза применяют β2-симпатомиметики, при необходимости, лидокаин внутривенно.
Больным с жалобами на одышку, одышку при нагрузке и/или увеличение количества мокроты, а также с аускультативными изменениями необходимо исследование функции легких с включением теста реакции на бронхолитик для контроля реверсивности. Этот тест состоит в ингаляции β2-симпатомиметика с последующим контролем эффекта.
Надо также провести анализ газового состава крови из артерии или из разогретой мочки уха — для выявления гиперкапнии. В зависимости от степени компенсации респираторного ацидоза можно дифференцировать хроническую или острую форму глобальной дыхательной недостаточности.
Перед большими операциями больному с ХОБЛ необходимо провести рентгенологическое обследование легких в двух проекциях с документированием данных для исключения свежих инфильтратов. У больных с бронхиальной астмой рентгенологическое обследование легких имеет смысл только в исключительных случаях, так как даже при тяжелых приступах астмы на снимке редко видны патологические изменения.
При выраженных жалобах с одышкой в покое или при незначительной физической нагрузке (подъем меньше, чем на один этаж) показаны лечение до операции и расширенная диагностика. Возможно, необходимы эхокардиография, расширенный анализ крови (например, натрийдиуретический пептид), a также ультразвуковое исследование для определения наличия плеврального выпота. В некоторых случаях показана компьютерная томография грудной клетки для уточнения неясных изменений в легких.
При выраженной одышке необходимо провести дифференциальную диагностику с почечной и сердечной патологией, исключить анемию (возможно связанную с опухолью).
Для улучшения функции легких при обоих заболеваниях необходимо выполнять общие рекомендации для лечения астмы и ХОБЛ. При обострениях ХОБЛ рекомендуется антибактериальная терапия после определения чувствительности возбудителя к антибиотикам. Плановые операции должны быть отложены до успешной терапии острой ситуации.
При обратимой обструкции (это означает наличие эффекта в острой ситуации на введение β2-симпатомиметика) отмечено, что число приступов после интубации уменьшается, если предварительно (за 2—3 дня) комбинировать β2- симпатомиметик с приемом преднизолона по 20 мг 2 раза в день per os. Эффект лечения должен быть подтвержден перед операцией контрольными обследованиями.
В основном при планировании анестезиологического пособия стоит вопрос: можно ли провести операцию под общей или регионарной анестезией, предпочтение должно быть отдано последней.
Чем тяжелее выражено заболевание, тем больше надо избегать раздражения дыхательных путей интубацией. Если нельзя исключить общего обезболивания, его лучше проводить с помощью ларингеальной маски, что вызывает меньшее раздражение и меньшую опасность бронхоспазма.
Если эндотрахеальная интубация неизбежна при обширной операции в брюшной полости, то комбинация общей анестезии с торакальной эпидуральной анестезией улучшает течение послеоперационного периода. Дополнительная эпидуральная анестезия позволяет почти исключить введение миорелаксантов и систематическое введение опиатов во время операции. Это способствует быстрому восстановлению дыхания после операции, а непрерывное обезболивание через эпидуральный катетер по типу «fast-track» с интенсивной дыхательной терапией приводит к более ранней активизации пациента.
Основным осложнением общей анестезии у больных бронхиальной астмой является рефлекторный спазм бронхов, который может усилиться за счет образования вязкого секрета. Этот спазм обычно устраняется в течение короткого времени после экстубации. У больных с ХОБЛ основное осложнение, кроме рефлекторного бронхоспазма, является задержка секрета и развитие ателектазов, которые могут в течение нескольких дней привести к пневмонии и гипоксемии. У больных с тяжелой стадией ХОБЛ послеоперационные легочные осложнения увеличивают летальность.
У больных с бронхиальной астмой и больных с ХОБЛ в хорошем физическом состоянии нет ограничения или особых рекомендаций для медикаментозной премедикации, можно использовать все стандартные препараты, включая бензодиазепины.
При прогрессирующей стадии ХОБЛ и респираторной глобальной недостаточности надо избегать препаратов, которые вызывают угнетение дыхания. В качестве альтернативы можно применить прометацин (25—50 мг) или клонидин (150 мг) перорально.
Ингаляционные анестетики вызывают бронходилатацию и после того, как предыдущие препараты оказались неэффективными, успешно применяются при тяжелом астматическом статусе как крайнее средство. Механизм действия включает проникновение кальция в клетку гладкой мускулатуры и через блокаду прохождения импульса в нервную клетку происходит центральное расслабления бронхоспазма через стимуляцию ГАМК-рецепторов.
Самый эффективный препарат при этом галотан. Эти эффекты дают по убывании значений севофлюран, изофлюран и энфлюран. Десфлюран также расслабляет гладкую мускулатуру бронхов, но прежде всего он раздражает нервные окончания слизистой оболочки бронхов. Это может привести к бронхоспазму, кашлю и увеличению выделения секрета. Поэтому десфлюран не рекомендуется больным с бронхиальной астмой.
Пропофол — это гипнотик для внутривенного введения, который обладает свойствами бронхолитика. Эффект пропофола главным образом центральный, передается через стимуляцию ГАМК-рецепторов. Показано преимущество пропофола для вводной анестезии по сравнению с барбитуратами и этомидатом у больных с повышенной бронхиальной реактивностью.
Из этого вытекает, что пропофол может применяться как гипнотик для эндотрахеальной интубации, внутривенной анестезии и седативной терапии у больных с бронхиальной астмой и ХОБЛ при ИВЛ. Очень важна при этом достаточная глубина анестезии, так как поверхностный наркоз может привести к рефлекторной бронхоконстрикции.
Кетамин — еще один анестетик с доказанным бронходилатирующим эффектом, который применим для интубации и седации у интубированных больных. Кетамин был первоначально изготовлен как рацемат из двух стереоизомеров. После разделения стереоизомеров было выявлено, что нежелательные эффекты рацемата (кошмарные сны и галлюцинации) вызваны R-изомером. В настоящее время изготавливается левовращающийся стереоизомер, который уменьшает побочные явления и является более сильным анальгетиком, чем рацемат. Но его бронхорасширяющее действие у пациентов с бронхиальной гиперреактивностью сомнительно.
Дексмедетомидин – селективный а2-агонист, применяется преимущественно как седативное средство в хирургии и интенсивной терапии. Возможно, он способен значительно уменьшить рефлекторную бронхоконстрикцию и будет иметь значение при отвыкании от ИВЛ у больных с ХОБЛ. Описан ряд случаев лечения больных с высоким риском бронхоспазма, у которых был успешно применен дексмедетомидин.
Тонус дыхательных путей регулируется стимуляцией мускариновых рецепторов, которые стимулируются также ацетилхолином. Стимуляция мускариновых M1- и М3- рецепторов вызывает бронхоконстрикцию, в то время как М2-рецепторы блокируют дальнейшее освобождение ацетилхолина. Различные недеполяризующие миорелаксанты имеют сродство к различным мускариновым рецепторам.
Миорелаксанты, которые большей частью блокируют М1 и М3-рецепторы и небольшую часть М2-рецепторов, не оказывают воздействия на бронхиальное сопротивление и могут быть применены для анестезии у больных с обструктивными заболеваниями дыхательных путей.
В интенсивной терапии комбинация миорелаксантов и стероидов часто ведет к длительной полинейропатии и миопатии со стойкой мышечной слабостью. Поэтому больным с обструктивными заболеваниями дыхательных путей в отделении интенсивной терапии противопоказано систематическое введение миорелаксантов, имеющих высокое сродством к М2-рецепторами (рапакурониум, галламин), поскольку они могут их блокировать и вызывать бронхоспазм.
В целом у больных с обструктивными заболеваниями дыхательных путей вполне возможно применение миорелаксантов. Тем не менее у больных с ХОБЛ и «пассивным обструктивным механизмом» большую роль играет проблема задержки секрета и ограниченная способность его откашлять. Поэтому надо обратить внимание на полное устранение миорелаксации до экстубации. «Остаточная релаксация» значительно повышает опасность аспирации, которая представляет большой риск у пациентов с ХОБЛ.
Опиаты — основные компоненты общей анестезии. Если предотвратить опасность ригидности грудной клетки при болюсном введении альфентанила, суфентанила и ремифентанила, то нет никаких противопоказаний для опиатов у больных с обструктивными заболеваниями дыхательных путей.
Для углубления анестезии и хорошей послеоперационной анальгезии предпочтительно применение опиатов. Учитывая, что введение морфина в высоких дозах у некоторых пациентов может привести к выбросу гистамина, необходимо переключиться на другие опиаты или вводить морфин инфузионно в течение нескольких минут.
Для послеоперационной анальгезии у больных с нарушенной функцией центральной регуляции дыхания, т. е. у больных с обструктивным синдромом апноэ во сне или у больных с ХОБЛ и глобальной дыхательной недостаточностью, опиаты должны применяться с осторожностью или надо перейти на неопиоидные анальгетики (так называемые периферические анальгетики) или на регионарную анестезию.
Дифференциальная диагностика диспноэ: сердечный отек легких, эмболия легочной артерии, пневмония, пневмоторакс, аспирация инородного тела, неврогенный отек, эпиглоттит, анемия, ингаляционная травма, психогенная гипервентиляция.
Местный анестетик лидокаин отчетливо снижает бронхиальную реактивность, особенно в комбинации с β2-симпатомиметиками. Этот эффект можно объяснить частичной блокадой проведения парасимпатического импульса, что может быть использовано не только как профилактическая защита от стимуляции, но и как терапевтическое средство при стимуляции гиперреактивной бронхиальной системы (эндобронхиальная интубация у больных бронхиальной астмой).
Учитывая, что побочные действия лидокаина коренным образом отличаются от β2-симпатомиметика и не усиливают их, лидокаин можно применять в тяжелых случаях как дополнительную терапию. Применение лидокаина эндобронхиально особенно рекомендуется, когда надо избежать рефлекторного бронхоспазма на интубацию трахеи или при переводе на самостоятельное дыхание перед экстубацией.
Показано, что эндотрахеальная интубация у бодрствующего обследуемого с бронхиальной астмой ведет к снижению ОФВ1 больше чем на 50%. При введении лидокаина и сальбутамола ОФВ1 снижается только на 20%. Длительность действия лидокаина от 30 до 45 мин.
Предупреждение и лечение бронхоспазма может быть достигнуто и при комбинации общего обезболивания с регионарной анестезией лидокаином, а также при эпидуральной анестезии этим препаратом. Лидокаин разрешен для внутривенного введения, поэтому при вводной анестезии больным с обструктивными заболеваниями дыхательных путей до интубации можно ввести лидокаин в дозе 1,5— 2 мг на кг массы тела.
Регионарная анестезия исключает раздражение дыхательных путей эндобронхиальной трубкой. Поэтому при применении спинальной или эпидуральной анестезии, как и при применении периферических нервных блокад, меньше дыхательных осложнений, чем при общем обезболивании.
Однако имеется одно исключение: при надключичной блокаде нервного сплетения неизбежно ограничение силы диафрагмы до ее полной блокады (диафрагмальный нерв относится к сплетению и даже при низкодозированной блокаде тоже блокируется). Поэтому у больных с далеко зашедшей стадией ХОБЛ не надо использовать надключичную блокаду или очень строго контролировать дыхание. У астматиков вне приступов этой опасности нет, потому что здоровая противоположная сторона гарантирует достаточное обеспечение легочной вентиляции.
В последние 20 лет широко применяется торакальная эпидуральная анестезии (ТЭА) не только как самостоятельный метод, но и в комбинации с общей анестезией, особенно при обширных абдоминальных операциях в урологии и онкологической гинекологии.
Это позволяет уменьшить введение анестетиков и миорелаксантов во время операции и обеспечивает хорошую анальгезию в послеоперационном периоде, способствует быстрому восстановлению работы желудочно-кишечного тракта. ТЭА проводят введением 0,5% бупивакаина.
Однако у больных с обструктивными заболеваниями дыхательных путей существуют некоторые опасности: ТЭА при распространении блокады до цервикальных корешков (CII—IV) может вызывать ослабление диафрагмы. Высокая торакальная и цервикальная ПДА с более низкой концентрацией, которую используют для послеоперационной анальгезии, представляет меньше опасности.
Считается также, что ТЭА может привести к усилению бронхиальной обструкции за счет симпатической блокады. Бронхиальный тонус регулируется симпатической нервной системой через стимуляцию β2-рецепторов. Эти рецепторы в отличие от β1-рецепторов, которые стимулируются непосредственно симпатическими нервными волокнами, стимулируются только гуморально, т.е. катехоламинами. Блокада симпатической нервной системы в области бронхов не ведет к увеличению бронхиального тонуса и реактивности; более того, местные анестетики через системный эффект ведут к уменьшению реактивности.
В целом установлено, что у больных с обструктивными заболеваниями дыхательных путей применение ТПДА приводит к значительному уменьшению послеоперационных респираторных осложнений.
Если во время общей анестезии у больного с обструктивным заболеванием дыхательных путей ухудшаются условия ИВЛ, причиной может быть бронхоспазм, связанный с увеличением бронхиального тонуса.
Этот диагноз необходимо подтвердить до начала терапии, исключив перегиб дыхательных трубок (включая эндотрахеальную трубку), монобронхиальную интубацию, обтурацию просвета бронха слизью, аспирацию инородного тела, высокое внутрибрюшное давление, синдром сдавления средостения, а также пневмоторакс и отек легких.
Если другие диагнозы исключены, снижается SpO2 и/или нарастает PetCO2, надо начать противообструктивную медикаментозную терапию.
- Перегиб дыхательных трубок (включая эндотрахеальный тубус)
- Односторонняя интубация
- Mucus Plugging (непроходимость просвета слизью)
- Аспирация инородным телом
- Высокое внутриабдоминальное давление (лапароскопия) Синдром сдавливания средостения
Независимо от формы обструктивного заболевания дыхательных путей для лечения бронхоспазма рекомендуется начинать с ингаляционных β2-симпатомиметиков. Вначале рекомендуется минимум 2—4 нажатия (200 мкг) сальбутамола или аналогичного β2-симпатомиметика и дальше в зависимости от предыдущего эффекта, каждые 10 мин 2 нажатия.
Важно, чтобы подача аэрозоля проводилась во время вдоха. У маленьких детей и у больных, которые не в состоянии провести контролируемую ингаляцию, преимуществом пользуется внутривенное введение (например, тербутамин 2 мг на 50 мл физиологического раствора через перфузор в зависимости от эффекта).
Во всех остальных случаях внутривенное применение не эффективнее, чем ингаляционное, но увеличивает число осложнений в основном со стороны сердца. К ним относятся: тахикардия, нарушение ритма сердца и гипокалиемия, зависящие от сопутствующих заболеваний пациента. В целом важен не одноразовый прием высшей дозы, а соответственно повторное введение, которое с учетом предыдущего эффекта дает возможность более глубокого распределения аэрозоля.
Глюкокортикоиды не только оказывают непосредственное воздействие на гладкомышечные клетки, но также повышают чувствительность β2- и М2-рецепторов. Они также оказывают влияние на регуляцию генной экспрессии для образования воспалительных цитокинов, уменьшают миграцию и активирование лейкоцитов и тучных клеток, препятствуют высвобождению медиаторов, уменьшают проницаемость сосудов и рефлекторную бронхоконстрикцию.
Систематическое введение глюкокортикоидов рекомендуется как первоначальная терапия у больных с приступом бронхиальной астмы и при обострении ХОБЛ. Уменьшение одышки ожидается не раньше, чем через 30—60 мин после введения. Чем раньше начато систематическое введение препаратов кортизона, тем больше эффект. Максимальный эффект возникает в течение первых 6 ч.
Рекомендуемая доза 0,5—1,0 мг/кг метилпреднизолона каждые 6 ч. Пока нет сомнений в резорбции активного вещества, нет никаких преимуществ парентерального введения по сравнению с пероральным. При остром приступе бронхиальной астмы введение 500 мг метилпреднизолона в сравнении со 100 мг не имеет никакого преимущества.
Теофиллин применяется как бронхолитик более 50 лет, но при обострении ХОБЛ он вызывает нежелательную стимуляцию дыхания; его комбинация с β2-симпатомиметиками увеличивает побочные действия со стороны сердца и поэтому его применение не рекомендуется.
- Углубление наркоза пропофолом или ингаляционными анестетиками
- Увеличение концентрации кислорода во вдыхаемом воздухе (в зависимости от сатурации артериальной крови, измеренная с помощью пульсоксиметрии)
- Короткодействующие β2-агонисты (например, сальбутамол) 4—8 доз нажатия и повторять каждые 10 мин 2 дозы (с учетом частоты сердечных сокращений), в случае если нет доступа к тубусу, внутривенное введение в зависимости от эффекта
- Глюкокортикоиды (метилпреднизолон) 1—2 мг/кг внутривенно
- Парасимпатолитики (ипратропиума бромид) 6 доз нажатия, затем 2 дозы каждые 10 мин
- Сульфат магния 2—4 г внутривенно (осторожно падение давления усиление мышечной релаксации)
- Лидокаин 1,5—2 мг/кг внутривенно
Влияние вагуса является важным компонентом рефлекторной дуги, оно осуществляется через 3 различных мускариновых рецептора М1, М2 и М3 рецепторы. M1 и М3 способствуют бронхоспазму, в то время как М2-рецепторы его ограничивают. Вирусная инфекция дыхательных путей может, например, привести к дисфункции М2-рецепторов и этим временно (приблизительно в течение 4 нед.) привести к имеющей клиническое значение бронхиальной гиперреактивности.
Антимускариновые вещества (атропин и ипратропиума бромид) блокируют мускариновые рецепторы неселективно и при большей дозировке блокируют все 3 рецептора, содействуя выраженной бронходилатации. Однако в низкой дозе они могут вызывать блокаду преимущественно М2-рецепторов и парадоксальный бронхоспазм. Поэтому при остром приступе важна высокая дозировка.
Для ипратропиума бромида рекомендуется начинать минимум с 4—8 доз-нажатий. Учитывая, что ипратропиума бромид очень мало резорбируется, при высокой дозе в острой ситуации побочные явления не возникают. Основной эффект наступает через 30—90 мин, и поэтому введение должно, как и ингаляции β2-симпатомиметика, повторяться с коротким интервалом (каждые 30—60 мин). Кроме применения дозированного аэрозоля, возможны также непрерывные ингаляции через распылитель (0,5 мг каждые 4 ч).
В целом терапевтический эффект антихолинергетиков, как атропина, так и ипратропиума бромида значительно слабее, чем эффект β2-симпатомиметика.
У больных с бронхиальной астмой интубация приводит к уменьшению ОФВ1 больше чем на 50%. Кроме того, показано, что ателектазы, которые возникли после массивного бронхоспазма, нельзя открыть без фармакологического воздействия ни приемом рекрутирования альвеол, ни ПДКВ.
Также показано, что у больных с острым приступом астмы увеличение ПДКВ больше, чем на 5 см вод. ст. повышается число осложнений (пневмоторакс и другие побочные явления) без улучшения вентиляции легких.
Цель ИВЛ — не преодоление обструкции давлением, а поддержание достаточной оксигенации с увеличением pаCО2 («допустимая гиперкапния») пока медикаментозная терапия не приведет к улучшению вентиляции. Поэтому принципиально надо всегда критически подумать, можно ли за время до клинического улучшения преодолеть без ИВЛ путем выбора эффективных и быстродействующих медикаментов.
источник
бронхоспазм заболевание легкое анестезия
Заболевание характеризуется генерализованной обратимой обструкцией дыхательных путей, которая вызывается спазмом бронхиальных гладких мышц, отеком и закрытием просвета бронха слизистой пробкой. В предоперационном периоде ключевое значение имеет оценка состояния пациента и приведение его, по возможности, к оптимальному. Данные анамнеза позволяют получить информацию о факторах, провоцирующих приступы, их частоте и тяжести, лекарственной терапии, осложнениях предшествующих анестезий. При дальнейшем обследовании отмечается наличие или отсутствие одышки, хрипов, кашля, удлинения фазы выдоха, признаков инфекции и сердечной недостаточности. Важно исследовать функциональные показатели после применения различных бронходилятаторов для определения их эффективности. При тяжелом заболевании может потребоваться анализ газов крови с целью установить исходные РO2, РCO2 и pH.
На основании дооперационного обследования можно выделить три группы пациентов, которым требуется различная тактика подготовки к операции. В 1-ю группу включают больных, у которых в прошлом определялись хрипы в легких, однако перед операцией они отсутствуют, а приступы бронхоспазма не повторяются. При опросе, физикальном и функциональном обследовании легких патологии не выявляется или обнаруживаются лишь незначительные отклонения от нормы. Этим больным не требуется специальная подготовка к проведению операции и анестезии.
Во 2-ю группу входят больные, у которых на момент обследования хрипы не прослушиваются, но они жалуются на повторные приступы бронхоспазма. К этой группе должны быть также отнесены пациенты, которые планово принимают бронходилятаторы и противовоспалительные средства. При этом ОФВ1, МВВ и ФВ25-75% у них составляет более 80% от нормы или от персонального лучшего показателя и стабильны на момент обследования. Этим больным все применяемые ими антиастматические средства не отменяются вплоть до начала операции (включаются в премедикацию). Если пациент длительно лечился кортикоидами в пероральной или аэрозольной форме, то во избежание развития надпочечниковой недостаточности следует назначить дополнительные дозы (например, гидрокортизон 100 мг в/в или в/м перед операцией, а в первый послеоперационный день по 100 мг 4 раза в день). После восстановления способности к глотанию назначается эквивалентная доза преднизолона перорально.
Если больные этой группы бронходилятаторы не принимали, то им с профилактической целью предоперационно назначают внутривенно или аэрозольно селективные в2-адреномиметики (изопреналин, орципреналин, тербуталин, сальбутамол) и/или аминофиллин (при первичном введении начальная доза составляет 5,6 мг/кг внутривенно в течение 20-30 мин, а поддерживающая — 0,5 — 0,9 мг/кг/ч, ее уменьшают при заболеваниях печени и застойной сердечной недостаточности). У теофиллина достаточно узкие границы терапевтического действия — 10-20 мкг/мл плазмы крови, поэтому при длительном использовании следует проконтролировать концентрацию этого вещества. Пациенты с астмой иногда хорошо реагируют на антихолинергический препарат ипратропия бромид (атровент). Когда состояние больного стабильно и без кортикоидов, их использование не рекомендуется.
3-ю группу составляют пациенты с хрипами в легких, функцией легких менее 80% от должной величины или с тенденцией к снижению в последний период. Плановые операции в этом случае откладываются до купирования бронхоспазма и максимально возможного улучшения проходимости бронхов. Если пациент с острым приступом нуждается в неотложном вмешательстве, ему показано проведение предоперационной подготовки. Следует назначить оксигенотерапию, ингаляцию в2-адреномиметика, внутривенное введение аминофиллина и кортикоидов, что чаще всего позволяет за короткий период улучшить респираторную функцию.
Особенности проведения анестезии. Бронхоспазм в периоперационный период могут вызвать эмоциональный стресс, боль и любое механическое раздражение дыхательных путей (воздуховоды, катетеры, интубационные трубки, кровь, рвотные массы) на фоне недостаточной анестезии, химическое раздражение газообразным анестетиком с резким, неприятным запахом, препараты, вызывающие анафилактические/анафилактоидные реакции или прямой выброс гистамина (морфин, атракуриум, d-тубокурарин, тиобарбитураты), антихолинэстеразные вещества, в -антагонисты. Исходя из этого и формируются подходы к проведению анестезии при сопутствующей бронхиальной астме.
Предпочтение отдается местной, регионарной или общей анестезии с ИВЛ через маску. Но следует учитывать, что при этом риск бронхоспазма по сравнению с общей анестезией и интубацией трахеи снижается, но полностью не исчезает.
В премедикации для снятия высокого уровня тревожности назначаются бензодиазепины. Внутривенное введение атропина предотвращает рефлекторный вагусный бронхоспазм, а также ряд побочных эффектов кетамина, однако в целом отношение к нему неоднозначное. Не рекомендуется использовать Н2 -гистаминолитики.
Выбор препарата для индукции не столь важен, как достижение достаточной глубины анестезии перед интубацией и хирургической стимуляцией. Тем не менее, лучше отказаться от барбитуратов и морфина. Не отмечается бронхоспазма при использовании пропофола, этомидата и фентанила. Кетамин обладает мощными бронходилятирующими способностями. Его можно рассматривать как анестетик, используемый в неотложной хирургии у пациентов с астмой при нестабильной гемодинамике. Он может использоваться для послеоперационной аналгезии в виде продолжительной инфузии. Однако его сочетание с высокой концентрацией теофиллина в крови чревато развитием судорог. Ингаляционные агенты также обладают бронхорасширяющим действием. Галотан (фторотан), в отличие от изофлюрана и десфлюрана, является более мощным бронходилататором. Он не вызывает кашель при вводной анестезии. Когда пациента лечат теофиллином, и его концентрация в плазме находится в области токсических доз, следует выбирать энфлуран или изофлуран, поскольку риск тяжелой аритмии значительно ниже, чем при использовании фторотана. Сукцинилхолин, атракуриум и тубокурарин наиболее часто по сравнению с другими релаксантами вызывают выброс гистамина.
Интубация трахеи сама по себе может вызвать бронхоспазм. Важно, чтобы она, как и начало операции, проводились при достаточной глубине анестезии. Анестезия голосовой щели спреем не снижает частоту бронхоспазма. Более того, она может даже способствовать его развитию, тогда как внутривенное введение лидокаина (1,5 мг/кг) за 2-3 мин до индукции и интубации представляется эффективным.
Поддержание анестезии может осуществляться газообразными галогенсодержащими анестетиками, закисью азота, кетамином, диприваном, наркотическим анальгетиком, миорелаксантом. Декураризация при помощи ингибиторов холинэстеразы представляет собой критический этап у таких больных, но она возможна на фоне действия антихолинэргических средств. Вопрос о том, когда лучше проводить экстубацию: в сознании или во сне, решается неоднозначно. Это, прежде всего, зависит от привычек и опыта врачей. Внутривенное введение лидокаина позволяет подавить рефлексы дыхательных путей при просыпании.
Значительную проблему представляют пациенты с тяжелой сердечной патологией на фоне астмы. Следует принимать во внимание степень тяжести заболевания. При относительно легком течении бронхиальной астмы и выраженных нарушениях системы кровообращения предпочтительна более поверхностная анестезия закисью азота и релаксантами, чем анестезия более сильными анестетиками, усугубляющими сердечную недостаточность. Для уменьшения частоты бронхоспазма и профилактики желудочковой экстрасистолии и тахикардии можно использовать болюсно лидокаин с последующей непрерывной его инфузией. Следует заменять назначение в-антагонистов блокаторами кальциевых каналов.
Риск бронхоспазма не исчезает к концу анестезии, а существует на всем протяжении послеоперационного периода. Следует учитывать возможность обструкции бронхов, ателектазов и инфекции. Важно обеспечить больному эффективную аналгезию, активную респираторную терапию с хорошим дренажом секрета, кислородотерапию и продолжение антиастматического лечения (чаще всего аэрозольным путем).
Терапия интраоперационного бронхоспазма. Для успешного купирования бронхоспазма, развившегося во время анестезии, необходима правильная диагностика. Он проявляется свистящим дыханием, повышением пикового давления вдоха, уменьшением экспираторного дыхательного объема, снижением артериального РO2 и насыщения O2, замедлением подъема восходящего колена кривой СO2 на капнограмме. При тяжелом бронхоспазме газоток может быть минимален либо отсутствовать, хрипов не слышно, концентрация СO2 резко снижена.
Следует исключить состояния, имитирующие бронхоспазм: обструкцию интубационной трубки вследствие перегибания, закупорки мокротой или перераздувания манжетки; эндобронхиальную интубацию; пневмоторакс; аспирацию желудочного содержимого; отек легких или эмболию легочной артерии; попытки самостоятельного дыхания при поверхностной анестезии; инспираторный стридор и ларингоспазм.
Лечение следует начинать немедленно. Прежде всего, необходимо устранить этиологический фактор, если это возможно. Бронхоспазм, спровоцированный раздражением, исходящим из зоны операции или из верхних дыхательных путей, обычно прекращается при углублении анестезии (в первую очередь кетамин или ингаляционные анестетики). Если он вызван применением какого-либо препарата, то в последующем применять его не следует. Антигистаминные средства не показаны, так как они уже не прекращают действие медиатора.
При снижении насыщения гемоглобина O2 следует повысить FiO2 до 100%. Рекомендуется перейти на ручную или автоматическую вентиляцию с относительно с частотой дыхания 10-14 в мин и дыхательным объемом 5-7 мл/кг под контролем пикового давления вдоха. Такой режим позволяет снизить вероятность нанесения баротравмы, увеличить продолжительность вдоха и выдоха с целью более равномерного распределения газового потока в легких, уменьшить экспираторное закрытие дыхательных путей и улучшить газообмен.
В случае бронхоспазма легкой или средней степени тяжести методом выбора является эндобронхиальное введение в2-адреномиметика. Ориентируются на данные дооперационного обследования и лекарственный анамнез. Препараты распыляют с помощью небулайзера или специальным ингалятором через переходник, доводя до 5-10 дозированных вдуваний. Если эффект не достигается, развивается бронхоспазм тяжелой степени или отсутствует возможность аэрозольного введения назначают внутривенно сальбутамол (сначала 125-250 мкг, затем 5-20 мкг/мин) или аминофиллин (нагрузочную дозу снижают в 2-4 раза, если больной принимал препарат до операции, ориентируясь на дооперационную концентрацию препарата в крови) либо подкожно вводят тербуталин (0,25 мг). Применяют также глюкокортикоиды (гидрокортизон внутривенно 1,5-2 мг/кг) с целью профилактики последующих спазмов и усиления действия адреномиметиков, особенно если пациент их раньше принимал. В отдельных случаях требуется внутривенное введение изопротеренола (1-3 мкг/мин) или адреналина (0,1 мкг/кг болюсно, далее 10-25 нг/кг/мин). Эти препараты титруют, ориентируясь на частоту сердечных сокращений, артериальное давление и бронходилятирующий эффект. Развитие метаболического ацидоза служит показанием для назначения гидрокарбоната натрия, повышающего эффективность действия в-агонистов.
источник







 «ультракаин ДС форте» – с концентрацией эпинефрина 1:100.000,
«ультракаин ДС форте» – с концентрацией эпинефрина 1:100.000,