
Обследование, основанное на сборе анамнеза, внешнем осмотре, пальпации, прослушивании и простукивании называется физикальным. Именно с такого метода диагностики начинается определение типа болезни.

- В каком возрасте начались астматические приступы, возможно какие детские болезни привели к астме. Это может быть коклюш, корь и другие, которые могут негативно повлиять на дыхательную систему.
- Были ли среди родственников астматики, это позволяет проследить генетическую связь, возможно кто-то из близких имел сильные аллергии.
- С какими раздражителями связаны приступы. Такие раздражители называются триггерами, и среди них может быть физическая нагрузка, холодный влажный воздух, микроскопические частицы шерсти и кожи собак, кошек, пыльца цветов разных растений, запыленность в помещении пылью определенного типа, продукты питания.
- Нужно узнать, как именно проходят приступы. Ведь при астматическом кашле пациенты принимают положение, при котором вдох менее мучительный, например, опираются руками о стол, расслабляя при этом плечевой пояс.
- Есть ли звуки при кашле, ведь свист при дыхании — это признак астматического сужения бронхов. Чтобы услышать характерные звуки при дыхании и приступах, не нужно прослушивать грудь стетоскопом, их хорошо слышно и на небольшом расстоянии.
- Долго ли длится приступообразный кашель, пропадает ли он после приема бронхолитических лекарств.
- После приступа наблюдается выделения вязкой, но прозрачной, как стекло мокроты, которая освобождает бронхи, таким образом облегчается дыхание, такие особенности также нужно узнавать при опросе.
Внешний осмотр проходит следующим образом:
- Врач смотрит на грудную клетку, которая может иметь вид, похожий на бочку. Такую форму грудная клетка приобретает вследствие развития эмфиземы, расширения легких, и, как результат — увеличение размеров грудной клетки;
-
Прослушивание проходит через стетоскоп, стетофонендоскоп или фонендоскоп, причем последний наиболее подходит для изучения звуков, издаваемых грудной клеткой при астме. Если происходит обострение, свист и характерные хрипы слышны по всей легочной поверхности, но при ремиссии свистящий хрип слышен снизу от лопаток и то только при усиленном вдохе.
- Постукивание пальцами не может эффективно сообщить информацию на ранних этапах астмы. Но если болезнь длится долго, то пальпацией и постукиванием можно услышать пустоту (звук картонной коробки), которая образовалась из-за эмфиземного расширения легких.
Лабораторные исследования проводятся в следующих направлениях:
- анализ крови направлен на определение количества эозинофилов — этот вид лейкоцитов является показателем аллергических процессов в организме;
-
если в анализе крови отсутствуют признаки воспалительных процессов и токсинов, выделяемых бактериями, то при наличии астматических симптомов доктору легче отличить астму от обычного бронхита или пневмонии;
- в мокроте под микроскопом можно обнаружить эозинофилы;
- в анализе мокроты присутствуют кристаллические вкрапления — особенные кристаллы Шарко-Лейдена и спиралевидные кристаллы Куршмана;
- мокрота при астме специфическая, отличается от мокроты при бронхите, структура двухслойная, консистенция густая, по густоте вязкая;
- методом проделывания царапин на коже (скарификации) берут пробы на аллергены, по которым уточняют аллергический возбудитель (триггер) бронхоспазма, аллергены вызывают на коже покраснение и зудящие ощущения;
- кал берут для определения гельминтов, которые могут размножиться до инвазивного количества и вызвать аллергическую интоксикацию организма, что также может влиять на возникновение приступов.
С помощью специально разработанных аппаратов проводится инструментальная диагностика. На первом месте в аппаратной диагностики стоит пикфлуометрия. На пикфлоуметре, который являет собой трубочку с нанесенной шкалой, измеряется самая большая скорость потока воздуха при выдохе, сделанном с максимальным усилием (форсированный выдох). Такая пиковая скорость выдоха называется ПСВ. Этот тест доступен детям с четырех лет, также он применяется и для взрослых.
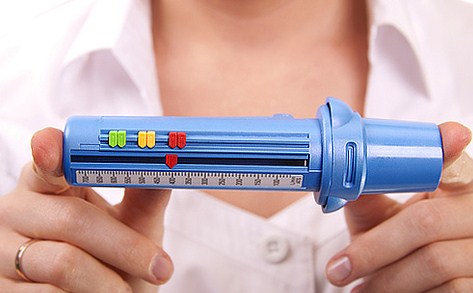
Измерительные процессы проводятся дважды в день, сутра и ближе к вечеру. Делаются три попытки, из которых выбирается та, которая сделана наиболее правильно. На трубку нанесена шкала с зеленой, желтой и красной зоной, которые обозначают степень проблемы. Но эта шкала не унифицирована, она подбираются путем индивидуальных двухнедельных исследований каждого больного. Если показатели в зеленой зоне, значит, что симптомы астмы под контролем, желтая зона — возможно обострение, при красной зоне нужно немедленно спешить человеку на помощь.
Больной должен зафиксировать лучшее значения ПСВ, и при дальнейшем использовании прибора при определении обструктивных изменений надобно соотносить с этим значениям другие показатели шкалы. Нужно правильно делать выдох форсированным способом, результаты записывать в дневник, чтобы с этими результатами ознакомить позже лечащего врача. Возможно, в вашем городе есть школа для больных астмой (где доктора рассказывают, как лечить это заболевание), поинтересуйтесь у доктора.

Спирограмма показывает форсированную жизненную емкость легких, сокращенно ФЖЕЛ, а также объем форсированного выдоха за одну секунду, сокращенно — ОФВ1, и так называемую пиковую скорость выдоха (ПСВ). Высчитывается индекс Тиффно, который составляет ОФВ1 поделить на ФЖЕЛ, у здоровых людей этот показатель выше 0,75.
Если при подозрениях на астму показатели спирографа в пределах нормы, делают медицинскую провокацию — дают больному метхолин или гистамин в виде ингаляций и сравнивают спирограмму с обычной обструкцией и под действием этих лекарств.
Но анализ дыхания может не дать четких результатов в случае, если заболевание являются профессиональным и приступ вызывает вещество, присутствующее только на работе. Чтобы диагностировать профессиональную астму, нужно кроме тестов дыхания изучить анализы и с помощью опроса выявить аллерген на рабочем месте пациента.
Если болезнь уже долго прогрессирует, развивается эмфизема, увеличение в объеме легких, которые на рентгенологической фотографии видимы как более прозрачные.
Томографию также назначают не во всех случаях, а только тогда, когда кашель и удушье не проходят длительное время, не смотря на лечение, и есть подозрения на наличие других болезней.
Диагностика астматических приступов у детей имеет особенности, поскольку они часто болеют респираторными и другими заболеваниями с похожими симптомами. Прежде всего у детей выясняют зависимость приступов от действий аллергенов, также возможную склонность к аллергии на генетическом уровне — есть ли близкие родственники с сильной аллергией на что-либо, это позволяет уточнить диагноз.

У детей исследуют внешнее дыхание с помощью приборов, предварительно дав бронходилататоры (препараты, расширяющие просвет в бронхах). Также сдают анализы, чтобы отследить наличие гельминтов и воспалительного процесса в организме, иногда проводят аллергологический тест. Но некоторые современные врачи отказываются от тестов на аллергены, резонно указывая на то, что в большинстве случаев аллергены вполне обычны и избежать их влияния довольно трудно.
У детей бронхиальная астма полностью излечима в большинстве случаев, однако для успешного лечения имеет большое значение своевременная диагностика бронхиальной астмы и правильное лечение, которое состоит не только в приеме медикаментов, но и в укреплении организма.
Люди пожилого возраста имеют множество заболеваний, которые могут хронически проходить долгие годы. Симптомы этих болезней могут накладываться на астматические, и клиническая картина становится нечеткой.

Кроме того, рекомендуется проводить функциональные методы выявления бронхиальной астмы, включающие ЭКГ, рентгенографию, пикфлоуметрию (это исследование нужно делать в течение 2 недель). Только после выполнения всех диагностических мероприятий назначается симптоматическое лечение бронхиальной астмы.
источник
Что такое бронхиальная астма? Причины возникновения, диагностику и методы лечения разберем в статье доктора Сергеева А. Л., аллерголога со стажем в 10 лет.
Бронхиальная астма (БА) — заболевание, характерным проявлением которого является хроническое воспаление дыхательных путей, респираторные симптомы (свистящие хрипы, одышка, заложенность в груди и кашель), которые варьируют по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей. [1]
БА занимает лидирующую позицию по распространенности среди населения. Если верить статистике, за 15 лет зафиксировано удвоение количества заболевших этой патологией.
По оценкам ВОЗ, сегодня БА болеет примерно 235 млн человек, а к 2025 году прогнозируется увеличение до 400 млн человек в мире. [1] Так, в исследованиях 3 фазы (ISSAC) также выявлен рост мировой заболеваемости БА у детей в возрасте 6-7 лет (11,1-11,6%), среди подростков 13-14 лет (13,2-13,7%). [2] [3]
На появление и развитие БА влияет ряд причин.
Внутренние причины:
1. пол (в раннем детстве преимущественно болеют мальчики, после 12 лет девочки);
2. наследственная склонность к атопии;
3. наследственная склонность к гиперреактивности бронхов;
Внешние условия:
1. аллергены:
- неинфекционные аллергены: бытовые, пыльцевые, эпидермальные; грибковые аллергены;
- инфекционные аллергены (вирусные, бактериальные);
2. инфекции дыхательных путей. [4]
Характерные симптомы БА, на которые жалуются большинство больных, включают:
- кашель и тяжесть в груди;
- экспираторная одышка;
- свистящее дыхание.
Проявления БА изменчивы по своей тяжести, частоте появления и зависят от контакта с различными аллергенами и другими триггерными факторами. Зависят они и от подобранного противоастматического лечения, количества и тяжести сопутствующих заболеваний. Чаще всего симптомы БА беспокоят в ночное время или в ранние утренние часы, а также после физических усилий, что приводит к снижению физической активности больных. Воспалительные изменения в бронхиальном дереве и гиперреактивность дыхательных путей выступают основными патофизиологическими признаками БА. [5]
Механизмы, вызывающие основные симптомы БА [5]
| Симптом | Механизм |
|---|---|
| Кашель | Раздражение рецепторов бронхов, сокращение гладкой мускулатуры бронхов |
| Свистящее дыхание | Бронхообструкция |
| Заложенность в груди | Констрикция мелких дыхательных путей, воздушные ловушки |
| Одышка | Стимулированная работа дыхания |
| Ночные симптомы | Воспалительный процесс, гиперреактивность бронхов |
Патогенез бронхиальной астмы можно наглядно представить в виде схемы:
Сегодня есть огромное количество классификаций БА. Ниже представлены основные, они помогают в понимании причин и необходимы для статистики. Кроме того, приведен современный подход в рассмотрении проблемы астмы, как выделение фенотипов астмы. [1] [6]
В России используется следующая классификация БА:
Классификация БА (МКБ-10)
| J45, J45.0 Астма с преобладанием аллергического компонента |
| аллергическая экзогенная |
| атопическая |
| Бронхит аллергический без доп. уточнений |
| Ринит аллергический с астмой |
| Сенная лихорадка с астмой |
| J45.1 Астма неаллергическая |
| идиосинкратическая |
| эндогенная неаллергическая |
| J45.8 Астма сочетанная |
| ассоциация с состояниями, упомянутыми в J45.0, J45.1 |
| J45.9 Астма без уточнения |
| астма поздно начавшаяся |
| астматический бронхит без доп. уточнений |
| J46 Астматический статус |
| астма тяжелая острая |
Приоритетное внимание сейчас уделяется персонализированной медицине, которая на данный момент не имеет возможности создания индивидуального лекарственного препарата и способов обследования или предупреждения развития заболевания для конкретного больного, но предложено выделять отдельные категории. Эти подгруппы больных называют фенотипами БА, характеризующимися особенностями в причинах, развитии, методах обследования и терапии. [1] [8]
На данный момент существуют следующие фенотипические формы БА:
- Аллергическая БА. Этот тип не представляет сложности в диагностике — дебют заболевания выпадает на детский возраст, связан с отягощенным аллергологическим анамнезом. Как правило, у родственников также имеются респираторные или кожные проявления аллергии. У людей с этой разновидностью БА зафиксировано иммунное воспаление в бронхиальном дереве. Эффективно лечение больных этим типом БА местными кортикостероидами ( ГКС).
- Неаллергическая БА. Этим типом БА болеют преимущественно взрослые, в анамнезе нет аллергопатологии, наследственность по аллергии не отягощена. Характер воспалительных изменений в бронхах этой категории бывает нейтрофильно-эозинофильным, малогранулоцитарным или сочетать эти формы. ИГКС плохо работают в лечении этого типа БА.
- Астма с постоянной констрикцией дыхательных путей. Есть такая группа пациентов, у которых начинаются необратимые изменения в бронхах, как правило, это люди с неконтролируемыми симтомами БА. Изменения в бронхиальном дереве характеризуются перестройкой стенки бронхов. Терапия данных пациентов сложна и требует пристального внимания.
- Астма с запоздалым началом. Большинство больных, в основном женского пола, заболевают астмой в солидных годах. Эти категории больных требуют назначения повышенных концентраций ИГКС или становятся почти резистентными к базовой терапии.
- Астма в сочетании с лишним весом. Этот тип учитывает, что категория людей с превышением веса и БА страдают более тяжелыми приступами удушья и кашлем, постоянно бывает одышка, а изменения в бронхах характеризуются умеренным аллергическим воспалением. Лечение данных пациентов начинается с коррекции эндокринологических отклонений и диетотерапии.
Если вовремя не поставить диагноз бронхиальной астмы и не подобрать терапию, которая позволит контролировать течение болезни, могут развиться осложнения:
- легочное сердце, вплоть до острой сердечной недостаточности;
- эмфизема и пневмосклероз легких, дыхательная недостаточность;
- ателектаз легких;
- интерстициальная, подкожная эмфизема;
- спонтанный пневмоторакс;
- эндокринные расстройства;
- неврологические расстройства.
Бронхиальная астма представляет собой клинический диагноз, который устанавливает врач, учитывая жалобы, анамнестические особенности пациента, функциональные методы диагностики с учетом степени обратимости обструкции бронхов, специального обследования на наличие аллергопатологии и дифференциальной диагностики с прочими болезнями со схожими жалобами. Дебют развития заболевания чаще всего происходит в возрасте от 6 лет, реже после 12 лет. Но появление возможно и в более позднем возрасте. [9] Пациенты жалуются на эпизоды затрудненного дыхания ночью, в предутренние часы или связывают жалобы с эмоциональной, а иногда и физической перегрузкой. Эти симптомы сочетаются с затруднением дыхания, с нарушениями выдоха, «свистами» в груди, рецидивирующим кашлем с небольшим количеством мокроты. Эти симптомы могут купироваться самостоятельно или с использованием лекарственных бронхорасширяющих препаратов. Необходимо связать появления признаков БА после взаимодействия с аллергенными веществами, сезонность появления симптомов, связь с клиническими признаками насморка, присутствие в анамнезе атопических заболеваний или астматических проблем.
При подозрении на диагноз БА следует задать вопросы:
- Беспокоят ли вас приступы похрипывания в легких?
- Бывает ли покашливание в ночное время?
- Как вы переносите физическую нагрузку?
- Беспокоят ли вас тяжесть за грудиной, покашливание после пребывания в запыленных помещениях, контакта с шерстью животных, в весенне-летний период?
- Заметили ли вы, что чаще болеете дольше двух недель, и заболевание часто сопровождается кашлем и одышкой?
Специфические методы постановки диагноза
1. Оценка функции работы легких и степени возвратимости бронхиальной констрикции
- Спирометрия — это основной и простой метод исследования тяжести и возвратимости обструкции бронхов, применяемый также для последующей оценки течения БА. При проведении ФВД можно выявить тип изменений бронхиального дыхания (обструктивный, рестриктивный, смешанный), оценить тяжесть состояния. Для точной диагностики возвратимости бронхиальной констрикции можно применить пробу с бронхорасширяющими препаратами. Общепринятым положительным тестом считается прирост ОФВ1≥12%. Применяют следующие виды бронходилататоров: β2-агонисты быстрого эффекта (сальбутамол, фенотерол, тербуталин) с контролем ответа в течение 14 минут. Положительный тест свидетельствует об обратимости значений нарушений при БА. [9]
- Пикфлоуметрия. Часто применяется измерение пиковой скорости выдоха с помощью специального простого аппарата — пикфлоуметра. Необходимо объяснить больным, как измерять ПСВ в утренние часы (до пользования лекарственными препаратами); в этом случае измеряем самое минимальное значение ПСВ. Измерение ПСВ необходимо сделать и поздним вечером, это будет самый высокий уровень ПСВ. Изменчивость в течение суток ПСВ называют амплитудой ПСВ. Фиксирование ПСВ следует проводить около 2-3 недель. Данное исследование оценивает ПСВ в домашних и рабочих условиях, что позволяет определить, как влияют факторы внешней обстановки на самочувствие пациента (аллергены, профессиональные факторы, физическая нагрузка, стрессы и другие триггеры). [10]
- Определение гиперреактивности бронхов. Присутствие гиперреактивности бронхиального дерева считается важным критерием для постановки диагноза БА. Самым используемым методом исследования гипервосприимчивости бронхов на данный момент является бронхоконстрикторный тест с биологически активными веществами (метахолином, гистамином), а также физической нагрузкой. Оценка показателей исследования оценивается по изменениям ОФВ1. При уменьшении показателей ОВФ1 более чем на 20% (от первоначальных цифр) тест можно считать положительным. [8]
2. Аллергообследование. Подразумевает проведение аллергопроб на коже, тестов-провокаторов с некоторыми видами аллергенов, лабораторного исследования для выявления специфических IgE-антител. Наиболее распространенными являются кожные пробы, так как это простые методы по технике выполнения, достоверно точные и безопасные для пациентов.
2.1. Существуют следующие виды кожных аллергопроб по технике выполнения:
- скарификационные аллергопробы;
- пробы уколом (prick-test);
- внутрикожные пробы;
- аппликационные пробы
Чтобы проводить кожные пробы, необходимы данные из истории болезни пациента, свидетельствующие за однозначную связь жалоб и контакта с тем аллергеном или их группой в патогенезе болезни, IgE-зависимый тип аллергической реакции.
Кожное тестирование не проводится в случаях:
- обострения аллергического заболевания;
- острых вирусных или бактериальных заболеваний (ОРВИ, назофарингиты, бронхиты и др.);
- тяжелой формы астмы, ее неконтролируемого течения (ОФВ1 [10]
2.2. Провокационный ингаляционный тест. Эксперты Респираторного Общества из Европы рекомендуют проводить данное исследование. Перед исследованием проводят спирометрию, и если уровень ОФВ1 не снижается ниже отметки 70% от нормы, пациент допускается до провокации. Используют небулайзер, с помощью которого можно струей выдавать определенные дозы аллергена, и пациент делает несколько ингаляций с определенными разведениями аллергенов под постоянным контролем врача-аллерголога. После каждой ингаляции оцениваются результаты через 10 мин трижды. Тест расценивается как положительный при уменьшении ОФВ1 на 20% и больше от начальных показателей.
2.3. Методы лабораторной диагностики. Диагностика в лаборатории выступает неосновным методом. Проводится, если необходимо еще одно исследование для подтверждения диагноза. Основными показаниями для назначения лабораторной диагностики являются:
- возраст до 3-х лет;
- в анамнезе тяжелые аллергические реакции на кожное обследование;
- основное заболевание протекает тяжело, практически без периодов ремиссии;
- дифференциальная диагностика между IgE-опосредованными и не-IgE-опосредованными типами аллергических реакций;
- обострение кожных заболеваний или особенности строения кожи;
- требуется постоянный прием антигистаминных препаратов и глюкокортикостероидов;
- поливалентная аллергия;
- при проведении кожного тестирования получают ложные результаты;
- отказ больного от кожных проб;
- результаты кожных проб не совпадают с клиническими данными.
В лабораториях применяют следующие методы определения общего и специфического IgE — радиоизотопный, хемилюминисцентный и иммуноферментный анализы.
Самый новый подход к диагностике аллергических заболеваний на данный момент — это молекулярное аллергообследование. Оно помогает более точно поставить диагноз, рассчитать прогноз течения болезни. Для диагностики важно учитывать следующие нюансы:
- отличие истинной сенсибилизации и перекрестных реакций у больных с полиаллергией (когда имеется широкий спектр сенсибилизации);
- снижение риска тяжелых системных реакций при проведении аллергообследования, что улучшает приверженность пациентов;
- точное определение подтипов аллергенов для проведения аллерген-специфической иммунотерапии (АСИТ);
- наиболее распространена технология чипов Immuna Solid phase Allergen Chip (ISAC). Это самая полноценная платформа, которая включает в себя более 100 аллергенных молекул в одном исследовании.
Сегодня, к сожалению, современная медицина не может вылечить больного от бронхиальной астмы, однако все усилия сводятся к созданию терапии с сохранением качества жизни пациента. В идеале при контролируемой БА должны отсутствовать симптомы заболевания, сохраняться нормальными показатели спирометрии, отсутствовать признаки патологических изменений в нижних отделах легких. [1]
Европейскими рекомендациями предложен ступенчатый подход к лечению:
Фармакотерапию БА можно разделить на 2 группы:
- Препараты ситуационного использования
- Препараты постоянного использования
Препараты для купирования приступов следующие:
- коротко-действующие β-адреномиметики;
- антихолинергические препараты;
- комбинированные препараты;
- теофиллин.
К препаратам для поддерживающей терапии относят:
- ингаляционные и системные глюкокортикостероиды;
- комбинации длительно действующих β2-агонистов и ГКС;
- теофиллины с длительным действием;
- антилейкотриеновые препараты;
- антитела к имммуноглобулину Е.
Для терапии БА важны как лекарственные препараты, так и способы введения данных веществ в организм и дыхательные пути. Препараты могут назначаться внутрь per os, парентерально, ингаляционно.
Выделяют следующие группы доставки лекарственных препаратов через дыхательные пути:
- аэрозольные ингаляторы;
- порошковые ингаляторы;
- небулайзеры.
Самым современным и исследованным методом лечения аллергической БА с подтвержденной эффективностью является АСИТ (аллерген-специфическая иммунотерапия). АСИТ на данный момент является единственным способом терапии, который меняет развитие болезни, действуя на механизмы патогенеза астмы. Если вовремя провести АСИТ, данное лечение способно приостановить переход аллергического ринита в астму, а также пресечь переход легкой формы в более тяжелую. А также преимущества АСИТ — это возможность не дать появиться новым сенсибилизациям.
АСИТ при БА проводится пациентам с:
- легкой или средней тяжести формой заболевания (цифры ОФВ1 должны быть не менее 70% от нормы);
- если симптомы астмы не полностью контролируются гипоаллергенным бытом и лекарственной терапией;
- если у пациента имеются риноконъюнктивальные симптомы;
- если пациент отказывается от постоянной формакотерапии;
- если при проведении фармакотерапии возникают нежелательные эффекты, которые мешают пациенту.
Сегодня мы можем предложить пациентам следующие виды АСИТ:
- инъекционное введение аллергенов
- сублингвальное введение аллергенов
В современных условиях нет доказательств, что экологические, климатические факторы, нарушения питания могут ухудшать течение БА, и устранение этих триггеров поможет снизить тяжесть заболевания и уменьшить объем фармакотерапии. Требуется проведение дальнейших клинических наблюдений в этом ключе. [7]
Выделяют первичную профилактику. Она включает:
- элиминацию аллергенов во время беременности и в первые годы жизни ребенка (гипоаллергенный быт и гипоаллергенная диета);
- кормление грудью;
- молочные смеси;
- пищевые добавки во время беременности (существует несколько гипотез протективного эффекта рыбьего жира, селена, витамина Е);
- отказ от курения во время беременности.
Вторичная профилактика включает:
- избегать поллютантов (повышение концентраций озона, окислов озона, взвесей частиц, аэрозолей кислот);
- борьба с клещами домашней пыли;
- не заводить домашних животных;
- отказ от курения в семье.
источник
Диагностика бронхиальной астмы выполняется, ориентируясь на полное комплексное обследование организма пациента. От правильно проведенной диагностики зависит получение положительных результатов лечения.
Протоколы (стандарты) определения заболеваемости, а также дальнейшего лечения взрослого населения и детей учитывают различные методики: клинический осмотр, сбор анамнеза, выявление симптоматики, лабораторная диагностика.
После проведения необходимых мероприятий для каждого больного подбирается индивидуальная схема лечения, которая способствует снижению заболеваемости и облегчению состояния больного. Дифференциальная диагностика бронхиальной астмы учитывает все аспекты (анализы, симптоматику, анамнез, аллергологическое исследование и дыхательную функциональность.).
Современная диагностика при развитии бронхиальной астмы является важной задачей для врача, так как адекватное лечение способно обеспечить полный контроль над заболеванием при полной нейтрализации симптоматики у детей и взрослых. Для этого оцениваются все критерии астмы с исключением ХОБЛ и постановкой предварительного диагноза.
Протоколы диагностики проводятся в несколько этапов:
Бронхиальная астма, в зависимости от степени заболеваемости, определяется наиболее часто в детском и подростковом возрасте. Как правило, наблюдается генетическая предрасположенность к развитию астматических заболеваний. Кроме того, ее развитие возможно на фоне ХОБЛ.
Бронхиальный приступ нередко связан с воздействием определенных факторов, провоцируя характерную симптоматику (одышку, кашель, свистящее дыхание, слабость и т.д.). Приступ способен появиться внезапно. Его можно купировать при помощи ингаляционных бронхолитиков. Если после использования ингалятора приступ не снимается, необходимы дальнейшие протоколы диагностики, а также исключение ХОБЛ.
В начальной стадии заболевания профессиональная диагностика не способна определить какие-то определенные протоколы в определении бронхиальной астмы, кроме исключения ХОБЛ. Во время затяжного приступа может возникнуть симптом «бочкообразной грудной клетки», что связано с затрудненным выдохом. В результате этого возможно постепенное развитие эмфиземы, критерии и протоколы которой зависят от выраженности симптоматики и стадии заболеваемости. От результатов визуального осмотра может зависеть дальнейшее лечение.
Немаловажным способом профессиональной диагностики является перкуссия (выстукивание) и аускультация (выслушивание) легких. По мере развития приступа можно услышать свистящее дыхание и хрипы в легких. Перкуссия эффективна при длительном течении заболевания и эмфиземе.
Лабораторная диагностика предполагает назначение проведения различного вида анализов, среди которых:
- биохимический анализ крови — определяет количество эозинофилов, являющихся маркерами аллергического процесса. Кроме того, этот анализ в совокупности с аллергологической пробой, позволяет выявить конкретный аллерген, на который острее всего реагирует организм;
- общий анализ крови — позволяет выявить воспалительные процессы, ХОБЛ и интоксикацию в организме больного. Забор крови выполняется натощак;
- общий анализ мокроты — выявляет характерные астматические маркеры с характерными спиралями Куршмана и кристаллами Шарко – Лейдена. При этом определяется вязкая и густая мокрота, которая может расслаиваться двумя слоями. При микроскопическом исследовании определяются эозинофилы;
- анализ кала — способствует выявлению паразитарных инвазий, которые нередко провоцируют развитие бронхиальной астмы. Например, аскариды при своей цикличности развития способны проникнуть через легочную систему, вызывая общую интоксикацию организма, ослабление иммунной системы, повышенную аллергизацию пациента;
- аллергопроба (включая скарификационную) — критерии проведения аллергопробы позволяют уточнить наличие триггера в крови, который вызывает ответную цепь реакций в крови, приводя к бронхоспазму. При положительном ответе могут наблюдаться местные признаки воспаления (зуд, гиперемия, отек и т.д.).
Наиболее сложно диагностировать астму при наличии обструктивного бронхита (ХОБ). Этот процесс проявляется, как хроническая обструктивная болезнь легких (ХОБЛ).
Протоколы выполнения этого вида диагностики служат показателями для постановки итогового диагноза.
Профессиональная рентгенография способна выявить повышенную воздушность легочной ткани (эмфизему) и усиленный легочный рисунок за счет активного притока крови к легочной ткани. Тем не менее, следует учитывать, что иногда даже рентгенограмма не может выявить изменения. Поэтому принято считать, что методы рентгенографии глубоко неспецифичны.
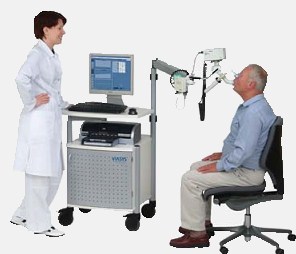
Этот метод служит для определения ФВД (функций внешней дыхательной деятельности) и является достаточно эффективным. Профессиональная спирометрия способна определить ряд главных показателей дыхательной деятельности.
Диагностика спирометрии выглядит следующим образом:
- пациенту предлагается дышать через специальный прибор (спирометр), который обладает чувствительностью и фиксирует все изменения дыхания;
- анализ проведенного обследования сравнивается (врачом или пациентом) с рекомендуемыми показателями ФВД;
- на основании профессиональной сравнительной характеристики внешнего дыхания врач устанавливает предварительный диагноз (для 100% уверенности в диагнозе одной спирометрии недостаточно);
- если у больного наблюдается бронхообструктивные нарушения (исключая ХОБЛ) это может говорить о проявлении бронхиальной астмы.
Помимо этого, спирометрические данные позволяют определить тяжесть астматического приступа и эффективность проводимого лечения в том случае, когда оно использовалось.
Этот метод диагностирования относится к нововведениям для контроля и определения развития бронхиальной астмы у взрослого пациента. Мониторинговый протокол с участием пикфлоуметра обладает следующими преимуществами:
- позволяет определить обратимость бронхиальной обструкции;
- возможность оценки тяжести течения болезни;
- протоколы пикфлоуметрии позволяют спрогнозировать период, когда возникает астматический приступ, в зависимости от степени заболеваемости;
- возможность выявления профессиональной астмы;
- мониторинг эффективности проводимого лечения.
Пикфлоуметрию следует выполнять ежедневно. Это позволяет получить более точные результаты диагностики.
При помощи этого способа профессиональной диагностики определяется пиковая объемность и максимальная объемная скорость на различных уровнях, учитывая процентное соотношение ФЖЕЛ (форсированную жизненную емкость легких). Измеряют максимальную скорость на уровне в 75%, 50% и 25%.
Наиболее затруднительны протоколы определения профессиональной астмы, так как приступ могут вызвать некоторые химические соединение, присутствующие в воздухе. Для подтверждения
СТАТЬЯ НАХОДИТСЯ В РУБРИКЕ — заболевания, астма.
Copyright © 2015-2019 Аллергия. Материалы данного сайта являются интеллектуальной собственностью владельца интернет площадки. Копирование информации с данного ресурса, разрешено только при указании полной активной ссылки на источник. Перед применением материалов сайта, обязательна консультация с врачем.
источник
Бронхиальная астма – диагноз клинический, то есть врач ставит его на основании прежде всего жалоб, истории заболевания и данных осмотра и внешнего исследования (пальпации, перкуссии, аускультации). Однако дополнительные методы исследования дают ценную, а в некоторых случаях определяющую диагностическую информацию, поэтому они широко применяются на практике.
Диагностика бронхиальной астмы с помощью дополнительных методов включает проведение лабораторных анализов и инструментальных исследований.
Пациенту с астмой могут быть назначены следующие анализы:
- общий анализ крови;
- биохимический анализ крови;
- общий анализ мокроты;
- анализ крови для выявления общего IgE;
- кожные пробы;
- определение в крови аллергенспецифических IgE;
- пульсоксиметрия;
- анализ крови на газы и кислотность;
- определение оксида азота в выдыхаемом воздухе.
Разумеется, не все эти тесты выполняются у каждого больного. Некоторые из них рекомендуются лишь при тяжелом состоянии, другие – при выявлении значимого аллергена и так далее.
Общий анализ крови выполняется у всех пациентов. При бронхиальной астме, как и при любом другом аллергическом заболевании, в крови отмечается увеличение количества эозинофилов (EOS) более 5% от общего количества лейкоцитов. Эозинофилия в периферической крови может возникать не только при астме. Однако определение этого показателя в динамике (повторно) помогает оценить интенсивность аллергической реакции, определить начало обострения, эффективность лечения. В крови может определяться незначительный лейкоцитоз и увеличение скорости оседания эритроцитов, однако это необязательные признаки.
Биохимический анализ крови у больного с астмой часто никаких отклонений не выявляет. У некоторых пациентов отмечается увеличение уровня α2- и γ-глобулинов, серомукоида, сиаловых кислот, то есть неспецифических признаков воспаления.
Обязательно проводится анализ мокроты. В ней находят большое количество эозинофилов – клеток, участвующих в аллергической реакции. В норме их меньше 2% от всех обнаруженных клеток. Чувствительность этого признака высокая, то есть он обнаруживается у большинства больных с астмой, а специфичность средняя, то есть, помимо астмы, эозинофилы в мокроте встречаются и при других заболеваниях.
В мокроте нередко определяются спирали Куршмана – извитые трубочки, образующиеся из бронхиальной слизи при спазме бронхов. В них вкраплены кристаллы Шарко-Лейдена – образования, которые состоят из белка, образующегося при распаде эозинофилов. Таким образом, два этих признака говорят о снижении бронхиальной проходимости, вызванном аллергической реакцией, что часто и наблюдается при астме.
Кроме того, в мокроте оценивается наличие атипичных клеток, характерных для рака, и микобактерий туберкулеза.
Анализ крови на общий IgE показывает уровень в крови этого иммуноглобулина, который вырабатывается в ходе аллергической реакции. Он может быть повышен при многих аллергических заболеваниях, но и нормальное его количество не исключает бронхиальную астму и другие атопические процессы. Поэтому гораздо более информативным является определение в крови специфических IgE – антител к конкретным аллергенам.
Для анализа на специфические IgE используются так называемые панели – наборы аллергенов, с которыми реагирует кровь больного. Тот образец, в котором содержание иммуноглобулина будет выше нормы (у взрослых это 100 ед/мл), и покажет причинно-значимый аллерген. Используются панели шерсти и эпителия разных животных, бытовые, грибковые, пыльцевые аллергены, в некоторых случаях – аллергены лекарств и пищевые.
Для выявления аллергенов применяются и кожные пробы. Их можно проводить у детей любого возраста и у взрослых, они не менее информативны, чем определение IgE в крови. Кожные пробы хорошо себя зарекомендовали в диагностике профессиональной астмы. Однако при этом существует риск внезапной тяжелой аллергической реакции (анафилаксии). Результаты проб могут меняться под действием антигистаминных препаратов. Их нельзя проводить при кожной аллергии (атопическом дерматите, экземе).
Пульсоксиметрия – исследование, проводимое с помощью небольшого прибора – пульсоксиметра, который обычно надевается на палец пациента. Он определяет насыщение артериальной крови кислородом (SpO2). При снижении этого показателя менее 92% следует выполнить исследование газового состава и кислотности (рН) крови. Снижение уровня насыщения крови кислородом свидетельствует о тяжелой дыхательной недостаточности и угрозе для жизни больного. Определяемое при исследовании газового состава снижение парциального давления кислорода и увеличение парциального давления углекислого газа свидетельствует о необходимости искусственной вентиляции легких.
Наконец, определение оксида азота в выдыхаемом воздухе (FENO) у многих больных с астмой выявляет увеличение этого показателя выше нормы (25 ppb). Чем сильнее воспаление в дыхательных путях и больше доза аллергена, тем показатель выше. Однако такая же ситуация бывает и при других болезнях легких.
Таким образом, специальные лабораторные методы диагностики астмы – кожные пробы с аллергенами и определение в крови уровня специфических IgE.
Методы функциональной диагностики бронхиальной астмы включают:
- исследование вентиляционной функции легких, то есть способности этого органа доставлять необходимое количество воздуха для газообмена;
- определение обратимости бронхиальной обструкции, то есть снижения проходимости бронхов;
- выявление гиперреактивности бронхов, то есть их склонности к спазму под действием вдыхаемых раздражителей.
Основной метод исследования при бронхиальной астме – спирометрия, или измерение дыхательных объемов и скоростей воздушных потоков. С него обычно начинается диагностический поиск еще до начала лечения больного.
Главный анализируемый показатель – ОФВ1, то есть объем форсированного выдоха за секунду. Проще говоря, это количество воздуха, которое человек способен быстро выдохнуть в течение 1 секунды. При спазме бронхов воздух выходит из дыхательных путей медленнее, чем у здорового человека, показатель ОФВ1 снижается.
Если при первичной диагностике уровень ОФВ1 составляет 80% и больше от нормальных показателей, это говорит о легком течении астмы. Показатель, равный 60 – 80% от нормы, появляется при астме средней тяжести, менее 60% – при тяжелом течении. Все эти данные применимы только к ситуации первичной диагностики до начала терапии. В дальнейшем они отражают не тяжесть астмы, а уровень ее контроля. У людей с контролируемой астмой показатели спирометрии в пределах нормы.
Таким образом, нормальные показатели функции внешнего дыхания не исключают диагноз «бронхиальная астма». С другой стороны, снижение бронхиальной проходимости обнаруживается, например, при хронической обструктивной болезни легких (ХОБЛ).
Если обнаружено снижение бронхиальной проходимости, то важно выяснить, насколько оно обратимо. Временный характер бронхоспазма – важное отличие астмы от того же хронического бронхита и ХОБЛ.
Итак, при снижении ОФВ1 для выявления обратимости бронхиальной обструкции проводятся фармакологические тесты. Пациенту дают препарат посредством дозированного аэрозольного ингалятора, чаще всего 400 мкг сальбутамола, и через определенное время снова проводят спирометрию. Если показатель ОФВ1 увеличился после использования бронхолитика на 12% и больше (в абсолютных цифрах на 200 мл и больше), говорят о положительной пробе с бронходилататором. Это означает, что сальбутамол эффективно снимает спазм бронхов у данного пациента, то есть бронхиальная обструкция у него непостоянна. Если показатель ОФВ1 увеличивается менее чем на 12%, это признак необратимого сужения бронхиального просвета, а если он уменьшается, это говорит о парадоксальном спазме бронхов в ответ на использование ингалятора.
Прирост ОФВ1 после ингаляции сальбутамола на 400 мл и больше дает практически полную уверенность в диагнозе «бронхиальная астма». В сомнительных случаях может быть назначена пробная терапия ингаляционными глюкокортикоидами (беклометазон по 200 мкг 2 раза в день) в течение 2 месяцев или даже таблетками преднизолона (30 мг/сут) в течение 2 недель. Если показатели бронхиальной проходимости после этого улучшаются – это говорит в пользу диагноза «бронхиальная астма».
В некоторых случаях даже при нормальных показателях ОФВ1 применение сальбутамола сопровождается приростом его величины на 12% и больше. Это говорит о скрытой бронхиальной обструкции.
В других случаях нормальной величины ОФВ1 для подтверждения гиперреактивности бронхов применяют ингаляционную пробу с метахолином. Если она будет отрицательной, это может служить причиной для исключения диагноза астмы. Во время исследования пациент вдыхает возрастающие дозы вещества, и определяется минимальная концентрация, которая вызывает снижение ОФВ1 на 20%.
Применяются и другие пробы для выявления гиперреактивности бронхов, например, с маннитолом или физической нагрузкой. Падение ОФВ1 в результате использования этих проб на 15% и более с высокой степенью достоверности указывает на бронхиальную астму. Проба с физической нагрузкой (бег в течение 5 – 7 минут) широко применяется для диагностики астмы у детей. Применение ингаляционных провокационных проб у них ограничено.
Еще один важнейший метод инструментальной диагностики астмы и контроля за ее лечением – пикфлоуметрия. Пикфлоуметр должен быть у каждого пациента с этим заболеванием, ведь самоконтроль – основа эффективной терапии. С помощью этого небольшого аппарата определяют пиковую скорость выдоха (ПСВ) – максимальную скорость, с которой пациент может выдохнуть воздух. Этот показатель, так же как и ОФВ1, прямо отражает бронхиальную проходимость.
ПСВ можно определять у больных начиная с 5-летнего возраста. При определении ПСВ делается три попытки, записывается лучший показатель. Измеряют величину показателя утром и вечером каждого дня, а также оценивают его вариабельность – разницу между минимальным и максимальным значениями, полученными в течение дня, выраженную в процентах от максимальной величины за день и усредненную за 2 недели регулярных наблюдений. Для людей с бронхиальной астмой характерна повышенная вариабельность показателей ПСВ – более 20% при четырех измерениях в течение дня.
Показатель ПСВ используется преимущественно у людей с уже установленным диагнозом. Он помогает держать астму под контролем. В течение наблюдений определяют максимальный лучший показатель для данного больного. Если отмечается снижение до 50 – 75% от наилучшего результата – это говорит о развивающемся обострении и необходимости усилить интенсивность лечения. При снижении ПСВ до 33 – 50% от лучшего для пациента результата диагностируют тяжелое обострение, а при более значительном уменьшении показателя возникает угроза жизни больного.
Определяемый дважды в день показатель ПСВ нужно записывать в дневник, который приносят на каждый прием к врачу.
В некоторых случаях проводятся дополнительные инструментальные обследования. Рентгенография легких выполняется в таких ситуациях:
- наличие эмфиземы легких или пневмоторакса;
- вероятность воспаления легких;
- обострение, несущее угрозу жизни больного;
- неэффективность лечения;
- необходимость искусственной вентиляции легких;
- неясный диагноз.
У детей младше 5 лет используется компьютерная бронхофонография – метод исследования, основанный на оценке дыхательных шумов, и позволяющий выявить снижение бронхиальной проходимости.
При необходимости дифференциальной диагностики с другими заболеваниями выполняют бронхоскопию (осмотр бронхиального дерева с помощью эндоскопа при подозрении на рак бронхов, инородное тело дыхательных путей) и компьютерную томографию органов грудной клетки.
О том, как проводится исследование функции внешнего дыхания:
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Для цитирования. А.А. Зайцев. Бронхиальная астма у взрослых: ключевые вопросы диагностики и фармакотерапии // РМЖ. 2015. № 18. С. 1096–1100.
Бронхиальная астма (БА) относится к числу наиболее распространенных и социально значимых заболеваний человека. Так, среди взрослого населения европейских стран распространенность БА составляет 6–9%, в США – 11% [1–5]. Согласно официальной статистике, распространенность астмы в России составляет около 3%. В то же время результаты отдельных эпидемиологических исследований позволяют уточнить истинную распространенность БА в Москве – 6,4%, Екатеринбурге – 6,2%, Иркутске – 5,6%. Экспертами Российского респираторного общества признается, что распространенность БА среди детей составляет от 5,6 до 12,1%, а среди взрослых – 5,6–7,3%. В абсолютных цифрах можно предположить, что в России общее число больных БА составляет как минимум 7 млн человек [6, 7].
Проблема усугубляется тем, что больные БА нуждаются в продолжительной медицинской помощи, что требует больших экономических затрат. В развитых странах затраты на ведение пациентов с БА составляют 1–2% от бюджетных средств, выделяемых на здравоохранение. Экономическое бремя БА связано не только с высокими расходами на лечение, но и с затратами, связанными с потерей работоспособности и снижением качества жизни больных [1]. Согласно российским данным, общие расходы на ведение больных БА в 2007 г. составили более 11 млрд руб. [8]. Из них порядка 6 млрд руб. составляют расходы на оказание неотложной помощи и стационарное лечение пациентов в связи с обострением заболевания или ухудшением состояния из-за недостаточно эффективной терапии. Очевидный рост затрат вследствие неадекватной базисной терапии подтверждается целым рядом исследований [9–11]. Таким образом, рациональный выбор терапии для достижения и поддержания контроля над клиническими проявлениями БА является чрезвычайно важной задачей [12–14].
Типичные симптомы БА, отмечаемые большинством пациентов, включают: экспираторную одышку, свистящее дыхание, кашель и заложенность в груди [12]. Наиболее часто симптомы БА проявляются ночью или сразу после пробуждения, а также после физической нагрузки, что зачастую приводит к ограничению физической активности пациентов. Важным этапом клинической оценки БА является оценка внелегочных проявлений аллергии – прежде всего аллергического ринита, конъюнктивита, атопического дерматита. Диагноз БА устанавливается на основании жалоб и анамнестических данных пациента, клинико-функционального обследования с оценкой обратимости бронхиальной обструкции, специфического аллергологического обследования (кожные тесты с аллергенами и/или специфический иммуноглобулин класса Е (IgЕ) в сыворотке крови) и исключения других заболеваний. Важнейшим фактором диагностики является тщательный сбор анамнеза, который укажет на причины возникновения, продолжительность и разрешение симптомов, наличие аллергических реакций у пациента и его кровных родственников, причинно-следственные особенности возникновения признаков болезни и ее обострений.
Начало заболевания БА в большинстве случаев приходится на детский и юношеский возраст. Однако дебют болезни может быть в любом возрасте, и начало болезни у взрослых и даже пожилых пациентов не является редкостью. Вместе с тем бронхообструктивный синдром, впервые развившийся в пожилом возрасте, требует проведения дифференциальной диагностики с целым рядом сходных по клиническому течению заболеваний (хроническая обструктивная болезнь, тромбоэмболия легочной артерии, острая левожелудочковая недостаточность, опухолевый процесс в легких и др.). Важно установить связь появления симптомов БА после контакта с аллергеном, сезонную вариабельность симптомов, сочетание с ринитом, наличие в семейном анамнезе атопии или БА. Иногда встречается кашлевой вариант БА, когда единственным проявлением заболевания является кашель, беспокоящий преимущественно в ночные часы.
Клинические признаки, повышающие вероятность наличия БА [12]:
1) наличие более одного из следующих симптомов: хрипы, удушье, чувство заложенности в грудной клетке и кашель, особенно в случаях ухудшения симптомов ночью и рано утром; возникновение симптомов при физической нагрузке, воздействии аллергенов и холодного воздуха; возникновение симптомов после приема ацетилсалициловой кислоты или β-блокаторов;
2) наличие атопических заболеваний в анамнезе;
3) наличие астмы и/или атопических заболеваний у родственников;
4) распространенные сухие свистящие хрипы при аускультации;
5) низкие показатели пиковой скорости выдоха (ПСВ) или объема форсированного выдоха за 1 с (ОФВ1) (ретроспективно или в серии исследований), необъяснимые другими причинами;
6) эозинофилия периферической крови, необъяснимая другими причинами.
Специальные методы диагностики БА включают исследование вентиляционной функции легких с оценкой обратимости бронхиальной обструкции, выявление бронхиальной гиперреактивности, проведение специфического аллергологического обследования. При проведении спирометрии важным параметром является ОФВ1, указывающий на степень бронхиальной обструкции. Бронходилатационный тест считается положительным, если после ингаляции бронходилататора величина прироста ОФВ1 составляет ≥12% от должного или абсолютный прирост составляет 200 мл и более (для заключения о положительном тесте обязательно достижение обоих критериев). У пациентов с показателями спирометрии в пределах нормы следует провести дополнительное исследование для выявления бронхиальной гиперреактивности – ингаляционный тест с метахолином. Тест является высокочувствительным, поэтому положительный результат является подтверждением БА. Мониторирование ПСВ используется для выявления повышенной суточной вариабельности показателей, характерных именно для БА (вариабельность показателей ПСВ или >30% в течение 1 сут). Характерным признаком БА является эозинофилия периферической крови (более 0,4х109/л), в анализах мокроты обнаруживаются также эозинофилы, кристаллы Шарко – Лейдена, спирали Куршмана. Среди дополнительных тестов стоит упомянуть аллергологическое обследование, позволяющее выявить чувствительность к различным аллергенам, определение общего и специфических IgE. Проба с физической нагрузкой используется для подтверждения БА у детей и подростков. После 7-минутных упражнений более чем у 90% детей с БА наблюдается снижение ОФВ1.
В зависимости от факторов, провоцирующих обострение, выделяют различные клинические формы БА: аллергическая (атопическая), аспириновая, астма физического усилия и др. Аллергические механизмы имеют преобладающее значение (
80% случаев) в развитии детской астмы и обнаруживаются более чем в 50% случаев у взрослых. Такая астма нередко сочетается с аллергическим ринитом, конъюнктивитом и дерматитом. Отмечается гиперчувствительность к различным аллергенам. Для аспириновой астмы характерна триада симптомов: БА, полипозный риносинусит и непереносимость нестероидных противовоспалительных препаратов. Астма физического усилия характерна для молодого и детского возраста (приступ бронхоспазма провоцируется физической активностью – ходьбой, бегом и т. д., причем симптомы возникают не во время действия фактора, а через 5–30 мин после него. Нередко провоцирующим фактором обострения БА является вирусная инфекция, поэтому говорят об инфекционно-зависимой астме. В ряде случаев выделить какой-либо механизм не представляется возможным, поэтому в клинических диагнозах встречается термин «смешанная форма БА».
По степени тяжести БА делится на интермиттирующую и персистирующую (легкой, средней и тяжелой степени тяжести) (табл. 1).
В руководстве GINA (The Global Initiative for Asthma) в настоящее время рекомендована 3-уровневая классификация БА по уровню контроля клинических признаков и характеристике внешнего дыхания (контролируемая, частично контролируемая и неконтролируемая БА) (табл. 2). Такой подход лучше описывает состояние болезни на фоне проводимых лечебных мероприятий, отражает понимание того, что тяжесть БА зависит не только от выраженности симптомов заболевания, но и от ответа на терапию.
Целями фармакотерапии БА являются достижение и поддержание клинического контроля над заболеванием в течение длительного периода времени с учетом безопасности терапии, потенциальных нежелательных реакций и стоимости лечения [12, 14–15]. Увеличение потребности в препаратах неотложной помощи, особенно ежедневное их использование, указывает на утрату контроля над БА и необходимость пересмотра терапии. Если текущая терапия не обеспечивает контроля над БА, необходимо увеличивать объем терапии до достижения контроля. В случае достижения частичного контроля над БА следует рассмотреть возможность увеличения объема терапии с учетом наличия более эффективных подходов к лечению, их безопасности, стоимости и удовлетворенности пациента достигнутым уровнем контроля. При сохранении контроля над БА в течение 3 мес. и более возможно уменьшение объема поддерживающей терапии с целью установления минимального объема терапии и наименьших доз препаратов, достаточных для поддержания контроля.
Фармакотерапия БА включает в себя 2 вида препаратов: препараты неотложной помощи (купирование бронхоспазма) и препараты для базисной («поддерживающей») терапии. К первым относятся β2-агонисты короткого и длительного действия (сальбутамол, фенотерол, формотерол), ингаляционные антихолинергические препараты (ипратропия бромид, тиотропия бромид). Препараты базисной терапии: ингаляционные глюкокортикостероиды (ИГКС) и системные кортикостероиды, комбинированные препараты (пролонгированные β2-агонисты + ИГКС), пролонгированные теофиллины, антагонисты лейкотриеновых рецепторов и антитела к IgE.
ИГКС являются препаратами первой линии в терапии БА, они показаны для лечения персистирующей БА любой степени тяжести [12–14]. ИГКС, составляющие основу базисной противовоспалительной терапии БА, предотвращают развитие симптомов и обострений болезни, улучшают функциональные показатели легких. Раннее назначение ИГКС может улучшить контроль БА и нормализовать функцию легких, а также предотвратить развитие необратимого поражения дыхательных путей. В клинической практике применяются следующие ИГКС: беклометазона дипропионат (БДП), будесонид, флютиказона пропионат, мометазона фуроат и циклесонид.
Отдельной строкой необходимо выделить, что в лечении среднетяжелой и тяжелой БА наиболее эффективной и перспективной является комбинация ИГКС и длительно действующего β2-агониста (ДДБА) [12–14]. В настоящее время в клинической практике применяются следующие фиксированные комбинации ИГКС+ДДБА: салметерол+флутиказон, формотерол+будесонид, формотерол+беклометазон. По результатам ряда исследований показано, что комбинация ДДБА+ИГКС эффективнее увеличенных доз ИГКС, быстрее позволяет достигнуть контроля над симптомами БА, и при использовании комбинированного препарата отмечается снижение количества обострений. Так, исследование GOAL [16] продемонстрировало преимущества комбинированной терапии ИГКС+ДДБА в достижении контроля над симптомами заболевания при среднетяжелой и тяжелой БА по сравнению с монотерапией ИГКС. В авторитетном исследовании N. Barnes et al. было показано, что при персистирующей БА терапия с использованием комбинации флутиказон/салметерол оказалась более эффективной по сравнению с монотерапией флутиказоном [17]. В метаанализе, включившем более 20 тыс. пациентов с персистирующей БА, применение комбинированного препарата салметерол/флутиказон сопровождалось снижением риска обострений заболевания, риска госпитализаций по сравнению с монотерапией ИГКС [18].
Таким образом, в целом ряде клинических исследований было доказано, что добавление ДДБА к низким и средним дозам ИГКС обеспечивает лучший клинический эффект, чем увеличение дозы ИГКС, что в конечном итоге легло в основу современной стратегии ведения больных с БА [12–14].
Очевидно, что большим преимуществом фиксированных комбинаций является не только их высокая эффективность в достижении контроля над симптомами БА, но и хорошая комплаентность за счет соединения 2-х лекарственных средств в одном ингаляторе. Стоит отметить, что представленные на российском фармацевтическом рынке оригинальные комбинированные препараты обладают достаточно высокой стоимостью, но появление в настоящее время дженерических форм, безусловно, расширяет возможности их применения в реальной клинической практике.
Так, в начале 2015 г. в России зарегистрирован препарат Сальмекорт – фиксированная комбинация салметерол+флутиказон в форме дозированного аэрозольного ингалятора (ДАИ) в дозировках 25/50, 25/125 и 25/250 мкг. Клиническая эффективность и безопасность Сальмекорта в сравнении с оригинальным препаратом в форме аэрозоля для ДАИ изучались в рамках клинического исследования, включившего 107 больных с персистирующей БА и нуждающихся в комбинированной терапии высокими дозами ИГКС+ДДБА [19, 20]. Препараты применялись в дозе 25/250 мкг по 2 ингаляции 2 р./сут, продолжительность наблюдения за больными составила 12 нед. В группу больных, получавших Сальмекорт, вошли 56 пациентов, группу сравнения (оригинальный препарат) составил 51 больной с БА. В ходе исследования Сальмекорт продемонстрировал сравнимые с оригинальным препаратом эффективность и безопасность. Так, количество пациентов с положительным ответом на лечение по данным спирометрии составило 35 (64,81%) в группе Сальмекорта и 25 (49,02%) – в группе больных, получавших оригинальный препарат (табл. 3).
При анализе контроля над симптомами БА с использованием опросника АСТ – теста по контролю над астмой (Asthma Control Test) в обеих группах был отмечен значимый прирост показателей на фоне лечения, при этом количество пациентов с приростом оценки как минимум на 1 балл составило 45 в группе Сальмекорта и 40 – в группе сравнения (табл. 4).
В ходе исследования пациенты указывали на уменьшение общего количества приступов БА. При сравнительном анализе оказалось, что статистически значимое уменьшение общего количества приступов астмы наблюдалось в группе больных, получавших Сальмекорт. Анализ частоты развития нежелательных явлений не выявил статистически значимой разницы между группами. Нежелательные явления были зарегистрированы у 9 (16,1%) пациентов, получавших Сальмекорт, и у 3 больных (5,88%) в группе сравнения.
Таким образом, практические врачи располагает теперь более широкими возможностями для базисной терапии БА.
Возвращаясь к принципам терапии, необходимо отметить, что системные глюкокортикостероиды не рекомендуются для поддерживающей терапии БА из-за развития побочных эффектов. Эти препараты применяются для лечения тяжелых обострений БА. Теофиллины длительного действия могут быть использованы в качестве препаратов второй линии у пациентов с персистирующей БА. Анти-IgE-препараты – новый класс лекарственных средств, используемых в настоящее время для улучшения контроля над тяжелой персистирующей атопической БА. В числе наиболее изученных препаратов стоит упомянуть омализумаб. Его применение наиболее оправданно у больных с высоким сывороточным уровнем IgE, нуждающихся в повторных госпитализациях, экстренной медицинской помощи, применяющих высокие дозы ингаляционных и/или системных глюкокортикостероидов.
Для достижения контроля над симптомами БА рекомендован принцип ступенчатой терапии [12]. Каждая ступень включает варианты лечения, которые могут служить альтернативой при выборе поддерживающей терапии БА. У большинства больных с симптомами персистирующей БА, не получавших терапии, следует начинать лечение со ступени 2. Если симптомы БА при первичном осмотре указывают на отсутствие контроля (табл. 5), то лечение необходимо начинать со ступени 3. Если лечение неэффективно или ответ на него недостаточен, проверьте технику ингаляции, соблюдение назначений, уточните диагноз и оцените сопутствующие заболевания. При принятии решения, дозу какого препарата снижать первой и с какой скоростью, должны быть приняты во внимание тяжесть астмы, побочные эффекты лечения, продолжительность приема текущей дозы, достигнутый положительный эффект и предпочтения пациента. Снижение дозы ингаляционных стероидов должно быть медленным в связи с возможностью развития обострения. При достаточном контроле возможно снижение дозы каждые 3 мес., примерно от 25 до 50%.
источник
 Прослушивание проходит через стетоскоп, стетофонендоскоп или фонендоскоп, причем последний наиболее подходит для изучения звуков, издаваемых грудной клеткой при астме. Если происходит обострение, свист и характерные хрипы слышны по всей легочной поверхности, но при ремиссии свистящий хрип слышен снизу от лопаток и то только при усиленном вдохе.
Прослушивание проходит через стетоскоп, стетофонендоскоп или фонендоскоп, причем последний наиболее подходит для изучения звуков, издаваемых грудной клеткой при астме. Если происходит обострение, свист и характерные хрипы слышны по всей легочной поверхности, но при ремиссии свистящий хрип слышен снизу от лопаток и то только при усиленном вдохе. если в анализе крови отсутствуют признаки воспалительных процессов и токсинов, выделяемых бактериями, то при наличии астматических симптомов доктору легче отличить астму от обычного бронхита или пневмонии;
если в анализе крови отсутствуют признаки воспалительных процессов и токсинов, выделяемых бактериями, то при наличии астматических симптомов доктору легче отличить астму от обычного бронхита или пневмонии;
