В разных странах мира бронхиальная астма (БА) занимает лидирующие позиции среди аллергических заболеваний органов дыхания, как среди взрослого населения, так и у детей. При данной патологии наблюдается развитие синдрома гиперчувствительности и гиперреактивности на аллергены и неспецифические агенты, ирританты. Хроническое воспаление обуславливает возникновение повторяющихся приступов обструкции бронхов, обратимых спонтанно либо в результате лечения.
В результате различных исследований становится понятным, что существуют различные фенотипы бронхиальной астмы, имеющие определенные клинические и биологические характеристики. Актуальность выделения определенных фенотипов этого заболевания объясняется тем, что именно эти данные должны являться основой для лечения и разработки индивидуальных схем терапии.
Фенотипирование бронхиальной астмы основывается на выявлении доминирующего подтипа воспаления и биологических маркеров, которые присутствуют либо в моноварианте, либо дополняют друг друга. С атопической формой бронхиальной астмы связывают эозинофильный фенотип, при котором наблюдается эозинофильная клеточная инфильтрация. В основе патогенеза при этом лежит активация эозинофилов в очаге воспаления и выброс агрессивных медиаторов, которые являются биологическими маркерами данного воспалительного процесса.
Известно, что уровень эозинофилов в крови при аллергии увеличивается до 10-20%, что получило название «эозинофилия». В гранулах эозинофилов содержатся белки, основными являются цитотоксин и нейроцитотоксин. Эти белки способны повреждать собственные клетки организма. В результате активации эозинофилов из гранул высвобождаются медиаторы аллергических реакций, а также цитокины: ИЛ-4, ИЛ-5, ИЛ-10, ИЛ-12, ИЛ-13, ГМ-КСФ и ФНОα.
Помимо этого эти клетки несут на своей поверхности рецепторы для С4, С3, С3b компонентов комплемента, а также для Fc-фрагментов IgG, IgE. CD23 является низкоаффинным рецептором для IgE. Большая часть IgE связана с рецепторами, несвязанная — циркулирует в сыворотке крови, где и определяют уровень общего IgE. Экспрессия рецепторов на клетках, как и концентрация иммуноглобулинов в крови при аллергическом процессе меняется. Взаимоотношение «Fc-рецептор-иммуноглобулин» определяет их уровень в крови и на клетках, и от этого зависит развитие патологического процесса.
Несмотря на имеющиеся в литературе данные, четких клинических и иммунологических критериев определенных фенотипов не разработано, что является необходимым для дифференцированного подхода к выбору терапии и профилактики бронхиальной астмы. Цель работы — характеристика эозинофильного фенотипа бронхиальной астмы у детей.
В обследование включено 160 детей в возрасте от 5 до 18 лет. 130 пациентов наблюдались по поводу атопической бронхиальной астмы. Диагноз установлен на основании международных рекомендаций, подтвержден данными анамнеза, клинической картиной заболевания, результатами аллергологических и инструментальных исследований. Контрольную группу составили 30 здоровых детей обоих полов 5-18 лет, не имеющих аллергических заболеваний. В ходе работы определяли следующие показатели: относительный и абсолютный уровень эозинофилов, уровень эозинофилов, несущих FcεRI+ и CD23+IgE+ рецепторы, уровень общего IgE.
Фенотипирование клеток проводили на проточном цитометре Cytomics FC 500 (Beckman Coulter Inc., США) с использованием моноклональных антител производства ОДО «НИКП РЕСАН», Беларусь. Для лизиса эритроцитов использовали лизирующий раствор OptiLyse С.
У детей с бронхиальной астмой, имеющих высокий уровень эозинофилов, изучали анамнез жизни и заболевания, наследственность, особенности клинической картины бронхиальной астмы, оценивали результаты аллергологического исследования. Аллергологическое обследование включало проведение кожных скарификационных проб (КСП), а также определение специфических IgE-антител в сыворотке крови к бытовым (клещ постельный Dermatophagoides pteronyssinus) и эпидермальным (шерсть кошки, шерсть собаки) аллергенам.
Статистическую обработку данных проводили с использованием стандартного пакета прикладных программ «Statistica 6.0». Критерий Шапиро-Уилка применяли для принятия решения о виде распределения количественного признака. Для описания признака распределение, которого отличается от нормального использовали медиану и интерквартильный интервал. Использовались непараметрические методы статистического исследования: критерий Манна-Уитни (для анализа различий в двух независимых группах по количественному признаку). Различия считали достоверными при р
источник
Эозинофильная астма является формой астмы, связанной с высоким уровнем лейкоцитов, называемых эозинофилами.
В Соединенных Штатах (США), по оценкам, 25,7 млн. Человек имеют определенную форму астмы, а 15% из них имеют тяжелую астму, которую трудно контролировать со стандартными лекарствами.
Эозинофильная астма считается основной причиной тяжелой астмы, затрагивающей от 50 до 60 процентов людей с тяжелой формой заболевания.
В популяции в целом эозинофильная астма встречается редко, затрагивая только 5 процентов взрослых с астмой.
Эозинофильная астма походит на другие формы астмы в том, что люди с состоянием страдают от воспаленных дыхательных путей, заблокированных жидкостью и слизью, и испытывают спазмы, которые затрудняют дыхание.
Однако, в отличие от других видов астмы, эозинофильная астма включает аномально высокие уровни определенного типа лейкоцитов, называемых эозинофилами.
Эозинофилы являются частью иммунной системы и помогают организму бороться с инфекцией. Однако высокие уровни эозинофилов могут вызывать воспаление в дыхательных путях, влияя на пазухи и носовые ходы, а также на нижние дыхательные пути.
В целом, по мере увеличения уровня эозинофилов, воспаление и другие симптомы астмы становятся более серьезными.
Эта форма астмы чаще всего развивается у людей в возрасте от 25 до 35 лет. Люди с эозинофильной астмой обычно не страдают аллергией. Это состояние может быть трудно поддающимся лечению и может оказать негативное влияние на качество жизни человека.
Конкретная причина эозинофильной астмы не выявлена. В то время как другие формы астмы вызваны аллергическими реакциями на факторы окружающей среды, такие как пыльца или волосы для животных, эозинофильная астма не развивается таким образом.
Высокие уровни эозинофилов могут развиваться, когда организм борется с паразитарной инфекцией, но ученые пока не определили, что заставляет эти уровни спадать в случаях эозинофильной астмы.
Астма может работать в семьях, поэтому исследователи изучают возможность генетической связи. Однако никакой прямой генетической связи не обнаружено при эозинофильной астме.
Симптомы эозинофильной астмы включают:
- сбивчивое дыхание
- хрипящий
- герметичность в сундуке
- кашляющий
- препятствующий воздушный поток
- заложенный нос
- носовой дренаж
- хронические инфекции синуса
- аносмия или потерянное обоняние
- носовые полипы
Лица должны видеть врача, если они часто испытывают:
- сбивчивое дыхание
- кашляющий
- хрипящий
- герметичность в сундуке
Быстрое и последовательное лечение эозинофильной астмы важно, так как воспаление дыхательных путей может привести к постоянным повреждениям, таким как утолщение стенок дыхательных путей или рубцевание ткани легкого.
Людям с астмой рекомендуется обращаться к врачу не реже одного раза в год, чтобы убедиться, что их план лечения эффективен. Симптомы, требующие немедленной медицинской помощи, включают:
- головокружение или ощущение слабости
- свистящее дыхание во время дыхания
- затруднение в повседневной деятельности
Человек должен обратиться за неотложной помощью, если возникнет какой-либо из этих симптомов:
- быстродействующий препарат не оказывает никакого облегчения через 15 минут
- затруднение в разговоре или ходьба в обычном темпе
- губы или гвозди становятся синими
- принимая более 30 вдохов в минуту
- дыхание вызывает появление ноздрей, а горло и ребра — растянутые
Первым шагом в диагностике эозинофильной астмы является диагностика тяжелой астмы. Следующие шаги включают в себя оценку:
- одышка с упражнением
- дыхательные пути, которые остаются заблокированными
- ограниченный поток воздуха
- хроническая синусовая болезнь
- носовые полипы
- ответ на системные стероидные препараты, такие как пероральные кортикостероиды
Тем не менее, определяющим фактором в диагностике эозинофильной астмы является обнаружение высоких уровней эозинофилов. Врач может измерять эти уровни, анализируя кровь человека, мокроту или слюну или проводя бронхиальную биопсию.
Исследователи отметили, что симптомы эозинофильной астмы отличаются от классической астмы и, по сути, более напоминают симптомы хронического легочного обструктивного расстройства (ХОБЛ).
По оценкам, 8,4% населения США имеет какую-то астму. Однако, поскольку ученые больше узнают о состоянии, они обнаруживают, что «астма» может быть зонтичным термином, описывающим ряд различных хронических респираторных заболеваний.
Каждое из этих состояний, включая эозинофильную астму, требует определенной формы лечения.
До недавнего времени пероральные кортикостероиды были стандартным лечением для эозинофильной астмы. Хотя многие люди хорошо реагируют на эти лекарства, они не всегда успешно контролируют это заболевание. Некоторые люди также стали зависимыми от этого лекарства.
Новые методы лечения, называемые биологической терапией, теперь используются для лечения этого состояния. Лекарства, известные как антагонисты лейкотриена, также могут быть использованы для уменьшения воспаления.
В дополнение к этим лекарствам от астмы, антибиотики могут использоваться для лечения синусовых инфекций, которые часто сопровождают эту форму астмы.
Люди с эозинофильной астмой также могут испытывать:
- хронические инфекции синуса
- носовые полипы
- эозинофильный средний отит, внутренняя ушная инфекция
- респираторное заболевание, вызванное аспирином
Кроме того, это состояние также связано с другими состояниями, характеризующимися высокими уровнями эозинофилов. Хотя заболевания, связанные с эозинофилом, встречаются редко, они растут во всем мире, особенно когда они атакуют желудочно-кишечную систему.
Хотя связь между эозинофилами и астмой известна с 1889 года, исследователи продолжают исследовать лучший способ лечения эозинофильной астмы.
Продолжающаяся разработка новых методов лечения значительно улучшила перспективы для людей с этим заболеванием.
Люди с этим состоянием часто имеют частые вспышки и могут сильно зависеть от пероральных кортикостероидов, которые имеют серьезные побочные эффекты. Болезнь может быть даже смертельной.
Благодаря новым вариантам лечения это не обязательно. Тем не менее, люди с эозинофильной астмой должны придерживаться своего плана лечения и заниматься самообслуживанием, чтобы сохранить себя в лучшем состоянии здоровья.
источник
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
В медицинской практике под эозинофилией понимают состояние крови, при котором наблюдается повышение уровня особых клеток крови – эозинофилов. При этом наблюдается также инфильтрация (пропитывание) других тканей эозинофилами. Например, при аллергическом насморке эозинофилы можно обнаружить в отделяемом секрете из носа, при бронхиальной астме с бронхитом – в мокроте, при скоплении крови в легких или опухолях плевры – в легочной жидкости.
У взрослого человека нормальным считается количество эозинофилов в крови от 0,02х10 9 /л до 0,3х10 9 /л.
Выделяют следующие степени эозинофилии:
1. Небольшая – до 10% от общего количества лейкоцитов.
2. Умеренная – 10-20%.
3. Высокая – свыше 20%.
Стойкая эозинофилия – это чаще всего признак глистных поражений, аллергических реакций, некоторых лейкозов.
Эозинофилия является не самостоятельным заболеванием, а признаком (симптомом) многих инфекционных, аутоиммунных, аллергических и других заболеваний. Их список довольно широк.
Итак, рассмотрим основные причины развития эозинофилии.
1.Аутоиммунные и реактивные заболевания.
При этих болезнях чаще всего, наряду с повышением эозинофилов, отмечаются:
- анемия;
- гепатоспленомегалии (увеличение селезенки и печени);
- снижение веса;
- фиброз легких;
- повышение температуры;
- воспалительные поражения артерий и вен;
- застойная сердечная
- недостаточность;
- боль в суставах;
- полиорганная недостаточность.
2.Глистные и другие паразитарные инвазии.
Помимо повышения содержания эозинофилов, при данных заболеваниях наблюдается:
- лимфаденопатия – увеличение, болезненность лимфатических узлов;
- гепатоспленомегалия – увеличение печени и селезенки;
- симптомы общей интоксикации: тошнота, слабость, снижение аппетита, головные боли и головокружение, повышение температуры тела;
- миалгии (боль в мышцах), боли в суставах;
- синдром Леффлера при миграции личинок (кашель с астматическим компонентом, боль в груди, одышка);
- может быть учащение пульса, гипотония, отеки на лице и веках, сыпь на кожных покровах.
3.Аллергические и кожные болезни.
Появление уртикарной сыпи (волдыри), зуд, сухость кожных покровов или мокнутие, вплоть до образования язв на коже, отслоение эпидермиса.
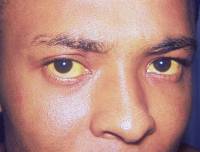
Поскольку многие заболевания пищеварительной системы приводят к нарушению микрофлоры кишечника, замедляется процесс очищения организма от шлаков, что и приводит к повышенному содержанию эозинофилов. При таких дисбактериозах пациента могут беспокоить рвота и тошнота после приема пищи, боль в околопупочной области, диарея, судороги, признаки гепатита (желтуха, увеличение печени и ее болезненность).
5. Заболевания крови.
Для системного гистиоцитоза на фоне эозинофилии характерны частые инфекционные заболевания, увеличение печени и селезенки, поражение лимфоузлов, кашель, цианоз кожных покровов (синюшное окрашивание), диспноэ (затрудненное дыхание).
Наряду с эозинофилией, при лимфогранулематозе отмечаются лихорадка, боли в костях и суставах, слабость, зуд на большей части поверхности кожи, лимфаденопатия, увеличение печени и селезенки, может быть кашель.
Эозинофилия при неходжкинских лимфомах сопровождается также повышением температуры, слабостью, снижением массы тела и двигательной активности, а также симптомами, характерными для поражения определенных областей. Так, при появлении опухоли в брюшной области отмечают такие симптомы, как жажда, увеличение живота, кишечную непроходимость. Со стороны ЦНС – головные боли, параличи и парезы, снижение зрения и слуха. Могут возникать боли за грудиной, кашель, отек лица, нарушение глотания.
Под этим термином понимают инфильтрацию (пропитывание) легочной ткани эозинофилами. Это самая распространенная тканевая локализация эозинофилов.
Заболевание объединяет под собой следующие состояния:
1. Эозинофильные гранулемы.
2. Легочные инфильтраты (летучие).
3. Эозинофильные васкулиты легких, вызванные различными причинами.
4. Эозинофильную пневмонию.
Перечисленные состояния характерны для следующих патологий:
- аллергический ринит;
- бронхиальная астма;
- синдром Чарга-Стросса;
- паразитарные инвазии;
- аллергический бронхолегочный аспергиллез;
- саркоидоз;
- идиопатический эозинофильный синдром;
- синдром Леффлера;
- экзогенный аллергический альвеолит.
Тропическая легочная эозинофилия именуется также по фамилии врача, открывшего ее — синдром Вайнгартена. Вызывается чаще всего вухериями, но причиной могут послужить и аскариды, эхинококки, токсокары и анкилостомы. Больные жалуются на приступообразный сухой кашель, возникающий больше по ночам, снижение аппетита и массы тела. Внешние признаки сопровождаются появлением выраженной эозинофилии в общем анализе крови.
Эозинофилию можно выявить при проведении общего анализа крови у недоношенных младенцев. Но это явление непостоянно, и исчезает, как только масса тела ребенка достигает нормального физиологического значения. Т.е. повышенное содержание эозинофилов у недоношенных детей – вариант нормы.
Наиболее частыми причинами появления эозинофилии крови у детей являются:
- Аллергические заболевания (бронхиальная астма, атопический дерматит). При атопическом дерматите на коже лица и конечностей могут появляться различного рода высыпания, сопровождающиеся зудом. Такой дерматит часто связан с пищевой аллергией, и по времени часто совпадает с введением первых прикормов. При бронхиальной астме ребенка может беспокоить частый сухой кашель, который не поддается лечению отхаркивающими и противокашлевыми средствами, а также приступы удушья, возникающие чаще в ночное время.
- Паразитарные инвазии (острицы и аскариды) – проявляются зудом половых органов, особенно ночью. У детей нарушается сон, появляется чрезмерная нервозность и плаксивость. Также родители замечают покраснения и расчесы в области ануса и половых органов у детей.
- Наиболее выражено повышение уровня эозинофилов при токсокарозе , особенно в период роста и миграции личинок. Этот период сопровождается увеличением печени и селезенки, появлением анемии и инфильтратов в легочной ткани, снижением количества белков в плазме крови.
- Анкилостомоз. Характерным симптомом этого паразитарного заболевания, сопровождающегося эозинофилией, является феномен ползущей сыпи с зудом, что обусловлено также миграцией личинок под кожей.
- Что касается эозинофильного гастроэнтерита , то это заболевание регистрируется преимущественно у детей (или у молодых людей в возрасте до 20 лет).
- Причиной возникновения эозинофилиии у детей могут послужить и некоторые наследственные заболевания , такие как семейный гистиоцитоз.

Для выяснения характера заболевания, приведшего к эозинофилии, необходимо провести биохимический анализ крови (уровень белков, ферментов печени и др.), общий анализ мочи, анализ кала на яйца глистов. Одним из методов подтверждения аллергического ринита является мазок на эозинофилию отделяемого клеток в слизистой оболочке носовой полости, окрашенный по Райту.
Необходимо провести рентгенографию легких при наличии показаний, пункцию пораженного сустава при ревматоидном артрите для выявления эозинофильной инфильтрации, бронхоскопию.
Автор: Пашков М.К. Координатор проекта по контенту.
источник
В периоде ремиссии цифровые показатели превышают средние нормальные показатели (4 500 000 — 5000000 в 1 мм 3 ). Средние цифры гемоглобина и эритроцитов наблюдались у больных в периоде осложнения бронхиальной астмы. Среди наших больных, как упоминалось выше, преобладали гиперстеники, у которых в нормальных условиях количество эритроцитов и гемоглобина значительно выше по сравнению со средней нормой.
Одна из причин, с которой связывают эритроцитоз, наблюдаемый у больных бронхиальной астмой (М. Д. Тушинский, 1940, Г. Г. Газенко, Б. А. Камбур, А. А. Клементьева, 1935),— это реакция костного мозга на гипоксию. Такая точка зрения, по нашему мнению, заслуживает внимания.
Количество лейкоцитов у наших больных вне приступов было в пределах от 4200 до 19 600 при норме в 6 000—8 000 в 1 мм 3 . В среднем количество лейкоцитов было на верхней границе нормы — 8 800.
Если распределить больных по периодам заболевания, то в периоде обострения инфекции преобладали больные с повышенным по отношению к средней норме количеством лейкоцитов и с выраженным лейкоцитозом. В периоде ремиссии преобладали больные с нормальным числом лейкоцитов и с наклонностью к лейкопении. В периоде осложнений количество лейкоцитов чаще было в пределах средней нормы.
Во время приступов бронхиальной астмы и длительного астматического состояния мы наблюдали у 32% больных лейкоцитоз от 10 000 до 19 500 в 1 мм 3 , нормальное количество лейкоцитов — в пределах 6000 — 8000 — было у 51% больных, у остальных 17% больных мы наблюдали лейкопению.
Таким образом, лейкоцитоз мы наблюдали вне и во время приступов у тех больных, у которых было обострение инфекционных очагов, находившихся в верхних дыхательных путях, бронхах или легких. Лейкоцитоз чаще наблюдался в периоде обострения инфекции. Лейкопения чаще наблюдалась у больных в период ремиссии.
Данные, полученные у больных во время приступов, не соответствуют данным Е. В. Лошкаревой (1926), В. П. Луканина (1934), наблюдавших только лейкоцитоз, данным Р. А. Лурия (1939), получившего только лейкопению, и данным М. М. Большаковой (1926), обнаружившей нормальные цифры лейкоцитов.
Мы понимаем, что в данном случае количество лейкоцитов находится в прямой зависимости от состояния сенсибилизации организма и динамики токсикоинфекционного очага, на что и следует всегда обращать внимание у больных бронхиальной астмой. Надо сказать, что этот вопрос подлежит еще дальнейшему специальному изучению.
Количество эозинофилов в крови во время ремиссии было в пределах от 2 до 35%, среднее количество их составляло 8%. Наибольшее число эозинофилов наблюдалось у больных во время приступа бронхиальной астмы. Обострение инфекции у больных в периоде осложнений часто сопровождалось увеличением количества эозинофилов.
На основании наших наблюдений, при наличии клинических данных и эозинофилии в крови, следует ставить диагноз бронхиальной астмы. При этом надо учитывать, что по одному исследованию крови в период тяжелого приступа бронхиальной астмы, когда эозинофилии нет, нельзя отклонять диагноз бронхиальной астмы.
Количество сегментоядерных нейтрофилов вне приступов было несколько понижено по сравнению с нормой (45,5%) с колебаниями от 26 до 62%. Палочкоядерные нейтрофилы в среднем составляли 3,2% с колебаниями от 1,0 до 12%. Во время приступов бронхиальной астмы количество нейтрофилов возрастало, преимущественно за счет сегментоядерных, и достигало 60—75%, в среднем составляя 66%. Количество палоч-коядерных нейтрофилов в большинстве случаев оставалось без перемен.
При распределении больных бронхиальной астмой по периодам оказалось, что в периоде инфекционной аллергии преобладали больные с высокими цифрами палочкоядерных и сегментоядерных нейтрофилов и, наоборот, в периоде ремиссии у больных были низкие цифры, но с более значительными колебаниями количества палочкоядерных и сегментоядерных нейтрофилов.
Суммируя изложенное выше, мы делаем вывод, что у больных бронхиальной астмой во время ремиссии имеется наклонность к нейтропении. Во время приступов бронхиальной астмы количество нейтрофилов нарастает до нормальных или субнормальных цифр (60—70%).
Количество базофилов колеблется от 0 до 1% вне и во время приступа бронхиальной астмы.
Количество лимфоцитов у больных вне приступа было в среднем равно 38% с колебаниями от 24 до 54%. Во время приступов количество лимфоцитов снижалось в среднем до 18% с колебаниями от 10 до 31%.
Наши данные совпадают с наблюдениями Е. В. Лошкаревой (1926), М. М. Невядомского (1925), Брея и Сигни (1937) и др.
Количество моноцитов у наших больных вне приступов было в пределах нормы, в среднем оно было равно 6,2% с колебаниями от 2 до 12%. Во время приступов и астматического состояния намечалось некоторое недостаточно отчетливое снижение числа их: в среднем число их было равно 5% с колебаниями от 1 до 9%.
Подытоживая все вышеизложенное о морфологическом составе крови у больных бронхиальной астмой, можно сделать вывод, что состав периферической крови во время ремиссии и во время приступов изменяется. Во время ремиссии количество гемоглобина у большинства больных было выше средней нормы, выявлены также эозинофилия (в среднем 8%), лимфоцитоз (в среднем 38%), нейтропения (в среднем 38,5%); отчетливых изменений количества моноцитов и базофилов не наблюдалось.
Во время приступа у больных бронхиальной астмой можно отметить некоторое увеличение количества гемоглобина (в среднем на 6%) и количества эритроцитов (в среднем до 500 000 в 1 мм 3 крови), что сочетается с наклонностью к лейкопении. При этом отмечено нормальное или субнормальное количество палочкоядерных и сегментоядерных нейтрофилов, увеличение количества эозинофилов, наклонность к лимфоцитозу и у некоторых больных, из группы находившихся в периоде осложнений, резко выраженная эозинофилия и лимфоцитоз.
Таким образом, эозинофилия является у больных бронхиальной астмой важным симптомом заболевания, подтверждающим его аллергическое происхождение. Наиболее выражена эозинофилия во время приступа бронхиальной астмы и у больных, длительно и тяжело болеющих бронхиальной астмой. Большой интерес представляет сочетание эозинофилии и лимфоцитоза, о чем имелись сообщения в литературе еще в 1926 г. (Е. В. Лошкарева).
Роль лимфоцитов по литературным данным, полученным за последние годы, весьма существенна в явлениях иммунитета. Продукты, освобождающиеся в процессе распада лимфоцитов, обладают высокой физиологической активностью. По Догарти, Чейзу и Уайту (Dougherty, Chase, White, 1945), из лимфоцитов под влиянием гормонов надпочечников могут освобождаться гамма-глобулины, из которых образуются антитела. Также следует учитывать возможность освобождения из лимфоцитов при их распаде нуклеиновых кислот.
Если учесть, что эти изменения в организме больных бронхиальной астмой происходят одновременно с колебанием количества 17-кетостероидов, которые связаны, как видно из наших наблюдений, с инфекционным процессом в органах дыхания, то вырисовываются следующие одновременно появляющиеся симптомы: эозинофилия, лимфоцитоз, нарастание в крови гамма-глобулинов (Л. А. Глинская, 1959) и падение количества 17-кетостероидов (Н. Н. Зубцовская, 1962).
Все эти симптомы наиболее выражены у больных с тяжелым течением заболевания, у которых из воспалительных очагов органов дыхания продолжается сенсибилизация организма. Однако у большинства больных эти изменения носят функциональный характер и с прекращением сенсибилизации, во время ремиссии, эти симптомы не определяются.
Изучение реакции оседания эритроцитов у больных бронхиальной астмой также представляет практический интерес.
По литературным данным, реакция оседания эритроцитов может быть нормальной (И. Е. Ландсман, 1956, Б. М. Прозоровский, 1934, В. П. Луканин 1934, и др.), замедленной (И. Е. Ландсман 1956, М. Израэль, 1938) и ускоренной (И. Е. Ландсман, 1956). Ускоренная реакция оседания эритроцитов отмечалась при осложнении бронхиальной астмы инфекционными заболеваниями (Брей, 1937; Уесткот и Спейн — Westcott, Spain, 1933).
Реакция оседания эритроцитов в большинстве случаев рассматривалась исследователями без учета состояния в организме токсикоинфекционного очага.
У обследованных нами больных реакция оседания эритроцитов была нормальной — в пределах от 6 до 15 мм— в 45% случаев, замедленной — от 0 до 5 мм — в 17% случаев и повышенной— от 17 мм и выше — у 38% больных.
Установлено, что показатели реакции оседания эритроцитов выше средней нормы были по преимуществу у больных с инфекцией в органах дыхания. В период ремиссии у больных отмечаются нормальные или чаще пониженные показатели реакции оседания эритроцитов.
Ускоренная реакция оседания эритроцитов, наблюдавшаяся в периоде осложнений, объясняется наличием у больных острой или обострением хронической инфекции, чаще хронической неспецифической пневмонии.
У больных во время ремиссии, наоборот, реакция оседания эритроцитов была замедленной или нормальной, что позволяет нам говорить об отсутствии у больных в это время активных проявлений инфекции.
При изучении стойкости коллоидов сыворотки крови у наших больных ставилась задача подтвердить наличие инфекционного процесса в органах дыхания, для этого мы пользовались методикой Матеффи, видоизмененной Брюловой.
Была обследована сыворотка крови у 34 больных бронхиальной астмой: у 12 больных — с очагами инфекции, у 12 больных — в периоде осложнений и у 10 больных —в периоде ремиссии.
У 7 из 12 больных бронхиальной астмой в периоде ремиссии стойкость коллоидов сыворотки крови по отношению к коагулянту— сернокислому алюминию — была повышена; у 8 из 12 больных с активными проявлениями инфекционной аллергии стойкость коллоидов сыворотки крови по отношению к этому коагулянту была понижена. У 8 из 10 больных в периоде осложнений стойкость коллоидов сыворотки крови была понижена.
источник
У большой части астматических детей (приблизительно 40%) электрокардиограмма отклоняется от нормы. Интенсивность отклонения, однако, не всегда соответствует степени тяжести заболевания. Печень часто увеличена. Во время астматического приступа и непосредственно после него в сыворотке уменьшается количество альбуминов и увеличивается количество глобулинов и гаммаглобулина.
В картине крови обнаруживается умеренный лейкоцитоз с легким сдвигом влево, умеренная, непостоянная эозинофилия. Сильно выраженная эозинофилия в крови нетипична для астмы. К костном мозгу она более постоянна. При отсутствии инфекции РОЭ нормально или умеренно ускорено. Мокрота астматиков может содержать слепки малых бронхов из стекловидной слизи. В области закупоренных бронхов развиваются ателектазы, в некоторых случаях в довольно больших размерах. В мокроте обнаруживаются комочки слизи, иногда слизь спиралеобразно организована, иногда обнаруживаются кристаллы Шарко — Лейдена и довольно часто эозинофильные клетки. Отсутствие эозинофилии в мокроте и в других выделениях еще не исключает аллергического состояния. Степень эозинофилии не имеет отношения к тяжести астмы и может быть ярче выражена в период между приступами.
В период между приступами с мочой астматиков выделяется столько же гистамина, как и с мочой здоровых лиц; во время приступа выделение значительно падает или останавливается на одном уровне (Duner 1958).
При каждом случае заболевания астмой со значительной эозинофилией, неподдающемся обычному лечению, необходимо думать о наличии кишечных паразитов, и исследования следует проводить регулярно и настойчиво в течение 6 недель.
Рентгенологическая картина легких при первых приступах неосложненной бронхиальной астмы может быть нормальна. При непродолжительности заболевания эмфизема не определяется или только намечается несколько ограниченным движением диафрагмы и в сохранении прозрачности нижних пространств при выдохе. При повторном недомогании неосложненной астмой состояние характеризуется повышенной прозрачностью, снижением диафрагмы и ограничением ее движений, расширением межреберных пространств и негустым, просвечивающимся рисунком гилюсов. Позднее бронхиальная астма часто характеризуется значительно повышенной прозрачностью после повторных приступов и в межприступный период, причем купол опущенной диафрагмы почти всегда становится более плоским, раскрытием френикокостальных углов, расширением межреберных пространств, горизонтальным расположением ребер, сужением средостения и узкой малой тенью сердца.
После частых астматических явлений развивается грудной кифоз. Ретростернальное пространство расширяется и становится более прозрачным. Возникают и внутрипаренхиматозные буллезные полости и субплевральные пузыри. Сосудистый, особенно бронхиальный рисунок усиливается. Рентгенологически и бронхоскопически определяются бронхиальные стенозы. Иногда наблюдаются многочисленные, пятнистые или полосатые тени, быстро исчезающие после отхаркивания мокроты. Тени ателектазов имеют иногда сегментарные, изредка большие размеры, но транспонирование средостения на пораженную сторону не бывает достаточно явным.
После повторных астматических приступов, при длительном течении астмы часто наблюдаются отчетливо бронхомуральные параллельные, острые тени, становящиеся с периферии более толстыми, идущие по направлению к гилюсам, где совместно с сосудистым рисунком они сливаются в гомогенные, широкие, лохматые гилюсные тени. В ортоградной проекции бронхомуральная инфильтрация изображается в виде более тонких или более грубых кольцеобразных теней. Картина бронхомуральной тяжистости может походить на усиленный сосудистый рисунок. Интенсивность гилюсных теней усиливается увеличенными лимфатическими узлами. Натяжение и даже сужение альвеолярных капил ляров при эмфиземе изменяет условия давления и кровотока, вызывает стаз и расширение сосудов в гилюсной области, что усиливает сосудистый и гилюсный рисунок, изменяет деятельность и форму сердца.
При длительном течении заболевания изменения могут определяться и электрокардиографически. Мы до сих пор не имели случая наблюдать приводимый в литературе пневмоторакс и подкожную эмфизему. Чем младше дети, тем чаще мы наблюдали выгибание конуса легочной артерии.
источник
При светооптическом исследовании диаметр эозинофилов составляет 12–17 мкм; они обычно несколько крупнее, чем нейтрофилы. В отличие от зрелых полиморфноядерных лейкоцитов (ПМЯЛ), ядра которых имеют около четырех долек, ядра эозинофилов, как правило, состоят из двух долек, связанных между собой нитью. Основным своеобразием их цитоплазмы является наличие двух типов специфических гранул (больших и малых), которые имеют красный или оранжевый цвет [3]. Даже в плохо окрашенных мазках их можно отличить от гранул нейтрофилов, так как они более многочисленны и отчетливо крупнее. Большие гранулы содержат основные протеины, которые являются уникальными для эозинофилов.
К ним относятся: большой основной протеин (БОП), эозинофильный катионный протеин (ЭКП), эозинофильная пероксидаза (ЭПО), эозинофильный нейротоксин (ЭН), ранее называемый эозинофильным протеином Х, и гомолог БОП [1]. Малые гранулы содержат ферменты арилсульфатазу В и кислую фосфатазу, также обнаруживаемые в азурофильных гранулах нейтрофилов [4]. Лизофосфолипаза В (кристаллы Шарко–Лейдена) – фермент мембран эозинофилов – не играет важной роли в патогенезе болезней и не имеет диагностической ценности.
В активированных эозинофилах число гранул значительно уменьшается и клетки часто вакуолизируются, становясь менее плотными, чем неактивированные эозинофилы [5].
Функции эозинофилов точно неизвестны. Они обладают многими функциями других циркулирующих фагоцитов, таких как ПМЯЛ и моноциты. Хотя эозинофилы способны к фагоцитозу, они уничтожают находящиеся внутри них бактерии менее эффективно, чем нейтрофилы.
Прямых доказательств того, что эозинофилы убивают паразитов in vivo, нет, но они токсичны для гельминтов in vitro, и гельминтозы часто сопровождаются эозинофилией [1]. Эозинофилы могут модулировать реакции гиперчувствительности немедленного типа, инактивируя медиаторы, высвобождаемые тучными клетками (гистамин, лейкотриены, лизофосфолипиды и гепарин).
БОП и ЭКП токсичны для некоторых паразитов и клеток млекопитающих. ЭН способен серьезно повреждать миелиновые нервные волокна. БОП и ЭКП связывают гепарин и нейтрализуют его противосвертывающую активность. ЭПО в присутствии перекиси водорода и галогенов генерирует окислительные радикалы [6]. Длительная эозинофилия иногда приводит к повреждению тканей, механизмы которого пока не ясны. Степень повреждения связана с эозинофильной инфильтрацией тканей, продолжительностью эозинофилии и степенью активации эозинофилов [7]. Наибольшее повреждающее действие эозинофилов обнаружено при состояниях, подобных болезни Леффлера (эозинофильный фибропластический эндокардит) и идиопатическому гиперэозинофильному синдрому [2].
Эозинофилы – это неделящиеся гранулоциты, которые, как и другие ПМЯЛ, непрерывно образуются в костном мозге из единой стволовой клетки. Эозинофилопоэз и дифференцировку эозинофилов из клеток-предшественников регулируют Т-лимфоциты путем секреции колониестимулирующего фактора гранулоцитов и макрофагов (ГМ!КСФ), интерлейкина-3 (ИЛ-3) и ИЛ!5 [8, 9]. Кроме того, ИЛ-5 и ГМ!КСФ активируют эозинофилы, индуцируя переход клеток из нормальной плотности в низкую (меньше 1,085) [10].
Продолжительность жизни эозинофилов составляет 10–12 дней. Покинув костный мозг, где они образуются и созревают в течение 3–4 дней, эозинофилы несколько часов циркулируют в крови (период их полужизни составляет 6–12 ч). Затем, подобно нейтрофилам, они покидают кровяное русло и уходят в периваскулярные ткани, главным образом в легкие, желудочно-кишечный тракт и кожу, где остаются в течение 10–14 дней. На каждый эозинофил периферической крови приходится примерно 200–300 эозинофилов в костном мозге и 100–200 в других тканях [11].
Эозинофилы в нормальном мазке крови составляют от 1 до 5% лейкоцитов. В абсолютных числах за норму принято 120–350 эозинофилов в 1 мкл (120–350 . 106/л) периферической крови. Уровень от 500 до 1500 эозинофилов/мкл рассматривается как легкая эозинофилия, а свыше 1500 клеток/мкл – как гиперэозинофилия: умеренная (1500–5000 клеток/мкл) и выраженная (более 5000 клеток/мкл).
Абсолютное число эозинофилов в периферической крови у здоровых людей варьирует. Суточные колебания числа эозинофилов находятся в обратной зависимости от уровня кортизола в плазме, причем максимум приходится на ночные часы, а минимум – на утренние [12].
источник
В норме в 1 мкл крови насчитывается 50–250 эозинофилов, чаще всего — 150–250 в 1 мкл, что составляет в среднем 3 % (с возможными пределами колебаний от 0 до 5 %).
Эозинофилией принято считать увеличение количества эозинофилов в периферической крови более 0,4´10 9 /л у взрослых и > 0,7´10 9 /л у детей.
Критическим уровнем, который указывает на патологический процесс, связанный с увеличением количества эозинофилов, является уровень, превышающий 450 в 1 мкл.
Выделяют 3 степени эозинофилии: легкая — 400–1500´10 9 /л, умеренная — 1500–5000´10 9 /л, тяжелая — больше, чем 5000´10 9 /л. Многие гематологи считаютэозинофилию умеренной при наличии 10–15 % эозинофилов в периферической крови; выраженной, если их количество превышает 15 %, а состояния, при которых количество эозинофилов больше 15–20 % предложено называть «большими эозинофилиями крови». Они обычно сочетаются с увеличением общего количества лейкоцитов.
Гиперэозинофилия крови может не коррелировать с тканевой эозинофилией и проявиться только эозинофилией в периферической крови или одновременно сочетанием эозинофилии в крови и эозинофильной тканевой инфильтрацией, или только эозинофильной тканевой инфильтрацией.
Механизмы развития эозинофилий различны. Наиболее важными из них являются:
1) высокий уровень в крови интерлейкина-5;
2) антителозависимый хемотаксис эозинофилов, обусловленный гипер-продукцией IgE и IgG (наблюдается преимущественно при паразитарных инвазиях);
3) иммунный механизм с гиперпродукцией ІgЕ (развивается при аллергической реакции немедленного типа);
4) гиперпродукция хемотаксического эозинофильного фактора (при некоторых опухолях);
5) опухолевая пролиферация, патоморфологический субстрат которой составляют эозинофилы (при эозинофильной лейкемии и миелопролиферативных заболеваниях).
Из всех перечисленных механизмов общий для всех клинических форм — первый (высокий уровень в крови интерлейкина-5), который является фактором роста и дифференцировки В-лимфоцитов и эозинофилов, а также стимулирует синтез ІgА. Он вырабатывается Т-лимфоцитами-хелперами 2-го типа.
Гиперэозинофилия оказывает многогранное влияние на макроорганизм. Эозинофилы — источник ряда цитокинов, некоторые из них участвуют в поддержании гомеостаза, другие выполняют провоспалительную функцию. Эозинофилы секретируют трансформирующий фактор роста, их количество резко возрастает по краям раны,и это позволяет утверждать, что они участвуют в заживлении раны.
В настоящее время существует точка зрения о том, что эозинофилы участвуют в развитии реакций, обусловленных Т-лимфоцитами. Они замедляют прогрессирование солидных опухолей, оказывая цитотоксическое действие на клетки опухоли. Эозинофилы в ряде случаев могут быть причиной тяжелых повреждений тканей. Хроническая гиперэозинофилия, наблюдающаяся при лекарственных аллергических реакциях, паразитарных инвазиях, эозинофильной лейкемии, гиперэозинофильном синдроме, ассоциируется с эндомиокардиальным фиброзом. С другой стороны, известно повреждающее влияние эозинофилов на паразитов, откуда следует, что гиперэозинофилия способствует их уничтожению. Эозинофилы выделяют провоспалительные медиаторы (фактор, активирующий тромбоциты, провоспалительные простагландины) и, следовательно, являются клетками, участвующими в повреждении тканей (например, при бронхиальной астме, гиперэозинофильном синдроме).
В редких случаях встречается синдром псевдоэозинофилии: зернистость в нейтрофилах окрашивается эозином, и тогда нейтрофилы могут быть ошибочно приняты за эозинофилы.
Диагностика осуществляется с помощью цитохимического ферментного анализа.
Клинические состояния, сопровождающиеся
1. Большие паразитарные эозинофилии:
1.15. Большая эозинофилия после укусов пауков и паукообразных.
2. Большие опухолевые эозинофилии.
3. Большие лекарственные эозинофилии.
4. Большие легочные эозинофилии:
4.1. Простая эозинофильная пневмония (синдром Леффлера).
4.2. Острая эозинофильная пневмония.
4.3. Хроническая эозинофильная пневмония.
4.4. Аллергический бронхопульмональный аспергиллез.
4.5. Экзогенный аллергический альвеолит.
4.6. Идиопатический гиперэозинофильный синдром.
5. Эндомиокардиальная болезнь.
6. Большие эозинофилии при системных заболеваниях:
6.3. Диффузный эозинофильный фасциит.
7. Большие эозинофилии при поражении желудочно-кишечного тракта.
8. Большая эозинофилия при кожных заболеваниях:
8.2. Болезнь Кимуры (эозинофильная гранулема мягких тканей).
9. Большие эозинофилии при эндокринопатиях.
10.Большие эозинофилии при иммунодефицитах:
10.1. Большие эозинофилии при болезнях крови.
11.Большая циклическая эозинофилия.
12.Большая семейная эозинофилия.
В клинической практике наиболее часто встречаются такие паразитарные инвазии, как аскаридоз, описторхоз, трихинеллез, три-хоцефалез, энтеробиоз, эхинококкоз, стронгилоидоз, дифиллоботриоз. При этих заболеваниях личинка или зрелые формы паразита, соприкасаясь с тканями пациента, выделяют хемотаксические вещества, под влиянием которых увеличивается продукция эозинофилов в костном мозге. Далее эозинофилы поступают в кровоток (гиперэозинофилия), а также контактируют с личинками паразитов и выделяют уничтожающие их катионный белок, лизосомальные ферменты, пероксидазу и другие активные вещества.
1. Большие паразитарные эозинофилии составляют 17–25 % всех случаев больших эозинофилии. Высокий лейкоцитоз вплоть до лейкемоидной реакции с эозинофилией характерен для острой или личиночной стадии практически всех гельминтозов, особенно, в фазе миграции, когда гельминт оказывает максимальное аллергизирующее действие.
Клиническая картина личиночной стадии не зависит от вида гельминта и проявляется лихорадкой, рецидивирующими высыпаниями на коже, болями в мышцах и суставах. Возможно развитие отечного синдрома (отек Квинке, пастозность лица), ринита, бронхоспастического синдрома, иногда — синдрома Леффлера I (Loffler). Изредка возникают боли в животе, жидкий стул. В некоторых случаях появляются симптомы миокардита, системная лимфаденопатия (чаще — у детей), незначительное увеличение печени и селезенки.
При некоторых нижеуказанных гельминтозах большие эозинофилии встречаются наиболее часто, причем не только в личиночной, но иногда в подострой и хронической стадиях. Наиболее выраженная эозинофилия описана при эхинококкозе, трихинеллезе, описторхозе.
1.1. Аскаридоз — самый распространенный гельминтоз. Большая эозинофилия встречается главным образом во время миграционной стадии, когда личинки паразита приходят в соприкосновение с тканями организма и эозинофилия крови нередко является сопутствующей фазой местной реакции со стороны шокового органа, чаще всего — легких. Здесь могут возникнуть летучие эозинофильные инфильтраты, реже — эозинофильные плевриты.
Острая стадия аскаридоза часто сопровождается также другими симптомами, типичными для личиночной стадии гельминтозов. Миграционная стадия возникает чаще всего в летне-осенний период и продолжается не более 15 суток. В кишечной стадии аскаридоза большие эозинофилии встречаются редко, особенно, у взрослых, но возможны у детей. Типичны снижение аппетита, диспептические явления, неустойчивый стул. Благодаря значительной подвижности, аскариды могут внедриться в червеобразный отросток, протоки печени и поджелудочной железы, реже — в гортань, носовые и слуховые ходы.
Описаны хирургические осложнения аскаридоза: кишечная непроходимость, аппендицит, острый холецистит, механическая асфиксия аскаридами. Иногда развиваются аскаридозные абсцессы печени.
Диагностика: постоянно необходимо помнить о важности правильно собранного эпидемиологического анамнеза. Основа диагностики личиночной стадии любого гельминтоза — серологические методы.
На этой стадии типичны лейкоцитоз (вплоть до лейкемоидной реакции), увеличение СОЭ, диспротеинемия и другие осадочные реакции за счет гипергаммаглобулинемии и гипоальбуминемии. Значительно повышены концентрации IgE и в меньшей степени, IgG и IgM. При рентгенологическом исследовании легких можно выявить летучие эозинофильные инфильтраты. При личиночной стадии аскаридоза возможно появление в мокроте и крови живых личинок аскарид.
Кишечная форма аскаридоза выявляется, прежде всего, многократным исследованием кала на яйца аскарид, обязательно с использованием различных методов накопления: их применение необходимо для поиска яиц любых гельминтов в кале. Яйца аскарид и других нематод могут отсутствовать в кале в случае паразитирования одних самцов, а также при наличии в кишечнике старых или, наоборот, незрелых молодых самок.
В периферической крови наблюдаются умеренная гипохромная анемия, лейкопения, незначительное увеличение СОЭ. Хроническая стадия любого гельминтоза может привести к иммунологическим изменениям: чаще всего в крови обнаруживаются специфические антитела.
1.2. Токсокароз — множественные глистные инвазии и миграция в человеческом организме личинок собачьих и кошачьих аскарид. По данным последних лет, отмечают рост токсокароза, в частности из-за увеличения числа собак и сильного загрязнения яйцами токсокар почвы городских садов и парков. Не исключаются передача токсокароза через плохо термически обработанное мясо резервуарных животных (свиньи, ягнята, цыплята, голуби).
источник
Эозинофилия (эозинофильный лейкоцитоз) – это увеличение в крови уровня эозинофилов больше 500 в 1 мкл крови или больше 5%. Чаще всего встречается при аллергических реакциях, паразитарных инвазиях, может свидетельствовать о тяжелых заболеваниях легких, онкологических гематологических патологиях. Специфических проявлений нет. Клиническая картина зависит от заболевания, при котором наблюдается повышенное содержание эозинофилов. Уровень эозинофилов исследуется в венозной или капиллярной крови путем подсчета лейкоцитарной формулы в общем анализе крови. Для коррекции эозинофилии необходимо лечение заболевания, которое ее вызвало.
На сегодняшний день существуют две основные классификации эозинофилии – по уровню повышения эозинофилов и по этиопатогенетическому фактору. По количеству клеток различают следующие эозинофилии:
- Легкие. Уровень эозинофилов от 500 до 1500.
- Умеренные. Концентрация эозинофилов от 1500 до 5000.
- Выраженные. Содержание эозинофилов составляет более 5000. Наиболее характерны для гельминтозов, гематологических болезней.
Умеренные и выраженные эозинофилии объединяют термином гиперэозинофилии. По патофизиологическому механизму эозинофилии разделяют на:
- Клональные. Эозинофилы являются частью злокачественного клона. Встречаются при миелопролиферативных гемобластозах (лейкозах), системных заболеваниях тучных клеток (мастоцитозе).
- Реактивные. Общий механизм возникновения – гиперпродукция Т-хелперами интерлейкина-5, который стимулирует костномозговую выработку эозинофилов. Развиваются как ответная реакция на различные внешние воздействия на макроорганизм – аллергены, паразитарные инвазии и т.д. Составляют около 90% всех эозинофилий.
Отдельно выделяют транзиторную (кратковременную) эозинофилию, не связанную напрямую с конкретными заболеваниями. Количество эозинофилов может увеличиться при употреблении некоторых лекарственных препаратов (антибиотиков, противотуберкулезных средств), введении вакцины против гепатита А, при проведении гемодиализа, воздействии локальной радиационной терапии. Точный патофизиологических механизм повышения эозинофилов при этих обстоятельствах неизвестен.
Это наиболее частая причина эозинофилии. Любые реакции гиперчувствительности сопровождаются увеличением продукции эозинофилов костным мозгом. Патогенез эозинофилий при аллергиях хорошо изучен. При попадании в организм аллергена (ингаляционно, через кожу или слизистые) он взаимодействует с IgE на мембране базофилов. Это приводит к их дегрануляции последних и высвобождению гистамина, лейкотриенов и других медиаторов, в результате чего в тканях развивается аллергическое воспаление, что и обусловливает симптоматику со стороны кожи (атопический дерматит, крапивница), слизистых оболочек (аллергический ринит, конъюнктивит), а также дыхательной системы (бронхиальная астма).
Параллельно с этим базофилами выделяется эозинофильный хемотаксический фактор анафилаксии, который стимулирует миграцию эозинофилов из периферической крови к очагу воспаления. Эозинофилы, в свою очередь, подавляют выработку медиаторов аллергии. Во время разгара аллергической реакции (обострения) уровень эозинофилии максимальный; по мере разрешения симптомов он постепенно снижается и нормализуется в стадию ремиссии.
При выраженном обострении содержание эозинофилов, наоборот, может быть снижено (эозинопения) или даже равно нулю (анэозинофилия). Такое случается, когда произошла массивная миграция эозинофилов к очагу аллергического воспаления, а новые эозинофилы еще не успели синтезироваться в костном мозге. Также, если во время рецидива бронхиальной астмы присоединится вторичная бактериальная инфекция (бронхит), то показатели эозинофилов могут оставаться в пределах нормы.
В основном при аллергиях встречается легкая степень эозинофилии. Для бронхиальной астмы, особенно атопической и аспириновой формы, характерна умеренная эозинофилия. При аллергических патологиях повышенное содержание эозинофилов наблюдается не только в крови, но и в других биологических жидкостях (в мокроте и бронхоальвеолярной жидкости – при бронхиальной астме, в носовой слизи – при рините, в соскобе с конъюнктивы – при конъюнктивите).
Другой частой причиной эозинофилий (особенно среди детей) является заражение гельминтами. Эозинофилия в данном случае обусловлена двумя патогенетическими механизмами. Во-первых, эозинофилы обладают противопаразитарной активностью – они выделяют эозинофильный катионный белок и активные формы кислорода, которые губительны для гельминтов. Во-вторых, продукты метаболизма гельминтов способны индуцировать реакции гиперчувствительности. Именно поэтому глистные инвазии часто сопровождаются аллергической симптоматикой.
Самые частые гельминтозы, сопряженные с высокой эозинофилией среди детей – аскаридоз, токсокароз, среди взрослых ‒ анкилостомидоз, описторхоз. При стронгилоидозе эозинофильный лейкоцитоз долгое время может быть единственным проявлением. Эозинофилия выявляется уже на 4-5 день инфицирования. Затем она очень быстро нарастает и достигает максимума примерно к 30-40 дню, а потом медленно начинает уменьшаться, но продолжает оставаться на высоких цифрах длительное время. Уровень эозинофилов очень большой (может составлять от 20% до 70-80%). Резкое нарастание эозинофилии происходит во время стадии миграции личинок по организму и проникновения в ткани.
Существует группа болезней легких, называемых легочными эозинофилиями, которые объединяет большое содержание эозинофилов в крови, в бронхоальвеолярной жидкости и образование эозинофильных инфильтратов в легочной ткани. Точный патогенез эозинофилии периферической крови и инфильтрации эозинофилами легочной ткани при большинстве этих заболеваний неизвестен. Различают следующие легочные эозинофилии:
- Эозинофильные пневмонии. К ним относятся синдром Леффлера (простая легочная эозинофилия), острые, хронические эозинофильные пневмонии (ОЭП, ХЭП). При синдроме Леффлера наблюдается легкая эозинофилия, которая быстро и самостоятельно разрешается. Для ХЭП характерен постоянный умеренный эозинофильный лейкоцитоз. При ОЭП отмечается эозинофилия, резко нарастающая до высоких цифр (до 25%) и столь же стремительно регрессирующая на фоне терапии глюкокортикостероидами.
- Аллергический бронхолегочный аспергиллез. Обусловлен гиперчувствительностью больных к грибкам рода аспергилл. Патогенез сходен с аллергическими патологиями (IgE-опосредованная реакция). Эозинофилия умеренная, возникает только в фазу обострения. В период ремиссии уровень эозинофилов находится пределах нормальных значений.
- Синдром Черджа-Стросса. Эозинофильный гранулематоз с полиангиитом ‒ тяжелое заболевание неизвестной этиологии из ряда системных васкулитов, поражающее несколько внутренних органов. Эозинофильный лейкоцитоз наиболее высокий среди всех легочных эозинофилий, в период рецидива может доходить до 50%.
Во время некоторых злокачественных гематологических заболеваний в крови наблюдается повышенный уровень эозинофилов с разным патогенетическим механизмом. При миелопролиферативных патологиях (остром и хроническом эозинофильном лейкозе, хроническом миелолейкозе), агрессивном системном мастоцитозе эозинофилия обусловлена опухолевой (клональной) пролиферацией эозинофильного ростка кроветворения.
Эозинофилия нарастает медленно, в течение нескольких лет. При мастоцитозе достигает умеренных значений, при лейкозах – выраженных (до 60-70%). Уменьшается очень медленно, под действием химиотерапии. Кроме периферической крови, эозинофилия наблюдается также в миелограмме (мазке пунктата костного мозга). Для лейкозов существует специфичный лабораторный признак ‒ одновременное увеличение эозинофилов и базофилов (базофильно-эозинофильная ассоциация).
При лимфогранулематозе и неходжкинских лимфомах эозинофилия возникает вследствие продуцирования лимфатическими клетками цитокинов (в том числе интерлейкин-5), которые стимулируют пролиферацию нормальных эозинофилов. Эозинофильный лейкоцитоз умеренный, медленно нарастающий.
Эозинофилия сопровождает некоторые болезни органов пищеварения. К ним относят эозинофильный эзофагит, гастрит и энтероколит. Морфологическим субстратом является инфильтрация эозинофилами стенок пищевода, желудка, кишечника. Патогенез до сих пор остается предметом дискуссий.
Предполагается, что у наследственно предрасположенных лиц воздействие пищевых аллергенов на слизистую оболочку вызывает активацию антиген-презентирующих клеток (Т-лимфоцитов), вырабатывающих интерлейкины и эотаксин-3. В результате этого происходит миграция эозинофилов и инфильтрация ими слизистой оболочки органов ЖКТ. Эозинофильный лейкоцитоз обычно легкий и наблюдается только во время выраженного обострения заболевания. Высокая концентрация эозинофилов в биоптате слизистых, напротив, встречается постоянно.
Некоторые гормоны, например, глюкокортикостероиды (гормоны коры надпочечников), стимулируют апоптоз (запрограммированную клеточную гибель) эозинофилов. Поэтому заболеваниям, сопровождающимся снижением уровня глюкокортикостероидов, сопутствует эозинофилия. К таким патологиям относятся первичная надпочечниковая недостаточность (болезнь Аддисона), врожденная дисфункция коры надпочечников, а также множественные эндокринопатии, такие как синдром Шмидта, пангипопитуитаризм. Степень эозинофилии легкая. Количество эозинофилов быстро нормализуется после введения глюкокортикоидов.
Эозинофилия встречается при, так называемых, первичных иммунодефицитах – тяжелых болезнях с высокой летальностью, обусловленных генетическим дефектом одного или нескольких компонентов иммунной системы (клеточных, гуморальных реакций, фагоцитоза и пр.). Такими заболеваниями являются синдром Вискотта-Олдрича и синдром Джоба (гипер-IgE-синдром). Эозинофилия, вероятно, связана с аномальной гиперпродукцией иммуноглобулина Е. Уровень эозинофилов в тканях и крови очень высокий (до 60%), не поддается коррекции.
Некоторые опухоли, особенно аденокарциномы легких, органов пищеварительной и мочеполовой системы, имеют способность к выработке эозинофильного хемотаксического фактора, стимулирующего костномозговую продукцию эозинофилов. При таких заболеваниях эозинофильный лейкоцитоз нарастает медленно, достигает высоких значений (до 20-40%). Концентрация эозинофилов периферической крови возвращается к норме после долгой химиотерапии или хирургического удаления злокачественного образования.
Эозинофилия выявляется при подсчете лейкоцитарной формулы клинического анализа крови. Так как спектр патологий, сопровождающихся эозинофилией, довольно широк, при впервые выявленных изменениях в анализах необходимо обратиться к врачу-терапевту. Для подтверждения заболевания, вызвавшего эозинофилию, с учетом клинических и анамнестических данных назначается обследование, которое может включать:
- Анализы крови. Определяется уровень эритроцитов, лейкоцитов, тромбоцитов. Проверяется наличие специфических антител к гельминтам, грибкам, антицитоплазматических антител (ANCA), концентрация некоторых гормонов (кортизола, паратгормона, эстрогенов, андрогенов). Проводится генетическое исследование на первичные иммунодефициты, а также иммунофенотипирование, иммуногистохимический анализ клеток крови для обнаружения специфических опухолевых антигенов (CD-маркеров).
- Аллергодиагностика. Для выявления аллергена выполняются различные аллергопробы – кожные (скарификационные, аппликационные, прик-тесты), провокационные (назальные, ингаляционные, конъюнктивальные), прямой и непрямой базофильный тесты. Методом ИФА измеряется уровень иммуноглобулина E (IgE).
- Исследование мокроты. Осуществляется микроскопическое исследование мокроты для изучения клеточного состава (количества эозинофилов, наличия кристаллов Шарко-Лейдена, спиралей Куршмана), выявления личинок гельминтов. Проводится бактериологический, микологический посев мокроты с определением чувствительности к антибактериальным и противогрибковым препаратам.
- Рентгенологические исследования. Одним из наиболее информативных методов диагностики легочных эозинофилий считается рентгенография грудной клетки. На снимках обнаруживаются летучие (мигрирующие) эозинофильные инфильтраты в виде участков затемнения. При аллергическом бронхолегочном аспергиллезе могут быть видны бронхоэктазы, фиброз верхних отделов легких.
- Эндоскопия. При подозрении на эозинофильное поражение органов желудочно-кишечного тракта проводятся фиброгастродуоденоскопия и фиброколоноскопия со взятием биопсийного материала. Для морфологической картины, помимо эозинофильной инфильтрации, характерен фиброз собственной пластинки слизистой оболочки.
- Спирометрия. При поражении дыхательной системы выполняется оценка функции внешнего дыхания. Измеряется степень проходимости бронхов мелкого и среднего калибра, растяжимость легочной ткани. Для пациентов с бронхиальной астмой типично уменьшение объема выдыхаемого воздуха (индекс Тиффно) и улучшение дыхательной функции после фармакологической пробы с сальбутамолом. При легочных эозинофилиях наблюдается снижение жизненной емкости легких.
- Гистология. С целью подтверждения синдрома Черджа-Стросса берется биопсия легкого. Отмечаются периваскулярные эозинофильные инфильтраты. Для изучения морфологической картины костного мозга (в случае подозрения на лейкоз) прибегают к стернальной пункции и трепанобиопсии. Обнаруживаются гиперплазия гранулоцитарного ростка кроветворения, гиперклеточность за счет эозинофильных миелобластов.
Самостоятельная коррекция эозинофилии невозможна. Для нормализации уровня эозинофилов необходимо бороться с причиной. Если эозинофилия легкая, связана с приемом ЛС или вакцинацией либо приходится на период реконвалесценции – беспокоиться не стоит. Нужно понаблюдать кровь в динамике через 7-10 дней. При обнаружении стойкой или высокой эозинофилии в анализе крови следует обратиться к специалисту, чтобы тот на основании осмотра, жалоб, анамнеза провел диагностический поиск этиологического фактора и назначил соответствующее лечение. Для терапии большинства болезней, сопровождающихся эозинофилией, используются лекарственные препараты из группы антигистаминных средств или глюкокортикостероидов.
Только по одному лишь эозинофильному лейкоцитозу в крови невозможно предсказать риск возникновения тех или иных последствий для здоровья и жизни человека. Прогноз всегда определяется основным заболеванием и своевременностью его диагностирования – он может варьироваться от благоприятного при аллергическом конъюнктивите до высокой вероятности летального исхода при злокачественных новообразованиях или миелопролиферативных патологиях. Поэтому любое превышение референсных значений эозинофилов в клиническом анализе крови требует тщательного обследования для установления причины.
источник




