Каждая ступень включает варианты терапии, которые могут служить альтернативами при выборе поддерживающей терапии БА, хотя и не являются одинаковыми по эффективности (Рис.2).
У большинства больных с симптомами персистирующей БА, не получавших терапии, следует начинать лечение со ступени 2. Если симптомы БА при первичном осмотре указывают на отсутствие контроля (табл. 5), лечение необходимо начинать со ступени 3 (Рис 2).
Если лечение неэффективно или ответ на него недостаточен, проверьте технику ингаляции, соблюдение назначений, уточните диагноз и оцените сопутствующие заболевания.
Обучение пациента и контроль над факторами окружающей среды являются важными составляющими эффективной терапии.
При принятии решения, какой препарат снижать первым и с какой скоростью, должны быть приняты во внимание тяжесть астмы, побочные эффекты лечения, продолжительность приема текущей дозы, достигнутый положительный эффект и предпочтения пациента.
Снижение дозы ингаляционных стероидов должно быть медленным в связи с возможностью развития обострения. При достаточном контроле возможно снижение дозы каждые три месяца, примерно от 25% до 50%.
Схема ступенчатой терапии БА приводится на рис. 2.
Рис. 2. Ступенчатая терапия бронхиальной астмы
Увеличивайте объем терапии до улучшения контроля
Уменьшайте объем терапии до минимального, поддерживающего контроль
Дополнительные средства поддерживающей терапии
β2-агонист короткого действия по потребности
Комбинация β2-агониста короткого действия и ипратропия бромида
Низкие дозы ИГКС +β2-агонист длительного действия 2
Средние или высокие дозы ИГКС
Низкие дозы ИГКС + антилейкотриеновый препарат
Низкие дозы ИГКС + теофиллин замедленного высвобождения
Добавьте один вариант или более:
Средние или высокие дозы ИГКС +β2-агонист длительного действия
теофиллин замедленного высвобождения
Добавьте один вариант или оба:
Минимально возможная доза перорального ГКС
1. ИГКС – ингаляционные глюкокортикостероиды
2. Регулярное назначение β2-агонистов как короткого, так и длительного действия не рекомендуется в отсутствие регулярной терапии ингаляционными глюкокортикостероидами
[А] (взрослые и подростки), [B] (дети в возрасте от 5 до 12 лет), [D] (дети до 5 лет)ингаляционные β2-агонисты короткого действия применяются в качестве неотложной облегчающей терапии у всех пациентов с симптомами астмы на всех ступенях терапии.
У больных с высокой частотой использования ингаляционных короткодействующих β2 -агонистов необходимо провести коррекцию тактики лечения астмы.
Антилейкотриеновые препараты или кромоны
[A] (дети с двух лет) – рекомендуются как предотвращающие обострение при бронхиальной астме в сочетании с аллергическим ринитом, при вирусиндуцированной бронхиальной астме, астме физического усилия. [А] (взрослые и подростки); [А] (дети в возрасте от 5 до 12 лет); [А] (дети до 5 лет) — ингаляционные стероиды рекомендуются как превентивные препараты для взрослых и детей для достижения целей лечения.Начальная доза ингаляционных стероидов выбирается согласно тяжести заболевания.
У взрослых стартовая доза, как правило, эквипотентна дозе беклометазона дипропионата (БДП) 400 мкг в день, у детей эквипотентна БДП 200 мкг в день. У детей в возрасте до пяти лет могут быть необходимы более высокие дозы, если есть проблемы с доставкой лекарственных средств.
Дозы ингаляционных стероидов титруются до самой низкой дозы, при которой сохраняется эффективный контроль астмы.
Частота дозирования ингаляционных стероидов
[А] (взрослые и подростки); [А] (дети в возрасте от 5 до 12 лет); [А] (дети до 5 лет) — Ингаляционные стероиды первоначально назначаются два раза в день, за исключением некоторых современных стероидов, назначаемых однократно в день. [А] (взрослые и подростки); [А] (дети в возрасте от 5 до 12 лет); [А] (дети в возрасте до 5 лет) – после достижения хорошего контроля ингаляционные стероиды можно применять один раз в день в той же суточной дозе.Для детей, получающих ≥ 400 мкг в день беклометазона дипропионата (БДП) или эквивалент:
В плане должны быть конкретные письменные рекомендации о замене стероидов в случае тяжелого интеркуррентного заболевания.
Ребенок должен быть под наблюдением педиатра и специалиста аллерголога/пульмонолога в период длительного лечения.
Возможные дополнения к терапии при недостаточной эффективности лечения на 2 ступени:
[А] (взрослые и подростки), [B] (дети в возрасте от 5 до 12 лет) – первым выбором дополнения к терапии ингаляционными стероидами у взрослых и детей в возрасте от 5 до 12 лет является добавление ингаляционных длительно действующих β2- агонистов при дозе 400 мкг БДП или эквивалента в сутки [B] (дети до 5 лет) — первым выбором в качестве дополнения к терапии ингаляционными стероидами являются антагонисты лейкотриеновых рецепторов. [D] (взрослые и подростки); [D] (дети в возрасте от 5 до 12 лет) – если контроль астмы остается субоптимальным после добавления ингаляционных длительно действующих β2 агонистов, то доза ингаляционных стероидов в эквиваленте БДП должна быть увеличена до 800 мкг/сут у взрослых или 400 мкг/сут у детей от 5 до 12 летУ взрослых и подростков с недостаточным контролем астмы на низких дозах ИГКС добавление ДДБА более эффективно, чем увеличение дозы ИГКС, в снижении частоты обострений, требующих применения пероральных стероидов, а также в улучшении показателей функции дыхания и уменьшении симптомов.
Ингаляторы, содержащие фиксированные комбинации, гарантируют применение ДДБА только вместе с ИГКС и могут улучшать комплаентность.
При уменьшении объема терапии, включающей комбинацию ИГКС/ДДБА, вероятность сохранения контроля выше при уменьшении дозы ИГКС в составе комбинации и отмене ДДБА после перехода на низкие дозы ИГКС.
[D] (взрослые и подростки); [D] (дети в возрасте от 5 до 12 лет) – если контроль остается недостаточным на дозе 800 мкг БДП день (взрослые и подростки) и 400 мкг в день (дети от 5 до 12 лет) ингаляционных стероидов в комбинации с длительно действующим β2- агонистом (ДДБА), рассматриваются следующие варианты :повышение дозы ингаляционных стероидов до максимальных (табл.6) + ДДБА
добавление антилейкотриеновых препаратов
добавление теофиллина замедленного высвобождения
Высокие дозы ингаляционных стероидов могут применяться с помощью дозированных аэрозольных ингаляторов (ДАИ) со спейсером или через небулайзер.
Если дополнительное лечение неэффективно, следует прекратить прием препаратов (в случае увеличения дозы ингаляционных стероидов – уменьшить до первоначальной дозы).
Прежде чем перейти к 5 ступени, направить пациентов с неадекватно контролируемой астмой, особенно детей, в отделение специализированной помощи для обследования.
У детей всех возрастов, которые получают специализированную медицинскую помощь, можно применить более высокие дозы ингаляционных кортикостероидов (более 800 мкг/сутки), прежде чем перейти к 5 ступени (нет контролируемых исследований).
Максимальная доза ИГКС до 1000 мкг в эквиваленте БДП
Минимально возможная доза пероральных стероидов
Пациенты на пероральных стероидах, которые ранее не получали ингаляционной терапии
[А] (взрослые и подростки); [D] (дети в возрасте от 5 до 12 лет) — у взрослых рекомендуется метод элиминации или уменьшения дозы стероидных таблеток на ингаляционных стероидах в дозах до 2000 мкг/сутки, если потребуется. У детей в возрасте от 5 до 12 лет необходима очень осторожная тактика при превышении дозы ингаляционных стероидов 800 мкг/сутки. [D] (взрослые и подростки); [D] (дети в возрасте от 5 до 12 лет), D (дети до 5 лет) – возможно пробное лечение с пролонгированными β2-агонистами, антагонистами лейкотриеновых рецепторов и теофиллинами в течение примерно шести недель. Они должны быть отменены, если нет уменьшения дозы стероидов, улучшения симптомов или функции легких.Таблица 6. Сравнительные эквипотентные суточные дозы (мкг) ИГКС для базисной терапии астмы у взрослых и подростков старше 12 лет (по GINA 2012 г.)
источник
Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей [1], которое проявляется: полной или частичной обратимой обструкцией дыхательных путей, возникающей вследствие спазма гладкой мускулатуры бронхов, отека и инфильтрации с
Бронхиальная астма (БА) — хроническое воспалительное заболевание дыхательных путей [1], которое проявляется:
- полной или частичной обратимой обструкцией дыхательных путей, возникающей вследствие спазма гладкой мускулатуры бронхов, отека и инфильтрации стенки бронха воспалительными клетками, гиперсекреции слизи, утолщения базальной мембраны;
- эпизодами кашля, свистящих хрипов, одышки, чувства стеснения в груди, которые, как правило, бывают связаны с воздействием специфических триггерных факторов и возникают преимущественно в ночное время или ранним утром;
- гиперреактивностью дыхательных путей.
БА — наиболее распространенное заболевание детского возраста, частота которого в США составляет 5–12% [2]. Чаще болеют мальчики, чем девочки (6% по сравнению с 3,7%), однако с наступлением пубертатного периода распространенность заболевания становится одинаковой у обоих полов [2]. БА чаще наблюдают у городских жителей, чем у сельских (7,1% и 5,7% соответственно) [3]. Заболевание тяжелее протекает у детей из семей с низким социальным статусом.
Профилактика БА связана с предупреждением развития аллергии у ребенка [4]. Первичная профилактика БА и аллергии направлена на предотвращение возникновения заболевания у лиц из групп риска. В настоящее время не существует эффективных пренатальных мер по первичной профилактике БА [5].
Постнатальная профилактика БА и аллергии предусматривает проведение следующих мероприятий:
- следует поощрять грудное вскармливание, обеспечивающее, помимо прочего, защитный эффект относительно возникновения свистящих хрипов в раннем возрасте [6, 7];
- курящих родителей детей необходимо предупредить о вреде курения для ребенка, в том числе о риске возникновения свистящих хрипов [8, 9]. Воздействие табачного дыма как в пренатальном, так и в постнатальном периоде оказывает неблагоприятное влияние на течение заболеваний, сопровождающихся бронхиальной обструкцией [5].
Мероприятия по вторичной профилактике БА и аллергии ориентированы на детей, у которых доказано наличие сенсибилизации, возможно наличие астмаподобных симптомов (кашля, свистящих хрипов, затруднения дыхания), но БА еще нет. Это дети из групп риска, у которых удается выявить:
- семейный анамнез БА или аллергию (риск БА до 50%);
- другие аллергические заболевания (атопический дерматит, аллергический ринит; риск БА — 10–20%);
- повышенный уровень общего иммуноглобулина Е (IgE) (более 30 МЕ/мл) в сочетании с выявлением специфических IgE-антител к белкам коровьего молока, куриного яйца, к аэроаллергенам более 0,35 МЕ/мл (у ребенка с атопическим дерматитом или аллергическим ринитом риск возрастает до 70%)
В целях вторичной профилактики БА в группах риска предлагается превентивная терапия цетиризином [10]. В исследовании ETAC показано, что назначение цетиризина в дозе 0,25 мг/кг/сут в течение 18 мес детям из группы высокого риска (с отягощенным аллергоанамнезом и кожными проявлениями аллергии) с бытовой или пыльцевой сенсибилизацией приводит к снижению частоты бронхообструкции с 40 до 20%. В ходе других более ранних исследований [5] была установлена протекторная роль специфической иммунотерапии в группах риска.
Третичная профилактика направлена на уменьшение воздействия провоцирующих факторов с целью улучшения контроля над течением БА у больных детей и уменьшения потребности в лекарственной терапии.
Соблюдение элиминационного режима может способствовать уменьшению тяжести течения уже существующего заболевания. Частый контакт с аллергенами у сенсибилизированных пациентов способствует усилению симптомов БА, развитию бронхиальной гиперреактивности, ухудшению функции легких [11–13].
Из аллергенов, с которыми человек контактирует в быту, следует выделить аллергены клещей домашней пыли, животных (имеющих шерсть или мех), тараканов и грибов. Рекомендуется проведение следующих мероприятий для уменьшения воздействия аллергенов клещей домашней пыли.
- Необходимо использовать специальные непроницаемые чехлы для матрацев, подушек и одеял [14, 15].
- Ковры или ковровые покрытия следует заменить на линолеум, или деревянные полы, либо паркет [16].
- Все постельные принадлежности нужно еженедельно стирать в горячей (55–60 °С) воде [17].
- Ковры необходимо обрабатывать акарицидными жидкостями и/или таниновой кислотой [18].
- Для уборки желательно использовать пылесос со встроенным HEPA-фильтром и пылесборником с толстыми стенками [19].
- Мягкие игрушки нужно стирать в горячей воде или периодически замораживать [20, 21]. Применение домашних ионизаторов воздуха не приводит к уменьшению выраженности симптомов БА [22].
- Необходимо устранить очаги плесени и не допускать высокой влажности в квартире в течение всего года.
Кроме перечисленных мероприятий, для уменьшения контакта с аллергенами домашних животных не следует пускать животное в спальню или основную жилую комнату [23], нужно заменить ковры или ковровые покрытия на линолеум, или деревянные полы, либо паркет. Даже после полного удаления животных из дома может пройти много месяцев, прежде чем концентрация аллергена снизится до приемлемых величин [25].
Причиной аллергической сенсибилизации часто бывают тараканы, особенно в городских домах [26]. Однако мероприятия по борьбе с ними оказывают лишь частичный эффект [27].
Пищевая аллергия является фактором обострения БА редко, главным образом у детей раннего возраста.
Риск аллергической сенсибилизации у детей увеличивает пассивное курение [28, 29]. Оно также повышает частоту и тяжесть симптомов у детей, страдающих БА. Всем пациентам с БА и родителям детей с БА следует воздерживаться от курения.
Важным в плане профилактики БА является ограничение контакта с полютантами внутри и вне помещений. Адекватная вентиляция и вытяжные устройства позволяют снизить концентрацию оксидов азота, угарного и углекислого газа, бытовых аэрозолей. Для ограничения воздействия летучих эфирных соединений не следует проводить ремонт помещений в присутствии больных детей или допускать их в только что отремонтированные квартиры. Необходимо помнить, что иногда в результате погодных и атмосферных условий возникают периоды особо интенсивного загрязнения атмосферного воздуха, когда более предпочтительным является пребывание дома в чистом, хорошо кондиционируемом помещении.
Пищевые факторы, как триггеры БА, могут быть актуальными в группе детей раннего возраста или у больных с пыльцевой сенсибилизацией. В процессе проведения провокационных тестов должны быть выявлены и в дальнейшем исключены из питания больных продукты, вызывающие обострение болезни. У таких больных нельзя использовать ацетилсалициловую кислоту и другие нестероидные противовоспалительные препараты (НПВП), так как они способны запускать особые механизмы аллергии, которые могут привести к тяжелым и угрожающим жизни обострениям БА. Важным является анамнестическое выявление аллергии на пенициллин с последующим исключением этой группы препаратов ввиду угрозы развития анафилактических реакций.
Одной из причин обострений и развития тяжелых форм БА, для которых характерно неконтролируемое течение, могут быть частые вирусные респираторные инфекции, а также сопутствующие риносинуситы. В связи с этим полезной может оказаться ежегодная противогриппозная вакцинация, хотя доказательств этого собрано недостаточно. Данный вопрос нуждается в дальнейшем изучении.
Всем детям старше 5 лет с рецидивирующими свистящими хрипами нужно проводить:
- спирометрию;
- пробы с бронхолитиком, физической нагрузкой;
- пикфлоуметрию с ведением дневника самоконтроля.
Классификация тяжести БА по клиническим признакам построена с учетом количества дневных симптомов в день/неделю, количества ночных симптомов в неделю, кратности применения β2-адреномиметиков короткого действия, значений пиковой скорости выдоха (ПСВ) или объема форсированного выдоха за 1-ю секунду (ОФВ1) и суточных колебаний ПСВ (вариабельности).
- Ступень 1 — интермиттирующая БА:
– симптомы возникают реже 1 раза в неделю;
– ночные симптомы возникают не чаще 2 раз в месяц;
– ОФВ1 или ПСВ 80% от должных величин;
– вариабельность показателей ПСВ или ОФВ1 30%.
Ступень 4 — тяжелая персистирующая БА:
– симптомы возникают ежедневно;
– ограничение физической активности;
– ОФВ1 или ПСВ 60% от должных величин;
– вариабельность показателей ПСВ или ОФВ1 > 30%.
Наличие хотя бы одного признака тяжести состояния позволяет отнести ребенка к данной категории.
Дети с интермиттирующим течением БА, но с тяжелыми обострениями должны получать терапию, как при персистирующей БА средней тяжести.
У детей с любой степенью тяжести, даже с интермиттирующей БА, могут быть тяжелые обострения.
Такой тип классификации, основанный на степени тяжести заболевания, важен в ситуации, когда необходимо решить вопрос о стартовой терапии при оценке состояния пациента.
Анамнез и физикальное обследование. Вероятность БА возрастает, если в анамнезе есть указания:
- на атопический дерматит, аллергический риноконъюнктивит либо отягощенный семейный анамнез по БА или другим атопическим заболеваниям;
- наличие хотя бы одного из следующих симптомов:
– кашель, усиливающийся преимущественно в ночное время;
– рецидивирующие свистящие хрипы;
– повторные эпизоды затрудненного дыхания;
– рецидивирующее чувство стеснения в грудной клетке;
появление или усиление симптомов:
– при контакте с: животными; химическими аэрозолями; клещами домашней пыли; пыльцой; табачным дымом;
– при перепадах температуры окружающей среды;
– при приеме лекарственных средств (ЛС) (ацетилсалициловая кислота, β-адреноблокаторы);
– при любых острых инфекционных заболеваниях респираторного тракта;
– при сильных эмоциональных нагрузках;
При физикальном обследовании необходимо обратить внимание на следующие признаки, характерные для БА:
- гиперэкспансия грудной клетки;
- удлинение выдоха или свистящие хрипы при аускультации;
- сухой кашель;
- ринит;
- периорбитальный цианоз — так называемые аллергические тени (темные круги под глазами из-за венозного застоя, возникающего на фоне назальной обструкции);
- поперечная складка на спинке носа;
- атопический дерматит.
Следует учитывать, что в стадии ремиссии патологическая симптоматика может отсутствовать (нормальная физикальная картина не исключает диагноза БА).
У детей в возрасте до 5 лет диагноз БА основывается главным образом на результатах клинического (но не функционального) обследования и анамнеза.
У детей грудного возраста, имевших три и более эпизодов свистящих хрипов, связанных с действием триггеров, следует подозревать БА, проводить обследование и дифференциальную диагностику.
Лабораторные и инструментальные исследования. У детей старше 5 лет необходимо определить ОФВ, форсированную жизненную емкость легких (ФЖЕЛ) и отношение ОФВ1/ФЖЕЛ. Спирометрия позволяет оценить степень обструкции, ее обратимость и вариабельность, а также тяжесть течения заболевания. При оценке показателей ОФВ1 и ФЖЕЛ важно учитывать этнические особенности и возрастные градации. При нормальной функции легких отношение ОФВ1 к ФЖЕЛ составляет более 80%, а у детей, возможно, более 90%. Любые значения ниже приведенных могут предполагать бронхиальную обструкцию. В пользу диагноза БА также свидетельствует подтверждение обратимости бронхиальной обструкции — увеличение ОФВ1 по крайней мере на 12% после ингаляции сальбутамола либо в ответ на пробную терапию глюкокортикоидами [30].
Пикфлоуметрия (определение пиковой скорости выдоха) — важный метод диагностики и последующего контроля за лечением БА. Последние модели пикфлоуметров относительно недороги, портативны, выполнены из пластика и идеально подходят для использования пациентами старше 5 лет в домашних условиях с целью ежедневной оценки течения БА. При анализе показателей ПСВ у детей используют специальные нормограммы, но более информативен ежедневный мониторинг ПСВ в течение 2–3 нед для определения индивидуального наилучшего показателя [31]. ПСВ измеряют утром (обычно наиболее низкий показатель) и вечером перед сном (как правило, наиболее высокий показатель). Заполнение больным дневников самоконтроля с ежедневной регистрацией в них симптомов, результатов ПСВ и лечения играет важную роль в стратегии лечения БА. Мониторинг ПСВ может быть информативен для определения ранних симптомов обострения заболевания. Дневной разброс показателей ПСВ более чем на 20% рассматривается как диагностический признак БА, а величина отклонений прямо пропорциональна тяжести заболевания [32]. Результаты пикфлоуметрии свидетельствуют в пользу диагноза БА, если ПСВ увеличивается по крайней мере на 15% после ингаляции бронхолитика или при пробном назначении глюкокортикоидов [33].
У пациентов c симптомами, характерными для БА, но с нормальными показателями функции легких в постановке диагноза БА может помочь исследование реакции дыхательных путей на физическую нагрузку [34]. В исследовательских целях для выявления бронхиальной гиперреактивности можно использовать тест с метахолином или гистамином. При диагностике БА эти тесты имеют высокую чувствительность, но низкую специфичность [35].
У некоторых детей симптомы БА провоцирует только физическая нагрузка. В этой группе полезно проведение нагрузочного теста (6-минутный протокол нагрузки бегом). Использование этого теста совместно с определением ОФВ1 или ПСВ может быть полезно для постановки точного диагноза БА [36].
Кожные тесты с аллергенами или определение общего или специфических IgE в сыворотке крови мало информативны для диагностики БА. Однако эти исследования помогают выявить аллергический характер заболевания, установить факторы риска и триггеры, на основании чего может быть рекомендован соответствующий контроль факторов окружающей среды [37].
Дифференциальную диагностику БА чаще всего приходится проводить со следующими заболеваниями:
- дисфункция голосовых связок (псевдоастма);
- бронхиолит;
- аспирация инородного тела или молока у детей грудного возраста;
- муковисцидоз;
- первичные иммунодефициты;
- синдром первичной цилиарной дискинезии;
- трахео- или бронхомаляция;
- пороки развития сосудов, вызывающие внешнее сдавление дыхательных путей;
- стеноз или сужение дыхательных путей, связанные с наличием гемангиом или других опухолей, гранулем или кист;
- облитерирующий бронхиолит;
- интерстициальные заболевания легких;
- застойные пороки сердца;
- туберкулез;
- бронхолегочная дисплазия;
- долевая эмфизема.
При наличии следующих симптомов следует заподозрить отличное от БА заболевание [38]:
– появление симптомов заболевания в возрасте до 2 лет;
– респираторный дистресс-синдром и/или применение искусственной вентиляции легких (ИВЛ);
– неврологическая дисфункция в неонатальном периоде;
– отсутствие эффекта от применения бронхолитиков;
– свистящие хрипы, связанные с кормлением или рвотой;
– затруднение глотания и/или рецидивирующая рвота;
– плохая прибавка массы тела;
– сохранение потребности в оксигенотерапии в течение более 1 нед после обострения заболевания.
– деформация пальцев рук в виде «барабанных палочек»;
– очаговые изменения в легких;
– крепитация при аускультации;
Результаты лабораторных и инструментальных исследований:
– очаговые или инфильтративные изменения на рентгенограмме органов грудной клетки;
– необратимая обструкция дыхательных путей;
Основаниями для направления на консультацию к другим специалистам служат:
- сомнительный или не уточненный диагноз;
- наличие симптомов с рождения или перинатальные заболевания легких;
- неукротимая рвота;
- тяжелые инфекции верхних дыхательных путей;
- персистирующий влажный кашель;
- наличие в семейном анамнезе необычного заболевания органов грудной клетки;
- плохая прибавка массы тела;
- неожиданные клинические находки (очаговые изменения в легких, дисфагия, патологический голос или крик, инспираторный стридор);
- отсутствие ответа на терапию (особенно при терапии ингаляционными глюкокортикоидами в дозе более 400 мкг/сут или необходимость частого применения пероральных глюкокортикоидов).
Целями терапии БА являются достижение и поддержание контроля над заболеванием. Контроль БА является комплексным понятием, включающим, согласно рекомендациям GINA (Global Initiative For Asthma, www.ginasthma.com), совокупность следующих показателей:
- минимальное количество хронических симптомов, включая ночные (в идеале симптомов нет);
- минимальное количество обострений (или нечастые обострения);
- отсутствие необходимости в скорой помощи;
- минимальная потребность в β2-адреномиметиках и других препаратах скорой помощи (в идеале не применяют);
- отсутствие ограничений активности, включая физическую нагрузку;
- циркадные вариации ПСВ менее 20%;
- нормальная (близкая к нормальной) ПСВ;
- отсутствие нежелательных лекарственных явлений или их минимальные проявления.
Достижение контроля БА должно быть целью терапии для всех пациентов вне зависимости от степени тяжести. Поскольку некоторые показатели, определяющие контроль БА неоднозначны и открыты для интерпретации, были разработаны более строгие и четкие характеристики контроля и выделено два его уровня (табл. 1). В исследовании GOAL было показано, что при терапии, направленной на достижение полного контроля, у значительной части пациентов (более 40%) возможно достижение полного контроля, а у большинства — достижение хорошего. Поскольку в исследование GOAL включались дети 12 лет и старше, неизвестно, можно ли экстраполировать полученные данные на младшие возрастные группы.
Показаниями к госпитализации служат:
– затрудненное дыхание в покое, вынужденное положение, речь отдельными словами, отказ от еды у младенцев, возбуждение, сонливость или спутанное сознание, брадикардия или одышка (частота дыхательных движений более 30 в минуту);
– наличие громких свистящих хрипов или их отсутствие;
– ЧСС более 120 в минуту (у детей грудного возраста более 160 в минуту);
– ПСВ менее 60% от должной или наилучшей индивидуальной величины, даже после начальной терапии;
К средствам базисной терапии относят ЛС с противовоспалительным и/или профилактическим эффектом (глюкокортикоиды, кромоны, антилейкотриеновые, анти-IgE- и антицитокиновые препараты) и длительно действующие бронходилататоры (длительно действующие β2-адреномиметики, препараты теофиллина с медленным высвобождением). Наиболее эффективные средства базисной терапии в настоящее время — это ингаляционные глюкокортикоиды (ИГК).
К средствам, облегчающим течение заболевания, относят ингаляционные короткодействующие β-адреномиметики (наиболее эффективные бронходилататоры), антихолинергические препараты, препараты теофиллина с немедленным высвобождением и пероральные короткодействующие β-адреномиметики.
Выбор терапии основывается на тяжести БА, доступности антиастматических препаратов, особенностях системы здравоохранения, соотношении риск/польза от применения препарата, культуре, личных обстоятельствах пациента и его семьи. При этом следует учитывать, что:
- ЛС для контроля заболевания принимают ежедневно длительно для достижения и поддержания контроля БА;
- препараты неотложной помощи действуют быстро, устраняя бронхоконстрикцию и сопутствующие ей острые симптомы, такие, как свистящие хрипы, чувство стеснения в груди и кашель.
Препараты для лечения БА вводят различными путями: пероральным, парентеральным и ингаляционным. Последний предпочтительнее [39, 40].
При выборе устройства для ингаляции учитывают эффективность доставки ЛС, стоимость/эффективность и удобство применения [41] (табл. 2).
У детей применяют три типа устройств для ингаляции: небулайзеры, дозированные аэрозольные ингаляторы (ДАИ) и дозированные порошковые ингаляторы (ДПИ) [42]. У детей при обострении тяжелой БА предпочтительнее применять небулайзеры. Доставку препаратов с их помощью осуществляют в течение 5 мин [46].
Рассмотрим препараты, контролирующие течение заболевания.
Кромоны. Кромоглициевая кислота менее эффективна, чем ИГК [43–45] в отношении клинических симптомов, функции внешнего дыхания, БА физического усилия, гиперреактивности дыхательных путей. Длительная терапия кромоглициевой кислотой при БА у детей по эффективности не отличается значительно от плацебо [46, 47].
Недокромил, назначенный перед физической нагрузкой, позволяет уменьшить тяжесть и продолжительность вызванной ею бронхоконстрикции [48]. Недокромил так же, как и кромоглициевая кислота, менее эффективен, чем ИГК [49, 50]. Кромоны противопоказаны при обострении БА, когда требуется интенсивная терапия бронхорасширяющими препаратами быстрого действия. Роль кромонов в базисной терапии БА у детей ограничена, особенно у детей дошкольного возраста, в связи с отсутствием доказательств их эффективности. Проведенный в 2000 г. метаанализ не позволил сделать однозначный вывод об эффективности кромоглициевой кислоты как средства базисной терапии БА у детей.
При неэффективности кромонов в течение 4-8 нед следует перейти на ИГК.
ИГК. В настоящее время ИГК являются самыми эффективными препаратами для контроля БА, поэтому их рекомендуют для лечения персистирующей БА любой степени тяжести [5, 51]. У детей школьного возраста поддерживающая терапия ИГК позволяет контролировать симптомы БА, уменьшает частоту обострений и количество госпитализаций, повышает качество жизни, улучшает функцию внешнего дыхания, снижает гиперреактивность бронхов и уменьшает бронхоконстрикцию при физической нагрузке [52–56]. Применение ИГК у детей дошкольного возраста, страдающих БА, приводит к клинически значимому улучшению состояния, включая балльную оценку дневного и ночного кашля, свистящего дыхания и одышки, физической активности, применения препаратов неотложного действия и использования ресурсов системы здравоохранения [57–61]. В настоящее время ИГК являются единственными препаратами базисной терапии у детей младше 3 лет, эффективность которых доказана исследованиями, проведенными в течение длительного периода времени. У детей применяют следующие ИГК: беклометазон, флутиказон, будесонид [62] (табл. 3, 4).
При длительной терапии ИГК (в средней дозе 450 мкг/сут по беклометазону дипропионату (БДП)) никаких побочных эффектов на плотность костной ткани не выявили [63–71]. У больных с легкой БА применение ИГК в дозе 400 мкг/сут по БДП или меньше не влияет на метаболизм костной ткани. Применение более высоких доз (800 мкг/сут по БДП) приводит к обратимому торможению как процесса образования кости, так и ее деградации [72–77].
Применение ИГК в дозе 100–200 мкг/сут по БДП не оказывает никаких статистически или клинически значимых негативных эффектов на рост пациентов [78–81]. Дети, больные БА, получающие лечение ИГК, во взрослом возрасте достигают нормальных итоговых показателей роста [82–84].
Лечение ИГК в дозе менее 400 мкг/сут по БДП обычно не сопровождается значимым угнетением гипоталамо-гипофизарно-надпочечниковой системы у детей [85–87], большей частотой развития катаракты [88–92]. Клинически проявляющаяся молочница редко становится значительной проблемой у детей, получающих ингаляционные или системные глюкокортикоиды. Применение спейсеров уменьшает частоту кандидоза полости рта [93, 94].
Системные глюкокортикоиды. Использование пероральных глюкокортикоидов у детей с БА ограничено обострениями, вызванными вирусными инфекциями [95–97]. Несмотря на то что системные глюкокортикоиды эффективны в отношении БА, необходимо учитывать нежелательные явления при длительной терапии, такие, как угнетение гипоталамо-гипофизарно-надпочечниковой системы, увеличение массы тела, стероидный диабет, катаракта, артериальная гипертензия, задержка роста, иммуносупрессия, остеопороз, психические расстройства [98, 99].
Ингаляционные β2-адреномиметики длительного действия. Препараты этой группы эффективны для поддержания контроля БА, их применяют в комбинации с ИГК [100] и перед интенсивной физической нагрузкой в тех случаях, когда стандартные начальные дозы не позволяют достичь контроля БА. Эффект этих препаратов сохраняется на протяжении 12 ч.
Формотерол в виде ингаляций начинает действовать через 3 мин, максимальный эффект развивается через 30–60 мин после ингаляции [101, 102].
Салметерол в виде ингаляций начинает действовать относительно медленно, значимый эффект отмечают через 10–20 мин после ингаляции однократной дозы 50 мкг [103], а эффект, сопоставимый с таковым сальбутамола, развивается через 30 мин [104]. Из-за медленного начала действия салметерол не следует назначать для купирования острых симптомов БА.
Дети хорошо переносят лечение ингаляционными β2-адреномиметиками длительного действия даже при продолжительном применении, а их побочные эффекты сопоставимы с таковым β2-адреномиметиков короткого действия (в случае их применения по требованию).
Пероральные β2-адреномиметики длительного действия. Препараты этой группы включают лекарственные формы сальбутамола и тербуталина длительного действия. Эти препараты могут помочь в контроле ночных симптомов БА. Их можно использовать в дополнение к ИГК, если последние в стандартных дозах не обеспечивают достаточного контроля ночных симптомов [105, 106]. Возможные побочные эффекты включают стимуляцию сердечно-сосудистой системы, тревогу и тремор.
Комбинированные препараты. Комбинация длительно действующего β2-адреномиметика и ИГК в низкой дозе более эффективна, чем увеличение дозы последнего [107, 108]. Комбинированная терапия салметеролом + флутиказоном через один ингалятор способствует лучшему контролю БА, чем длительно действующий β2-адреномиметик и ИГК в отдельных ингаляторах [109]. На фоне терапии салметеролом + флутиказоном практически у каждого второго пациента можно достичь полного контроля БА. Отмечают значительное улучшение показателей эффективности терапии (ПСВ, ОФВ1, частоты обострений, качества жизни) [110].
Терапия будесонидом + формотеролом в составе одного ингалятора обеспечивает лучший контроль симптомов БА по сравнению с одним будесонидом у пациентов, у которых ранее ИГК не обеспечивали контроля симптомов [111].
Метилксантины. Теофиллин значительно более эффективен, чем плацебо, для контроля симптомов БА и улучшения функции легких даже в дозах ниже обычно рекомендуемого терапевтического диапазона. Применение теофиллинов для лечения БА у детей проблематично из-за возможности тяжелых быстро возникающих (сердечная аритмия, смерть) и отсроченных (нарушение поведения, проблемы в обучении и пр.) побочных эффектов.
Антагонисты лейкотриеновых рецепторов. Антилейкотриеновые препараты (зафирлукаст, монтелукаст) можно использовать для усиления терапии у детей при среднетяжелой и тяжелой БА в тех случаях, когда заболевание недостаточно контролируется применением низких доз ИГК. Несмотря на то что антилейкотриеновые препараты не изучались как средства монотерапии при легкой персистирующей БА у детей, GINA (2002) рекомендует их использование как альтернативный вариант монотерапии при легкой персистирующей БА. При применении антагонистов лейкотриеновых рецепторов в качестве монотерапии у больных с тяжелой и среднетяжелой БА отмечают умеренное улучшение функции легких (у детей 6 лет и старше) и контроля БА (у детей 2 лет и старше) [5]. Зафирлукаст обладает умеренной эффективностью в отношении функции внешнего дыхания у детей 12 лет и старше со среднетяжелой и тяжелой БА.
Антихолинергические препараты. Антихолинергические препараты (ипратропия бромид) при применении отдельно или в комбинации с другими бронходилататорами (в основном β2-адреномиметиками) показаны для терапии бронхоспазма, ассоциированного с БА. Однако препараты этой группы с целью контроля течения БА в педиатрической практике применяют крайне ограниченно.
Безопасность и эффективность ипратропия бромида у детей младше 6 лет не установлены. У детей дошкольного возраста применение ипратропия бромида имеет лишь незначительное влияние на уровень контроля БА, рутинное применение антихолинергических препаратов в дополнение к β2-адреномиметикам не оправдано.
Средства неотложной терапии. Ингаляционные β2-адреномиметики быстрого действия — самые эффективные из существующих бронхолитиков, их считают препаратами выбора для лечения острого бронхоспазма [112, 113].
Антихолинергические препараты имеют ограниченное значение в лечении БА у детей [114].
Комбинация ингаляционного β2-агониста быстрого действия и антихолинергического препарата обеспечивает более выраженный бронхорасширяющий эффект и должна быть назначена до лечения метилксантинами. Применение комбинации сопровождается снижением потребности в госпитализации.
Принципы диагностики обострений приведены в таблице 6.
Ступень 1, легкая интермиттирующая БА. У пациентов с легкой интермиттирующей БА симптомы болезни появляются только при контакте с аллергеном или триггером. В отсутствие контакта симптомы болезни отсутствуют, а показатели функции легких находятся в пределах нормы. Интермиттирующую форму БА также диагностируют у больных с эпизодами БА физического усилия. Нечастые симптомы и ненарушенная функция легких являются основанием для того, чтобы не рекомендовать при этой форме БА длительную терапию противовоспалительными препаратами (табл. 7). Пациенты нуждаются в лекарственной терапии в периоды обострения болезни.
В качестве средств неотложной помощи используют ингаляционные формы сальбутамола.
Если у пациента необходимость в приеме ЛС появляется чаще 1 раза в неделю на протяжении более 3 мес, его следует расценивать как больного с легкой персистирующей БА. Дети с интермиттирующей БА, но с тяжелыми обострениями должны расцениваться как имеющие персистирующую БА средней степени тяжести.
Ступень 2, легкая персистирующая БА. Препараты выбора у детей любого возраста — ИГК в низких дозах (беклометазон, флутиказон, будесонид). В качестве альтернативных препаратов для контроля БА рассматривают теофиллины замедленного высвобождения и кромоны. В случае сохранения симптомов болезни у пациента, начавшего лечение БА с использования теофиллина медленного высвобождения или кромонов, следует спустя 4 нед назначить ИГК.
Монотерапия другими препаратами (кроме глюкокортикоидов) менее эффективна для контроля воспаления при БА.
Исследование монотерапии b2-адреномиметиками длительного действия у детей выявило некоторую эффективность этих средств, однако результаты исследований противоречивы. Применение антилейкотриеновых препаратов у детей с легкой персистирующей БА не изучалось. У пациентов с более тяжелыми формами заболевания препараты этой группы обладают умеренной эффективностью, поэтому их можно использовать у некоторых пациентов для контроля БА.
У детей старше 12 лет в качестве стартовой терапии может быть выбрана комбинация ИГК и длительно действующего β2-адреномиметика. Как было показано в исследовании GOAL, такой подход способен обеспечить полный контроль БА у большего количества пациентов при меньшей дозе глюкокортикоидов по сравнению с монотерапией ИГК.
Помимо регулярного применения препаратов для контроля БА, пациенту должен быть доступен ингаляционный β2-адреномиметик быстрого действия для купирования симптомов при необходимости, однако частота его применения не должна превышать 3–4 раз в сутки. Применение симптоматических препаратов более 4 раз в сутки указывает на плохой контроль БА по данной схеме терапии, в таких случаях следует считать, что пациент имеет более тяжелую степень БА.
Ступень 3, среднетяжелая персистирующая БА. При среднетяжелой персистирующей БА симптомы возникают ежедневно в течение длительного времени или ночью, чаще 1 раза в неделю. Диагноз персистирующей БА средней тяжести ставят пациенту с исходным значением ПСВ до приема ЛС более 60%, но менее 80% от должного и вариабельностью ПСВ от 20 до 30%. Если течение БА не удается контролировать низкими дозами ИГК (ступень 2), то такую БА следует расценивать как персистирующую средней степени тяжести.
Больные со среднетяжелой персистирующей БА должны ежедневно принимать противовоспалительные препараты с целью установления контроля над течением заболевания. Препаратами выбора у детей старше 5 лет являются ИГК (беклометазон, флутиказон, будесонид) в низких/средних дозах и β2-адреномиметики длительного действия, а у детей младше 5 лет — ИГК в средних дозах. Лучше всего в качестве средств усиливающей терапии изучены ингаляционные β2-адреномиметики длительного действия. Кроме того, можно также применять теофиллин медленного высвобождения и антилейкотриеновые препараты (монтелукаст, зафирлукаст). Эффективность этих препаратов варьирует у отдельных пациентов, поэтому дополнительную терапию следует выбирать индивидуально.
Помимо регулярного применения препаратов для контроля БА, у пациента должен быть ингаляционный β2-адреномиметик быстрого действия, который следует использовать при необходимости для купирования симптомов, но не чаще 3–4 раз в сутки.
Если контроля БА достичь не удается, следует начать лечение, соответствующее ступени 4.
Ступень 4, тяжелая персистирующая БА. Терапией первого ряда при тяжелой персистирующей БА у детей является комбинация ИГК (флутиказон, будесонид) в высоких дозах и ингаляционных длительно действующих β2-адреномиметиков (салметерол, формотерол). С этой целью рекомендованы также препараты комбинированной терапии, так называемые фиксированные комбинации (флутиказон + салметерол, будесонид + формотерол). Дополнительное назначение β2-адреномиметика длительного действия к базисной терапии ИГК при неконтролируемом течении болезни дает больший клинический эффект, чем увеличение дозы ИГК в 2 раза и более. Хотя ингаляционные β2-адреномиметики длительного действия лучше всего изучены и наиболее предпочтительны в качестве дополнительной терапии, однако можно использовать теофиллин медленного высвобождения, антилейкотриеновые препараты.
В некоторых случаях на ступенях 2–4 может потребоваться применение короткого курса системных глюкокортикоидов для быстрого достижения контроля заболевания. По материалам Executive Summary of the NAEPP Expert Panel Report (2002), рекомендуемая доза пероральных глюкокортикоидов для короткого курса составляет 1–2 мг/кг/сут (по преднизолону) и не должна превышать 60 мг/сут. Длительное лечение пероральными глюкокортикоидами следует начинать в минимально возможных дозах, лучше всего в виде однократного приема утром для сведения к минимуму возможных побочных эффектов. При переводе больных с пероральных на ИГК необходимо установить наблюдение в связи с риском развития симптомов надпочечниковой недостаточности. У больных, получающих комбинированную терапию, начать снижение объема лечения следует с уменьшения дозы ИГК примерно на 25% каждые 3 мес. После того как доза глюкокортикоидов будет составлять менее 800 мкг будесонида в сутки (для детей младше 12 лет) или эквивалента, следует отменить дополнительную терапию. На этапе уменьшения интенсивности терапии рекомендуется наблюдать пациента не реже 1 раза в 3 мес.
При тяжелой БА контроль над симптомами достигается далеко не всегда, в таком случае цель лечения заключается в получении наилучших возможных результатов.
В дополнение к базисной терапии используется β2-адреномиметик быстрого действия по потребности для облегчения симптомов, но желательно не чаще 3–4 раз в сутки.
Ступенчатый подход лечения БА подразумевает увеличение уровня терапии при возрастании степени тяжести заболевания. Если пациент уже получает лечение, классификация тяжести БА должна основываться на имеющихся клинических признаках и дозах ежедневно принимаемых ЛС (табл. 9). Например, пациенты с сохраняющимися (несмотря на проведение терапии, соответствующей данной ступени) симптомами легкой персистирующей БА должны рассматриваться как имеющие персистирующую БА средней тяжести. То есть при ступенчатом подходе к терапии переход на более высокую ступень показан в том случае, если контроля не удается достичь или он был утрачен на фоне проводимой терапии, причем необходимо убедиться, что пациент правильно принимает препараты. Целью лечения является достижение контроля над болезнью с применением наименьшего количества препаратов.
Таким образом, комбинация текущего уровня симптомов и текущей ступени лечения дает возможность установить тяжесть БА для пациента и назначить соответствующее лечение. После того как контроль над заболеванием установлен и поддерживается в течение не менее 3 мес, следует попытаться уменьшить объем терапии (ступень вниз) и определить минимальное лечение, необходимое для сохранения контроля. Если контроль поддерживается не менее 3 мес, степень тяжести заболевания должна быть пересмотрена в соответствии с новым лечением.
В ходе лечения необходимо проводить обучение пациента. Обучение пациента подразумевает установление партнерских отношений между ним, его семьей и медицинским работником. Хорошее взаимопонимание очень важно как основа комплаентности [115–118]. Пациентов необходимо обучить:
- избегать факторов риска;
- правильно принимать ЛС;
- различать ЛС для контроля заболевания и для купирования симптомов обострения;
- мониторингу симптомов заболевания, ПСВ (у детей старше 5 лет);
- распознавать признаки, предполагающие ухудшение БА, и предпринимать соответствующие действия;
- обращаться за медицинской помощью при необходимости.
Персистирующую БА гораздо эффективнее контролировать с помощью длительной противовоспалительной терапии, чем лечением только симптомов обострения заболевания. Существуют два подхода для достижения контроля над БА.
- Быстрое достижение контроля путем начала лечения с более высокого уровня (например, короткий курс пероральных глюкокортикоидов и/или применение более высоких доз ИГК в сочетании с β2-адреномиметиком длительного действия в дополнение к терапии, соответствующей степени тяжести БА у пациента).
- Начало лечения со ступени, соответствующей степени тяжести заболевания, с последующим увеличением на ступень вверх при необходимости.
Первый подход более предпочтителен.
Ступень вверх («step up»): если контроль над заболеванием не достигнут. Улучшение состояния должно наступить в течение месяца (обязательно нужно проверить технику ингаляции ребенка, комплаентность, исключить факторы риска).
Ступень вниз («step down»): если контроль над заболеванием сохраняется в течение 3 мес; уменьшение количества ЛС и их дозы (препаратов базисной терапии — примерно на 25%) в соответствии со ступенчатым подходом для достижения минимального объема лечения, необходимого для сохранения контроля. При комбинированной терапии снижение объема терапии должно начинаться с ИГК до достижения дозы, эквивалентной 500 мкг по беклометазону, затем может быть рассмотрена возможность отмены второго препарата комбинации.
Терапию необходимо пересматривать каждые 3–6 мес (если контроль БА достигнут). Дополнительными и крайне важными компонентами ведения пациентов с БА являются постоянный мониторинг симптомов и ПСВ с ведением дневника самоконтроля и разработка индивидуального плана действий.
У детей с повторяющимися эпизодами свистящих хрипов на фоне острой вирусной инфекции, не имеющих признаков атопии и атопических заболеваний в семейном анамнезе, симптомы обычно исчезают в дошкольном возрасте и БА в дальнейшем не развивается, хотя могут сохраняться минимальные изменения функции легких и бронхиальная гиперреактивность. При возникновении свистящих хрипов в раннем возрасте (до 2 лет) вероятность того, что симптомы будут сохраняться и в более позднем возрасте, невелика [119–121]. У детей младшей возрастной группы с частыми эпизодами свистящих хрипов, БА в семейном анамнезе и проявлениями атопии риск развития БА в возрасте 6 лет значительно увеличивается [122]. Мужской пол является фактором риска для возникновения БА в препубертатном периоде, однако существует большая вероятность того, что БА по достижении взрослого возраста исчезнет. Женский пол является фактором риска персистирования БА во взрослом возрасте.
По вопросам литературы обращайтесь в редакцию.
Л. С. Намазова, доктор медицинских наук, профессор
Л. М. Огородова, доктор медицинских наук, профессор
Н. А. Геппе, доктор медицинских наук, профессор
Ю. Г. Левина, кандидат медицинских наук
К. Е. Эфендиева, кандидат медицинских наук
Ф. И. Петровский, кандидат медицинских наук
НЦЗД РАМН, ММА им. И. М. Сеченова, СибГМУ, Москва, Томск
источник
FENO выдыхаемая концентрация оксида азота
IgE иммуноглобулины класса E
PaO2 парциальное давление кислорода в артериальной крови
PaCO2 парциальное давление углекислого газа в артериальной крови
АСИТ аллерген-специфическая иммунотерапия
БГР бронхиальная гиперреактивность
ДАИ дозированный аэрозольный ингалятор
ДДБА длительно действующие β2-агонисты
ДПИ дозированный порошковый ингалятор
ИГКС ингаляционные глюкокортикостероиды
КДБА короткодействующие β2-агонисты
ОФВ1 объем форсированного выдоха за 1 секунду
ПК20 провокационная концентрация метахолина, вызывающая 20%-ное падение
ПКИТ подкожная иммунотерапия
ПНЖК полиненасыщенные жирные кислоты
ПСВ пиковая скорость выдоха
СЛИТ сублингвальная иммунотерапия
ХОБЛ хроническая обструктивная болезнь легких
- Долгосрочными целями при лечении БА являются достижение хорошего контроля симптомов миминимизация риска возникновения обострений, фиксированного ограничения воздушного потока и побочных эффектов, связанных с терапией, в будущем. Также необходимо определить собственные цели пациента в отношении БА и лечения.
- Для эффективного лечения БА требуется сотрудничество между пациентом с БА (или родителем/опекуном) и медицинскими работниками.
- Обучение медицинских работников навыкам общения может привести к повышению удовлетворенности пациента лечением, улучшению клинических результатов и снижению использования ресурсов здравоохранения.
- Необходимо принимать во внимание уровень медицинской грамотности пациента, т.е. способность получать, анализировать и понимать базовую медицинскую информацию, необходимую для принятия правильных решений, касающихся здоровья.
- Лечение, основанное на контроле, означает, что терапия корректируется в рамках непрерывного цикла, состоящего из проведения оценки, назначения лечения и анализа ответа пациента в отношении контроля симптомов и риска возникновения обострений и побочных эффектов в будущем.
- Для принятия решения о лечении БА на популяционном уровне «предпочтительный вариант» для каждой ступени терапии представляет собой наилучшее лечение для большинства пациентов, основанное на результатах оценки средних по группе эффективности и безопасности по данным рандомизированных контролируемых клинических исследований, метаанализов и наблюдательных исследований, а также оценки себестоимости лечения.
- В индивидуальном порядке при принятии решения о назначении терапии также необходимо учитывать все характеристики пациента и его фенотип, что наряду с предпочтениями пациента и практическими вопросами (техника ингаляции, соблюдение предписанного режима терапии и ее стоимость для пациента) может помочь предсказать вероятный ответ пациента на терапию. [1]
Современные цели терапии стабильной БА включают:
- достижение и поддержание хорошего контроля симптомов БА в течение длительного времени;
- минимизацию рисков будущих обострений БА, фиксированной обструкции дыхательных путей и нежелательных побочных эффектов терапии.
Целями лечения обострений БА являются как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов. [2]
Лекарственные средства и стратегии, направленные на контроль симптомов и снижение риска
- В настоящее время на ступени 1 терапии применяется короткодействующий β2-агонист (КДБА) в виде монотерапии по потребности. В то же время даже у пациентов с редкими или недавно появившимися симптомами БА обнаруживается хроническое воспаление дыхательных путей, причем в таких популяциях проведено неожиданно малое количество исследований терапии ИГКС.
- Лечение с постоянным ежедневным применением ИГКС в низкой дозе высокоэффективно в плане уменьшения выраженности симптомов БА, а также снижения связанного с БА риска обострений, госпитализаций и случаев смерти.
- У пациентов со стойкими симптомами и/или обострениями, развивающимися, несмотря на применение ИГКС в низкой дозе, рекомендуется рассмотреть повышение интенсивности терапии, но сначала нужно оценить наиболее распространенные проблемы, такие как техника ингаляции, приверженность терапии, постоянное воздействие аллергена и сопутствующие заболевания.
- У взрослых и подростков предпочтительным вариантом повышения интенсивности терапии является комбинация ИГКС/длительнодействующий β2-агонист (ДДБА).
- У взрослых и подростков, у которых обострения развиваются, несмотря на применение других методов лечения, риск обострений снижается при применении низкой дозы комбинации ИГКС/формотерола (с беклометазоном или будесонидом) как в качестве поддерживающей терапии, так и для купирования симптомов в сравнении с поддерживающей терапией вместе с КДБА, применяемым по потребности.
- У детей в возрасте 6–11лет повышение дозы ИГКС предпочтительнее, чем переход на терапию комбинацией ИГКС/ДДБА.
- Рассмотреть возможность снижения интенсивности терапии сразу после достижения хорошего контроля БА и сохранения его на протяжении приблизительно 3 мес, что позволит определить самый низкий уровень терапии, обеспечивающий контроль симптомов и обострений.
o Предоставить пациенту письменный план действий при БА, обеспечить тщательный контроль и запланировать визит в рамках последующего наблюдения.
o Не отказываться от использования ИГКС полностью, за исключением случаев временной необходимости, когда это требуется для подтверждения диагноза БА.
o Обеспечить обучение навыкам использования ингалятора: пациенты часто используют неправильную технику ингаляции, что влияет на эффективность лекарственного средства.
o ○Поощрять соблюдение предписанного режима терапии препаратом для контроля заболевания, даже если симптомы развиваются редко.
o Провести обучение по самоуправлению БА (самостоятельный контроль симптомов и/или ПСВ, письменный план действий при БА и регулярная оценка врачом) с целью контроля симптомов и минимизации риска обострений, а также минимизации использования ресурсов здравоохранения.
- Для пациентов с одним или несколькими факторами риска обострений:
o Назначить регулярную ежедневную терапию ИГКС, предоставить письменный план действий при БА, а также организовать более частую оценку, чем у пациентов с низким риском.
o Выявить и устранить модифицируемые факторы риска (например, курение, низкие показатели функции внешнего дыхания).
o Рассмотреть нефармакологические стратегии и меры по оказанию помощи, направленной на контроль симптомов и снижение риска (например, рекомендации по отказу от курения, дыхательные упражнения, некоторые стратегии, направленные на избегание воздействия аллергенов). [1]
Категории лекарственных средств для лечения бронхиальной астмы:
Препараты для долгосрочной терапии БА можно разделить на три основные категории.
- Препараты для контроля заболевания: применяются для регулярной поддерживающей терапии. Обеспечивают контроль симптомов, уменьшают воспаление дыхательных путей и снижают риск возникновения обострений и ухудшения показателей функции внешнего дыхания в будущем.
- Препараты неотложной помощи: назначаются всем пациентам для применения по потребности с целью купирования бронхоспазма и сопутствующих ему симптомов, в том числе при ухудшении течения БА или обострениях. Также применение этих препаратов рекомендуется для кратковременной профилактики бронхоспазма, вызванного физическими упражнениями. Сокращение и, в идеале, отсутствие необходимости в применении препаратов неотложной помощи являются и важной целью лечения, и критерием его эффективности.
- Дополнительные препаратыу пациентов с тяжелой БА: их применение может рассматриваться в случае, если у пациентов наблюдаются постоянные симптомы и/или обострения, несмотря на оптимизированную терапию с применением препаратов для контроля заболевания в высоких дозах (как правило, ИГКС и ДДБА) и оказание воздействия на модифицируемые факторы риска. [1]
Начальная терапия, направленная на контроль заболевания
- Для получения наилучших результатов необходимо начать регулярную ежедневную терапию, направленную на контроль заболевания, в максимально короткие сроки после установления диагноза БА, так как данные свидетельствуют о том, что:
o раннее начало применения ИГКС в низкой дозе у пациентов с БА приводит к более выраженному улучшению показателей функции внешнего дыхания, чем в тех случаях, когда симптомы имелись более 2–4 лет.
o при развитии тяжелого обострения у пациентов, не получающих ИГКС, отмечается более выраженное долгосрочное снижение показателей функции внешнего дыхания, чем у тех, кто уже начал принимать ИГКС;
o пациентов с профессиональной БА прекращение воздействия сенсибилизирующих веществ на ранних этапах и раннее назначение терапии повышают вероятность восстановления. [1]
При лечении БА используется ступенчатый подход, приведенный вна рисунке 6.2.1.2
Основные его принципы:
- увеличение объема терапии при отсутствии контроля и/или наличии факторов риска обострений;
- снижение объема терапии при достижении и сохранении стабильного контроля и отсутствии факторов риска.
Каждая ступень включает варианты терапии, которые могут служить альтернативами друг другу при выборе поддерживающего лечения БА, хотя и не являются одинаковыми по эффективности. [2]
- Контроль БА
- При оценке контроля над БА могут использоваться вопросники: с-АСТ тест у детей с 4 до 11 лет, АСТ-тест у детей от 12 лет и взрослых, вопросник по контролю над астмой (ACQ-5).
- Для каждого пациента оценка БА должна включать оценку контроля симптомов и будущих рисков обострений и побочных эффектов лекарств (табл. 9).
- Увеличение потребности в препаратах неотложной помощи, особенно ежедневное их использование, указывает на утрату контроля над БА и необходимость пересмотра терапии.
- Необходимо увеличивать объем терапии (переход на ступень вверх), если не контролируются симптомы и есть риски обострений и других неблагоприятных исходов, но следует вначале проверить правильность диагноза, технику ингаляции и приверженность пациента терапии.
- В случае достижения частичного контроля над БА следует рассмотреть возможность увеличения объема терапии с учетом наличия более эффективных подходов к лечению, их безопасности, стоимости и удовлетворенности пациента достигнутым уровнем контроля.
- При сохранении контроля над БА в течение ≥3 месяцев и низком риске обострений, возможно уменьшение объема поддерживающей терапии с целью установления минимального объема терапии и наименьших доз препаратов, достаточных для поддержания контроля.
Таблица 6.2.2.2. Уровни контроля над БА*
А. Контроль симптомов БА
Уровень контроля
За последние 4 недели у пациента отмечались:
Дневные симптомы чаще, чем 2 раза в неделю
Ничего из перечисленного
1-2 из перечисленного
3-4 из перечисленного
Ночные пробуждения из-за БА
Потребность в препарате для купирования симптомов чаще, чем 2 раза в неделю
Любое ограничение активности из-за БА
В. Факторы риска для неблагоприятных исходов
• Оценивать факторы риска необходимо с момента постановки диагноза и периодически, особенно у пациентов с обострениями.
• Функция легких не учитывается при оценке контроля симптомов (но снижение ОФВ1 учитывается как фактор риска обострений).
• Необходимо измерять функцию легких в начале терапии, затем, спустя 3-6 месяцев лечения препаратами для длительного контроля, с целью определения лучшего персонального ОФВ1 пациента, и затем, периодически, для оценки риска.
Потенциально модифицируемые независимые факторы риска обострений БА:
• чрезмерное использование КДБА (> 1ингалятора 200 доз/месяц);
• неадекватная терапия ИГКС: отсутствие ИГКС-терапии; плохая приверженность терапии; неправильная техника ингаляции;
• существенные психологические или социально-экономические проблемы у пациента;
• контакт с триггерами: курение, аллергены;
• коморбидные состояния: ожирение, риносинуситы, подтвержденная пищевая аллергия;
• эозинофилия мокроты или крови;
Другие важные независимые факторы риска обострений:
• интубация или лечение в отделении интенсивной терапии по поводу БА;
• ≥ 1 тяжелого обострения за последние 12 мес.
Наличие одного или более из этих факторов повышает риск обострений 1,2 , даже если симптомы хорошо контролируются
Факторы риска развития фиксированной обструкции дыхательных путей:
• отсутствие или недостаточная ИГКС терапия;
• экспозиция с табачным дымом, вредными химическими, профессиональными агентами;
• низкий исходный ОФВ1, хроническая гиперсекреция слизи, эозинофилия мокроты или крови.
Факторы риска для развития нежелательных побочных эффектов лекарств:
• системные: частое применение системных ГКС; длительное применение высоких доз или применение сильнодействующих ИГКС; применение Р450-ингибиторов;
• локальные: высокие дозы или сильнодействующие ИГКС, плохая техника ингаляций.
* Источник: 2016 Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы (Российское респираторное общество).
2016 Global Strategy for Asthma Management and Prevention (update)
Сокращения: БА – бронхиальная астма; КДБА – короткодействующие β2-агонисты; ИГКС – ингаляционные глюкокортикостероиды; ОФВ1 – объем форсированного выдоха за 1 сек.
1 – При любом обострении необходимо рассмотрение поддерживающей терапии с целью оценки ее адекватности;
2 – По определению, неделя с обострением – это неделя неконтролируемой БА.
- Обострения БА
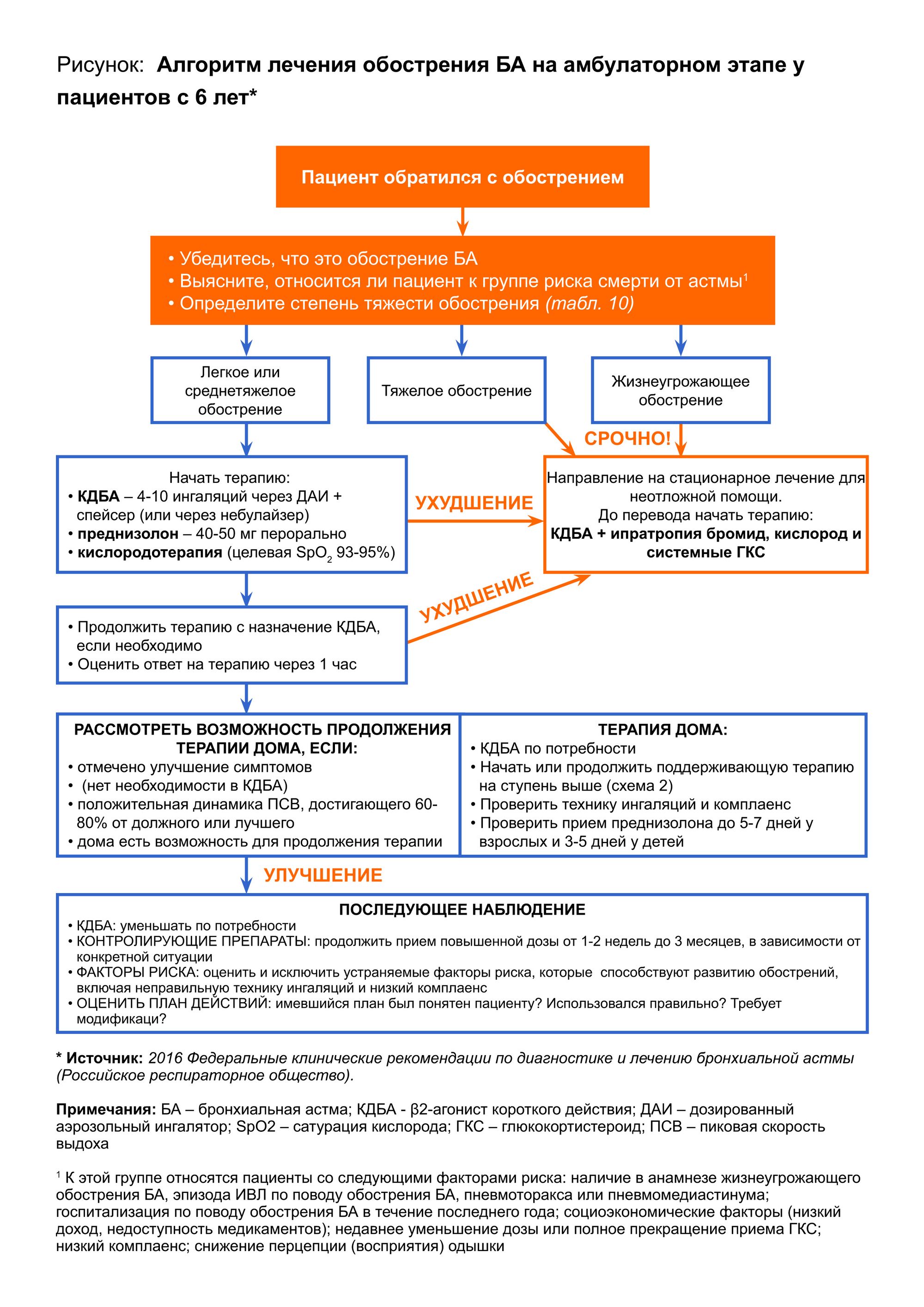
Алгоритм лечения обострения БА на амбулаторном (догоспитальном) этапе у взрослых, подростков и детей от 6 до 11 лет приведен на рисунке 6.2.3.1
1 ступень терапии
- Ингаляционные β2 агонисты короткого действия (КДБА) применяются в качестве неотложной облегчающей терапии у всех больных с симптомами БА на всех ступенях терапии. Наиболее высок уровень силы рекомендаций КДБА в отношении взрослых и подростков (A) и пациентов в возрасте 5-12 лет (B). Для детей младше 5 лет сила рекомендаций КДБА соответствует лишь уровню D.
- Регулярная терапия низкими дозами ИГКС в дополнение к КДБА по потребности должна быть рассмотрена для пациентов с риском обострений.
- У детей младше 5 лет регулярная терапия может начинаться с низких доз ИГКС, у детей с 2 лет – с монотерапии антигонистами лейкотриеновых рецепторов, кромонов. Предпочтение в доставке ИГКС отдается небулайзерной терапии: у детей с 6 месяцев может применяться будесонид в форме суспензии, с 6 лет – также беклометазонадипропионат. У пациентов с 1 года может использоваться флутиказонапропионат со спейсером.
2 ступень терапии
- Предпочтительный выбор терапии на этой ступени – регулярное применение низких доз ИГКС плюс КДБА по потребности.
- Лечение низкими дозами ИГКС редуцирует симптомы БА, повышает функцию легких, улучшает качество жизни, уменьшает риск обострений, госпитализаций и смертельных исходов из-за БА.
- Антилейкотриеновые препараты или кромоны рекомендуются детям с 2 лет как средства, предотвращающие обострение при БА в сочетании с аллергическим ринитом, при вирусиндуцированной БА, БА физического усилия. Антагонисты лейкотриеновых рецепторов менее эффективны, чем ИГКС.
- ИГКС рекомендуются как превентивные препараты для взрослых и детей для достижения целей лечения.
- Начальная доза ИГКС (табл. 10) выбирается в соответствии с тяжестью БА:
— у взрослых стартовая доза, как правило, эквивалентна дозе беклометазона дипропионата (БДП) 400 мкг в день, у детей – БДП 200 мкг в день;
— у детей в возрасте до 5 лет могут быть необходимы более высокие дозы ИГКС, если есть проблемы с доставкой лекарственных средств.
- По достижении и поддержании контроля над БА, по крайней мере, на протяжении 3 месяцев, дозы ИГКС титруются до самой низкой, при которой сохраняется эффективный контроль над заболеванием.
Таблица 6.3.1.1. Сравнительные эквипотентные суточные дозы (мкг) ИГКС для базисной терапии БА*
Низкие дозы 1
Средние дозы 1
Высокие дозы 1
Будесонид (суспензия для ингаляции через небулайзер)
* Источник: 2016 Global Strategy for Asthma Management and Prevention (update)
2016 Федеральные клинические рекомендации по диагностике и лечению бронхиальной астмы (Российское респираторное общество).
Примечания: ДАИ — дозированный аэрозольный ингалятор; ДПИ — дозированный порошковый ингалятор; NA – нет данных.
1 – Эти лекарственные эквиваленты являются приблизительными и зависят от других факторов, таких как техника ингаляций;
2 – флутиказона фуроат зарегистрирован в РФ только в виде фиксированной комбинации флутиказона фуроат + вилантерол (ДПИ).
- Первоначально частота применения ИГКС для пациентов всех возрастов составляет 2 раза в день, за исключением некоторых современных стероидов, назначаемых однократно в день. После достижения хорошего контроля над БА ИГКС можно применять 1 раз в день в той же суточной дозе.
- При лечении детей, получающих ≥ 400 мкг в день беклометазона дипропионата (БДП) или эквивалент, необходимо соблюдать следующие условия:
— в плане лечения должны быть конкретные письменные рекомендации в случае присоединения интеркуррентного заболевания;
— ребенок должен быть под наблюдением педиатра и специалиста аллерголога/ пульмонолога в период длительного лечения.
3 ступень терапии
- Предпочтительный выбор терапии для взрослых пациентов на этой ступени – комбинация низких доз ИГКС/ДДБА как поддерживающая терапия плюс КДБА по потребности. Альтернатива – комбинация низких доз ИГКС (будесонид или беклометазон)/формотерол в качестве поддерживающей терапии и для купирования симптомов (в режиме единого ингалятора).
- Предпочтительный выбор терапии для детей старше 5 лет – низкие/средние дозы ИГКС в комбинации с ДДБА или в комбинации с антагонистами лейкотриеновых рецепторов.
- При лечении детей до 5 лет первым выбором в качестве дополнения к терапии ИГКС являются антагонисты лейкотриеновых рецепторов.
- В России зарегистрировано множество фиксированных комбинаций ИГКС/ДДБА: флутиказона пропионат + сальметерол; будесонид + формотерол; беклометазон + формотерол; мометазон + формотерол; флутиказона фуроат + вилантерол.
- Добавление ДДБА к применяемой пациентом дозе ИГКС обеспечивает дополнительное улучшение симптомов и легочной функции с редукцией риска обострений, по сравнению с увеличением дозы ИГКС.
- У пациентов групп риска препараты состава ИГКС/формотерол в качестве единого ингалятора значительно редуцируют обострения. При сравнительно низкой дозе ИГКС они обеспечивают такой же уровень контроля над БА, что и фиксированные дозы ИГКС/ДДБА в сочетании с КДБА по потребности или же высокие дозы ИГКС в сочетании с КДБА по потребности. Режим единого ингалятора (для поддерживающей терапии и купирования симптомов) зарегистрирован и одобрен в нашей стране при лечении пациентов 18 лет и старше для двух фиксированных комбинаций: будесонид + формотерол в виде порошкового многодозового ингалятора и беклометазон + формотерол в виде дозированного аэрозольного ингалятора (ДАИ).
- Ингаляторы, содержащие фиксированные комбинации, гарантируют одновременное введение ДДБА и ИГКС и могут улучшать комплаенс.
- При уменьшении объема терапии, включающей комбинацию ИГКС/ДДБА, вероятность сохранения контроля над БА выше при уменьшении дозы ИГКС в составе комбинации и отмене ДДБА после перехода на низкие дозы ИГКС.
Наличие у пациента с БА, получающего терапию ИГКС, ограничений по применению ДДБА (нежелательные эффекты, противопоказания или индивидуальная непереносимость β2-агонистов) в качестве альтернативы ДДБА может быть использован тиотропия бромид. Кроме того, этот препарат может быть рассмотрен в качестве дополнительной терапии у пациентов с частыми обострениями.
4 ступень терапии
- Предпочтительный выбор терапии на этой ступени для взрослых пациентов – комбинация низких доз ИГКС (будесонид или беклометазон)/ формотерол в качестве поддерживающей терапии и для купирования симптомов (в режиме единого ингалятора) Альтернатива – комбинация средних доз ИГКС/ ДДБА как поддерживающая терапия + КДБА по потребности.
- У взрослых и подростков с БА, имеющих ≥ 1 обострений в предшествующий год, комбинация низких доз ИГКС с формотеролом в качестве поддерживающей терапии и для купирования симптомов (в режиме единого ингалятора) более эффективна в плане уменьшения обострений, чем поддерживающая терапия ИГКС/ДДБА в тех же дозах или лечение ИГКС в более высоких дозах.
- Если применение ГКС в дозе, эквипонентной 800 мкг БДП день у взрослых и подростков и 400 мкг в день у детей 5-12 лет, в комбинации с ДДБА не дает достаточного контроля над БА, то рассматриваются следующие варианты терапии:
— повышение дозы ИГКС до максимальных (табл.6) + ДДБА. Высокие дозы ИГКС могут применяться с помощью ДАИ со спейсером или через небулайзер;
— добавление антилейкотриеновых препаратов;
— добавление теофиллина замедленного высвобождения;
— в случае с больными тяжелой аллергической БА, которая не контролируется применением высоких доз ИГКС в комбинации с ДДБА, следует рассмотреть назначение омализумаба (с 6-летнего возраста).
- Если дополнительное лечение неэффективно, следует прекратить применение препаратов, в случае увеличения дозы ИГКС – уменьшить ее до первоначальной дозы.
- Прежде чем перейти к 5 ступени терапии, необходимо направить пациентов с неадекватно контролируемой БА, особенно детей, в отделение специализированной помощи для обследования.
5 ступень терапии
- Все пациенты с персистирующими симптомами или обострениями БА, несмотря на правильную технику ингаляции и хорошую приверженность лечению, соответствующему ступени 4, должны быть направлены к специалисту, занимающемуся экспертизой и лечением тяжелой БА.
- Варианты дополнительной терапии к максимальной дозе ИГКС (≥ 1000 мкг в эквиваленте БДП):
— минимально возможная доза пероральных стероидов.
- Терапия омализумабом (анти-IgE) может быть предложена взрослым, подросткам и детям старше 6 лет с среднетяжелой и тяжелой аллергической БА, которая не контролируется лечением, соответствующим ступени 4.
- Рекомендации по лечению пациентов, принимающих оральные ГКС, которые ранее не получали ингаляционной терапии:
— у взрослых и подростков рекомендуется метод элиминации или уменьшения дозы стероидных таблеток на ИГКС в дозах до 2000 мкг/сутки, если потребуется. У детей в возрасте от 5 до 12 лет необходима очень осторожная тактика при превышении дозы ИГКС 800 мкг/сутки;
— у пациентов всех возрастов возможно проведение пробного лечения с ДДБА, антагонистами лейкотриеновых рецепторов и теофиллинами в течение примерно 6 недель. Они должны быть отменены, если нет уменьшения дозы оральных стероидов, улучшения симптомов или функции легких.
Выбор ингаляционных устройств
- Ингаляторы назначают только после того, как пациент прошел обучение использованию устройства и показал удовлетворительную технику ингаляций.
- При БА стабильного течения у детей 5 -12 лет ДАИ + спейсер столь же эффективен, как любой другой ручной ингалятор. У взрослых ДАИ ± спейсер столь же эффективен, как любой другой ручной ингалятор, но пациенты могут предпочесть некоторые виды порошковых ингаляторов (ДПИ).
- Выбор ингаляционного бронхолитика при стабильной БА должен основываться на предпочтении пациента и оценке правильности использования. Многие пациенты не готовы использовать спейсер, предпочитая небулайзер.
- У детей от 0 до 5 лет при стабильной БА ДАИ + спейсер является предпочтительным способом доставки ИГКС или бронхолитиков. Лицевая маска необходима, если ребенок не может вдыхать лекарство из спейсера с использованием мундштука. При неэффективности используется небулайзер. ДПИ обычно проще использовать, однако они требуют определенного усилия вдоха (достижения оптимальной скорости вдоха).
- Решение о госпитализации должно быть принято квалифицированным врачом после повторной оценки ответа на бронхолитики.
- Первая линия терапии обострений БА у детей старше 2 лет – возрастные дозы сальбутамола через ДАИ со спейсером или небулайзер. Если симптомы не поддаются лечению β2-агонистами, добавляют ипратропия бромид (250 мкг/доза; смешивается с раствором β2-агониста через небулайзер). Комбинация β2-агонист + ипратропия бромид обеспечивает более выраженное улучшение функции легких и способствует уменьшению риска госпитализации.
- Повторные дозы ипратропия бромида используют для лечения детей, которые плохо отвечают на β2-агонисты.
- Ребенку с обострением БА, находящемуся дома, необходимо срочно вызвать скорую помощь, если симптомы не контролируются следующим лечением:
- Дополнительные дозы бронходилататоров даются по мере необходимости во время ожидания врача при выраженных симптомах.
- При неэффективности бронходилататоров добавляется суспензия будесонида через небулайзер (у детей с 6-месячного возраста).
- Во время доставки ребенка с тяжелым приступом БА в отделение неотложной помощи назначается бронхолитик + суспензия будесонида через небулайзер с кислородом.
- Необходимо индивидуализировать дозы препаратов, в зависимости от тяжести и ответной реакции пациента.
- ДДБА отменяются, если ингаляции КДБА требуются чаще, чем через 4 часа.
- Дети с тяжелой или угрожающей жизни БА должны быть доставлены в больницу в срочном порядке.
- Дети с угрожающей жизни БА или SpO2кислород через плотно прилегающую маску или носовые канюли для достижения нормальной сатурации.
- В рамках стероидной терапии тяжелых приступов БА применяется пероральный преднизолон в дозе 20 мг для детей 2-5 лет и 30-40 мг – для детей старше 5 лет. У детей, уже получающих стероиды перорально, преднизолон назначается из расчета 2 мг/кг, до максимальной дозы 60 мг.
- Если у ребенка наблюдалась рвота, преднизолон назначается повторно. Возможно внутривенное введение ГКС в случаях, когда пероральный прием препарата затруднен или невозможен.
- Обычно достаточно лечения пероральным преднизолоном в течение 3 дней, но длительность его приема может быть увеличена до 14 дней для полного купирования симптомов.
- При легких и средне-тяжелых обострениях применяются ингаляции β2-агониста. Оптимальным устройством доставки лекарственного средства служит небулайзер, возможно использование ДАИ + спейсера.
- При более тяжелых симптомах применяется ингаляционный ипратропия бромид в комбинации с ингаляционным β2-агонистом.
- Для купирования среднетяжелых и тяжелых приступов БА в условиях стационара у детей раннего возраста используют:
- Антибиотики детям с обострением БА назначаются только по строгим показаниям.
- нетяжелые обострения, для которых характерны снижение ПСВ на 25-50%, ночные пробуждения из-за БА и повышенная потребность в КДБА, обычно можно лечить в амбулаторных условиях. Если пациент отвечает на увеличение дозы бронхолитика уже после первых нескольких ингаляций, необходимость обращения в отделение интенсивной терапии отсутствует, однако дальнейшее лечение под наблюдением врача первичного звена может включать применение системных ГКС. Следует также провести обучение пациента и пересмотреть поддерживающую терапию;
- при легком и среднетяжелом обострениях оптимальным и наиболее экономичным методом быстрого устранения бронхиальной обструкции является многократное применение ингаляционных КДБА (от 2 до 4 ингаляций каждые 20 мин в течение первого часа). После первого часа необходимая доза β2-агониста будет зависеть от степени тяжести обострения:
- Использование комбинации β2-агониста и антихолинергического препарата сопровождается снижением частоты госпитализаций и более выраженным улучшением ПСВ и ОФВ1.
- Дозы бронхолитиков подбирают в зависимости от ответа конкретного пациента, и в случае отсутствия ответа или наличия сомнений в ответе на лечение необходимо направить пациента в учреждение, где может быть проведена интенсивная терапия.
- Системные ГКС следует использовать при лечении всех обострений, кроме самых легких, особенно если:
- Пероральные ГКС обычно не уступают по эффективности внутривенным ГКС и являются предпочтительными средствами
- Адекватные дозы пероральных ГКС – преднизолон (или эквивалент) 40-50 мг/сут., 1 раз в сутки. Длительность терапии составляет 5-7 дней.
- Нет необходимости в постепенном снижении дозы системных ГКС в течение нескольких дней, за исключением случаев, когда больной получал системные ГКС на постоянной основе до обострения. [2]
- Контроль БА важен во время беременности как для матери, так и для ребенка, уменьшая риск возможных осложнений.
- Тщательное наблюдение является важной составляющей ведения беременной женщины со среднетяжелой и тяжелой БА для сохранения хорошего контроля.
- Важно чтобы женщины, которые курят, знали, что это опасно как для самой женщины, так и для ее ребенка, и необходимо оказывать помощь в отказе от курения.
- Используйте короткодействующие β2-агонисты (КДБА) или их комбинации с ипратроприя бромидом по обычным показаниям во время беременности.
- Используйте пролонгированные β2-агонисты (ДДБА) по обычным показаниям
- Назначайте ИГКС по обычным показаниям.
- Используйте оральные и внутривенные теофиллины по обычным показаниям.
- Используйте стероидные таблетированные препараты по обычным показаниям, если есть признаки тяжелой астмы. Пероральные глюкокортикостероиды не должны быть исключены из-за беременности.
- Прием антагонистов лейкотриенов может продолжаться у беременных женщин, которые достигли значительного улучшения контроля на этих препаратах до беременности и не могут достичь его на других препаратах.
- Назначайте терапию обострения БА так же, как небеременным, включая системные стероиды и сульфат магния
- Тяжелое обострение астмы у беременных требует неотложных мероприятий и должно лечиться в стационаре. Назначьте высокие дозы кислорода немедленно для поддержания сатурации 94-98%.
- При тяжелом обострении БА рекомендуется наблюдение за состоянием плода.
- Для женщин с плохим контролем БА необходим контакт между пульмонологом и акушером для раннего перевода женщины с тяжелым обострением астмы в реанимационное отделение.
- Если беременной показана анестезия, региональная блокада более предпочтительна, чем общий наркоз.
- С большой осторожностью используйте простагландины F2α в экстренных ситуациях из-за риска вызвать бронхоспазм.
- Информируйте женщин о следующем:
- Женщины, которые получали пероральные ГКС в дозе, превышающей 7,5 мг преднизолона больше 2-х недель перед родами, должны быть переведены на гидрокортизон 100 мг парентерально каждые 6-8 часов во время родов.
- В отсутствие обострения кесарево сечение проводится по обычным акушерским показаниям.
- Рекомендуйте женщинам грудное вскармливание.
- Используйте базисную противоастматическую терапию как обычно. [2]
Обострения БА могут развиться у любого пациента, независимо от тяжести заболевания, но они считаются частым клиническим проявлением у пациентов с трудно контролируемой БА.
Скорость развития обострения БА может значительно варьировать у разных пациентов – от нескольких минут или часов до 10-14 дней. Также вариабельно и время разрешения обострения – от 5 до 14 дней.
Во время лечения следует регулярно оценивать критерии тяжести обострения, в частности ПСВ, частоту сердечных сокращений, частоту дыхания и показатели пульсоксиметрии.
Начальная терапия обострений БА у детей старше 2 лет
— ингаляциями β2-агониста или его комбинации с ипратропия бромидом через ДАИ со спейсером до 6-8 доз/сутки более 3 раз в сутки;
— ингаляциями 2,5-5 мг β2-агониста или его комбинации с ипратропия бромидом через небулайзер.
Вторая линия терапии обострений БА у детей старше 2 лет – внутривенное введение аминофиллина:
— аминофиллин НЕ рекомендуется для лечения детей с легким и среднетяжелым обострением БА;
— аминофиллин вводится внутривенно в педиатрическом отделении интенсивной терапии (ОРИТ) детям с тяжелой или угрожающей жизни БА, не отвечающим на максимальные дозы ингаляционных бронхолитиков и стероидов.
Лечение обострений БА у детей младше 2 лет
— ингаляционный будесонид через небулайзер в средних и высоких дозах;
— системные стероиды внутрь (преднизолон – 10 мг) до 3 дней.
Лечение обострений БА у взрослых
Пациентов с тяжелым обострением следует немедленно направлять на прием к лечащему врачу или, в зависимости от организации местных учреждений здравоохранения, в ближайшую клинику или больницу, в которой оказывают помощь пациентам с острой БА. Очень важно оценивать ответ на терапию в динамике (в том числе, ПСВ).
Основные мероприятия по лечению обострений включают (в порядке их назначения и в зависимости от тяжести обострений) кислородотерапию, повторные ингаляции бронхолитиков быстрого действия, раннее применение системных ГКС.
Принципы ведение пациентов с обострениями БА на догоспитальном этапе:
— легкие обострения купируются 2–4 дозами β2-агониста с помощью ДАИ каждые 3–4 ч;
— обострения средней тяжести потребуют 6–10 доз каждые 1–2 ч.
– начальная терапия ингаляционными β2-агонистами не обеспечила длительного улучшения;
– обострение развилось у пациента, уже получающего пероральные ГКС;
– предшествующие обострения требовали назначения пероральных ГКС.
Физиологические изменения, происходящие при беременности, могут вызвать как ухудшение, так и улучшение течения астмы. Беременность может влиять на течение астмы, а сама астма может влиять на беременность.
— приступ БА редко развивается в родах;
— необходимо продолжать прием противоастматических препаратов во время родов.
Терапия кормящих
источник