ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ ОСОБЕННОСТИ ИССЛЕДОВАНИЯ МОКРОТЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ
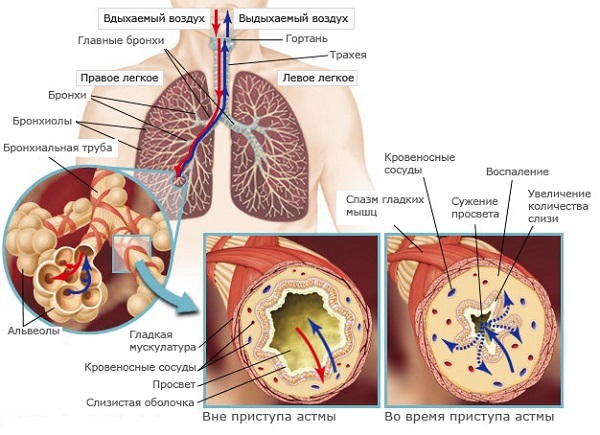
При аллергическом воспалении ключевой фигурой клеточного ответа на воздействие различных полютантов является эозинофил. Основным повреждающим фактором выступает главный основной белок эозинофилов, который вызывает деструкцию мукоцилиарного аппарата и нарушает мукоцилиарный клиренс. При дегрануляции тучных клеток образующиеся оксиданты повреждают мембраны эпителиальных клеток, приводя их к гибели и слущиванию эпителия. Конгломераты этих слущенных, измененных эпителиальных клеток формируют тельца Креола, выявляемые в мокроте. Отслойка эпителия обнажает ирритантные рецепторы блуждающего нерва, что способствует усилению секреции слизи.
Для больных бронхиальной астмой (БА) характерно выделение небольшого количества слизистой бесцветной мокроты. Она не содержит гноя, пока не присоединяется сопутствующая инфекция. После приступа можно наблюдать отхождение «стекловидной» мокроты. При атопическом варианте БА мокрота бывает ярко-желтого или канареечного цвета. Присоединение гнойного компонента придает ей зеленоватый оттенок.
При микроскопическом исследовании мокроты обнаруживаются:
1. Клетки эпителия: плоского, выстилающего ротовую полость, — не имеют диагностического значения; цилиндрического, реснитчатого — характерны для мокроты при остром приступе БА. Бокаловидные клетки встречаются при гиперпродукции слизи. Клетки бронхиального эпителия часто единичные, с гидрошгческим перерождением и плохо определяемой морфологией. При обострениях эти клетки собираются в более крупные скопления, имеют вакуолизированную цитоплазму с реснитчатыми краями, их называют Тельцами Креола (Creola) и считают неблагоприятным прогностическим признаком.
2. Альвеолярные макрофаги —- нередко называемые «чистильщиками» трахеобронхиально-го дерева, поскольку выполняют свою функцию путем фагоцитоза инородных компонентов тра-хеобронхиального содержимого. Наличие липид-ньгх капе\ь в цитоплазме альвеолярных макрофагов (липофагов) расценивают как признак обструктивного компонента в бронхах или бронхиолах
3. Эозинофильные лейкоциты.
4. Кристаллы Шарко—Лейдена — возникают вследствие распада эозинофильных лейкоцитов и кристаллизации белков, находящихся в них
5. Нейтрофильные лейкоциты — при инфекционном воспалении.
6. Моноциты и гистиоциты появляются в значительных количествах в фазе выздоровления (регенерации).
7. Спирали Куршмана — уплотненные, закрученные в спираль образования из слизи.
При обострении БА наблюдается так называемая «астматическая триада», включающая в себя эозинофилию мокроты, наличие спиралей Куршмана и кристаллов Шарко—Лейдена.
Микозы органов дыхания по клиническим симптомам и рентгенологическим признакам часто имитируют воспалительные или опухолевые поражения. Лучше исследовать первую утреннюю порцию мокроты, так как она представляет собой выделения трахеобронхнального дерева за ночь. В диагностике пневмомикозов преимущественно применяются исследования нативных препаратов мокроты на наличие в них элементов грибов (дрожжевые клетки, споры, почкующиеся формы мицелий — сферулы).
Это не настоящий грибок, а грамположительный микроорганизм, который медленно растет с ответвлением филаментов. Он является комменсалом, но может стать патологическим. Макроскопически выглядит в виде желтых (зеленовато-желтых) гранул в диаметре менее 1 мм.
Мукоромикоз редко поражает легкие и чаще встречается при диабете. Во влажном нативном препарате можно видеть огромные (15 мкм в диаметре) несептированные гифы. Необходимо выделение культуры.
Пневмоцистоз — плазмоклсточная пневмония, вызываемая Pneumocystis carinii, встречающаяся предогущественно у ослабленных больных, страдающих хроническими болезнями крови, онкологическими заболевании, при различных иммунодефицитах, особенно при ВИЧ инфекции, а также у детей раннего возраста, у недоношенных, ослабленных вследствие других заболеваний и на фоне приема глюкокортикоидов и иммунодепрессантов. Pneumocystis carinii вызывает воспалительную инфильтрацию межальвеолярных перегородок, что приводит к нарушению газообмена, заполнению альвеол пенистой массой и развитию гипоксии.
Образование слизисто-гнойной мокроты — это один из кардинальных признаков бронхшктазов, а откашливаемый объем зависит от положения тела. Типичен утренний кашель. Мокрота обычно гнилостная, серо-зеленого цвета (50— 250 мл в день), временами с примесью крови, при отстаивании разделяется на три слоя: 1) верхний пенистый, который позже оседает, 2) средний — густой (мутный) слизистый и 3) нижний — слой клеток гноя и микробов. Микроскопическое исследование данного слоя выявляет клетки бронхиального эпителия, кристаллы жирных кислот, бактерии и иногда пробки Дитриха. При раздавливании они издают гнилостный запах.
Макроскопически мокрота может быть слизистой (белая или прозрачная) либо гнойной (желтая или желто-зеленая). При кровохарка нье, связанном с хроническим бронхитом (ХБ), в мокроте присутствуют прожилки крови. Также можно обнаружить слизистые и гнойные пробки, а при наличии бронхоспастического синдрома — бронхиальные слепки. При фибринозном бронхите характерно откашливание «муляжей бронхиального дерева». Откашливаемый объем зависит от активности воспалительного процесса и в среднем составляет 60 мл в день. В разгар заболевания увеличивается количество лейкоцитов и эпителиальных клеток. Для гнойной мокроты характерно большое количество нейтрофильных лейкоцитов, макрофагов. При вступлении в фазу ремиссии отмечается увеличение гистиоцитов и моноцитов. Окраска по Граму обычно выявляет смешанную микрофлору.
Активная фаза сопровождается ростом активности некоторых ферментов в мокроте. Так, отмечается повышение активности лактатдегидрогеназы (ЛДГ), особенно перед обострением воспалительного процесса и при клиническом ухудшении. Поэтому соответствующие изменения в антибактериальной терапии можно сделать, не дожидаясь микробиологических или клинических признаков. Отклонение показателей вязкости и эластичности мокроты в сторону их уменьшения или увеличения приводит к значительному замедлению транспорта слизи.
Межклеточное взаимодействие играет важную роль при инфекционном воспалении. Так, защитная функция нейтрсфилов обусловлена их способностью генерировать цитотоксические агенты, такие, как активные формы кислорода, протеолитические ферменты, катионные протеины. В то же время их воздействие на ткани может носить поражающее действие. Существенное влияние на интенсивность образования ТВС оказывают протеазы. Так, химаза, выделяемая тучными клетками, является сильным секретогенным фактором для серозных клеток, подслизистых желез бронхов. Такой же эффект оказывают эластаза и катепсин G нейтрсфилов, которые действуют не только на серозные, но и на бокаловидные клетки.
Несомненное воздействие на формирование ТВС при инфекционном воспалении оказывает микрофлора дыхательных путей. Некоторые бактерии, в частности Pseudomonas aeruginosa, выделяют вещество, стимулирующее секрецию железами трахеи и бронхов муцина, но ингибирую-щее подвижность ресничек слизистой оболочки. Воздействие микрофлоры может быть опосредованным. Так, выделение медиаторов воспаления может стимулироваться через рецепторы с помощью анафилатоксинов СЗа и С5а, которые являются компонентами системы комплемента при его активации по классическому и неальтернативному пути. Активаторами систем комплемента по альтернативному пути выступают полисахариды бактерий, антигены некоторых видов грибков и компоненты аллергенов домашней пыли.
Т.е. при инфекционном воспалении с характерным присутствием нейтрофилов, выполняющих свою биологическую роль в борьбе с инфекционным патогеном, изменяются условия формирования ТБС под действием цитокинов и БАБ, выделяемых клетками, что приводит и к активации систем местной защиты. Наряду с активацией оксида нтной и протеолитической систем и стимуляцией выработки ТБС в зоне воспаления в силу вазодилятирующего эффекта БАВ увеличивается интенсивность кровотока и усиливается пропотевание плазмы из сосудистого русла.
В результате такого взаимодействия защитных механизмов при инфекционном воспалении, наряду с компонентами плазменного происхождения, количество которых увеличивается при экссудации, в бронхиальном секрете появляются продукты жизнедеятельности и распада микроорганизмов. Бактериальные энзимы, протеазы разрушенных клеток могут вторично видоизменять сиаломуцины и приводить к утрате их способности формировать волокнистые структуры, т. е. нарушению каркаса слизи.
В итоге для инфекционного воспаления, например при ХБ, характерна мокрота как с максимальной суммарной осмотической концентрацией, так и основных ее компонентов: натрия, калия, хлоридов и бикарбонатов, обусловливающих сдвиг рН среды в щелочную сторону.
Цель последовательных и в то же время одновременных событий с образованием клеточных коопераций в ответ на патоген при развитии инфекционного воспаления в бронхах представляется в интенсивной альтерации, выполняющей роль защиты и проявляющейся путем «вылущивания» части эпителиальной выстилки слизистой (как правило, до базального эпителия) как пути элиминации патогена.
Чем ярче проявления ответа организма на воздействие инфекционного возбудителя в виде активного привлечения лимфоцитов, мобилизации макрофагов, тем меньше проявления альтерации, десквамации эпителия. При снижении остроты воспалительного процесса в бронхах то есть снижении количества нейтрофилов в мокроте, возрастает пред ста вигельство «чистильщиков бронхиального дерева», какими являются макрофаги, а также лимфоцитов.
При этом и изменения химического состава ТБС, несомненно, носят закономерный характер. Преобладание щелочных валентностей над кислыми в составе ТБС может быть расценено как результат целенаправленной функции эпителия по регуляции активности протеаз, выделяемых нейтрофилами, а также обеспечении оптимального объема реакций оксидантных систем. Известно, что оптимизацию реологических свойств ТБС, существенно измененных при развитии ХБ из-за присутствия ДНК из лизированных клеток, можно достичь за счет усиления щелочной pea к-ции в бронхах (щелочное питье, ингаляции). При отсутствии причин для выраженного поражения базальной мембраны регенерация эпителия, а следовательно, восстановление целостности слизистой происходит достаточно быстро.
Мокрота появляется только при прорыве абсцесса в бронх. Необходимо ежедневно измерять суточное количество мокроты, которая со-бираегся в плевательницу с завинчивающейся крышкой. Мокрота, как правило, гнойная, нередко появляются прожилки крови или кровохарканье. При благоприятном течении постепенно исчезает зловонный запах, все более тонким становится слой осадка на дне банки. Необходимо помнить, что кровохарканье в более поздние фазы процесса служит нередко предвестником профузного легочного кровотечения. При микроскопическом исследовании осадка обнаруживают большое количество разрушающихся лейкоцитов, кристаллы гематоидина, холестерина, жирных кислог.
Этиологическими агентами обычно являются Klebsiella pneumoniae, Hemophilus influenzae, Staphylococcus aureus, Streptococcus hemoli-ticus. Микроорганизм считается этиологически значимым при концентрации его в мокроте 10 6 микробных тел в 1 мл или смыве из бронхиального дерева 10 4 микробных тел в 1 мл. Чаще всего в мокроте присутствует смешанная микрофлора. Необходимо исключить наличие туберкулезного процесса и злокачественных опухолей.
Для ранней диагностики пневмоний исследуют обычно мокроту, окрашенную по Граму. Мокроту предварительно гомогенизируют для лучшего распределения патогенных микробов. При пневмониях, вызванных грамположительной флорой, чаще всего выявляется Pneumococcus (streptococcus) pneumoniae; реже стафилококки и другие стрептококки.
При пневмококковой пневмонии свойства мокроты изменяются в зависимости от стадии болезни. Мокрота при начинающейся долевой пневмонии скудная, с примесью крови. В стадии красного опеченения мокрота становится ржавой, вязкой и слизисто-гнойной. Микроскопически выявляется много вне- и внутриклеточных микробов, эпителиальных клеток, лейкоцитов и эритроцитов. В стадии разрешения мокрота становится более обильной, менее вязкой и выгля дит как при хроническом бронхите. Повторное появление ржавой окраски указывает на прегрессирование заболевания или вовлечение в патологический процесс другого легкого. Таким пациентам с целью контроля за эффективностью лечения и исключения вторичной инфекции необходимо ежедневно исследовать мокроту, окрашенную по Граму.
Для обеспечения результативности бактериологического исследования мокроты необходимо выполнение нескольких условий: исследование утренней мокроты не позже чем через 1 час с момента ее откашливания
Дата добавления: 2014-11-16 ; Просмотров: 589 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник
Одной из причин бронхиальной обструкции является выделение густого секрета. На этапе диагностики очень важно понять причину возникновения болезни, для этого необходимо сделать анализ мокроты.
По результатам анализа можно судить о тяжести хронического воспаления бронхов, а также об эффективности назначенного лечения. При бронхиальной астме на основе исследования секрета можно сделать выводы о прогрессировании болезни и дальнейшем прогнозе.
В норме в просвет дыхательных путей выделяется небольшое количество слизи. Она необходима для смазывания стенок, предохранения их от инфекции и пересыхания.
При воспалении выработка секрета усиливается, он становится более вязким и густым, изменяется цвет. Также изменяется его запах, что зачастую свидетельствует о тяжелой патологии.
Мокрота при бронхиальной астме выделяется с кашлем, может содержать в себе примеси крови или эпителия бронхов. Выведение вязкого секрета наружу довольно затруднительно, поэтому он скапливается в просвете бронхов, нарушая дыхание больного.
Это становится одной из причин приступа удушья.
Для дифференциального диагноза имеет большое значение характеристика отделяемого из респираторного тракта. Для этого необходимо внимательно исследовать материал:
- Прозрачный цвет мокроты с белым оттенком при бронхиальной астме говорит о заболевании дыхательной системы в начальной стадии. Слизь при этом вырабатывается активно из-за воздействия аллергенов, которые таким образом выводятся наружу из дыхательных путей.
- Отделяемое желтого цвета означает, что в дыхательной системе развивается инфекционный воспалительный процесс.
- Зеленоватые выделения появляются при воспалении средней и тяжелой степени.
- Густая коричневая слизь свидетельствует о повреждении сосудов и недавнем кровотечении.
- Розовая пенистая мокрота при астме указывает на наличие кровотечения из-за повреждения стенки сосуда.
О характере мокроты при бронхиальной астме нужно спрашивать пациента в первую очередь, так как это напрямую влияет на лечение заболевания и прогноз. Обязательно на этапе диагностики проводится анализ слизи, выделяемой при кашле.
Целесообразно проведение анализа мокроты при подозрении на бронхиальную астму и любые другие болезни органов дыхания. Обязательно исследуется состав, качественные и количественные характеристики, проводится посев материала для выявления болезнетворных микроорганизмов и на чувствительность к антибактериальным средствам (при необходимости).
При наличии бронхиальной астмы такой анализ является одним из ключевых в диагностике болезни. По его результатам можно предположить причину возникновения астмы и, исходя из этого, выбрать метод лечения.
Перед сдачей мокроты на анализ очень важно подготовиться. Правильно проведенная подготовка влияет на достоверность полученного результата:
- За 8-12 часов до сдачи материала пациент должен употреблять больше жидкости. Это необходимо для улучшения отхождения секрета.
- Биоматериал сдается обычно в утренние часы, перед отхаркиванием нужно почистить зубы для удаления остатков пищи и микроорганизмов.
- За несколько дней до анализа нельзя употреблять алкоголь, исключается курение и тяжелая пища, ограничиваются физические нагрузки.
- Откашливание слизи проводится в чистую посуду, перед этим вся слюна обязательно сплевывается. Рекомендуется перед сбором экссудата прочистить носоглотку.
Для анализа будет достаточно 3-5 мл отделяемого при кашле. Материал необходимо доставить в лабораторию в течение 2-3 часов: это оптимальный срок для получения достоверного результата.
Экссудат сдается в лабораторию, где проводится его детальный анализ: оцениваются физико-химические свойства, исследуется клеточный состав. На основании полученных данных назначается лечение с обязательным учетом вида обнаруженной микрофлоры.
Процесс исследования образца материала при бронхиальной астме обычно длится не менее трех дней от момента сдачи его в лабораторию. Из особенностей оценки материала: огромную роль играет цвет отделяемого и примеси, среди которых можно в тяжелых случаях увидеть фрагменты тканей стенки бронхиального дерева.
В полученном результате лаборант обязательно указывает клеточный состав материала, по которому устанавливается природа и характер заболевания:
- при повышенном содержании эритроцитов можно предположить повреждение сосудов ввиду деструктивного процесса в тканях респираторного тракта;
- большое количество эозинофилов в слизи характерно для бронхиальной астмы, они свидетельствуют о ее аллергической природе;
- кристаллы Шарко-Лейдена указывают на аллергический процесс и его прогрессирование;
- количество мерцательного эпителия увеличивается при бронхиальной обструкции или воспалении бронхов;
- спирали Куршмана в анализе являются патогномоничным признаком астмы, говорят о спазме бронхов и скоплении густого секрета в просвете;
- макрофаги в отделяемой слизи подтверждают диагноз астмы.
Не менее важно соотношение содержания этих клеток. В зависимости от преобладания тех или иных клеточных структур назначается лечение.
Если в материале выявлены болезнетворные микроорганизмы, то необходимо провести бактериологический посев.
Мокроты при астме в бронхах вырабатывается очень много во время приступа. Она становится очень густой, перекрывая просвет. Это влечет за собой следующие последствия:
- закупорка дыхательных путей в результате невозможности выведения слизи и, как следствие, удушье;
- малопродуктивный кашель с мокротой и хрипами, недостаток воздуха;
- непроходимость бронхов, которые деформируются в процессе длительного воспаления, изменение структуры их тканей.
Одной из главных задач при лечении бронхиальной астмы является улучшение отхождения мокроты по бронхиальному дереву. Это можно обеспечить при помощи медикаментозных препаратов.
Также необходимо соблюдение общих рекомендаций.
При бронхиальной астме с мокротой назначают:
- отхаркивающие средства (улучшают отхождение слизи);
- муколитики (способствуют разжижению и ускоренному выведению мокроты);
- антигистаминные препараты (уменьшают отек, в случае аллергии борются с причиной);
- растительные средства в виде отваров для приема внутрь и ингаляций (помогают вывести слизь).
В помещении, где живет человек с бронхиальной астмой, должна поддерживаться повышенная влажность. Для этого можно использовать специальные увлажнители воздуха.
Астматику необходимо пить не менее полутора литров жидкости в сутки, проводить ингаляции паром с добавлением пихтового масла.
Бронхиальная астма — хроническое заболевание, но его можно и нужно держать под контролем. Для этого необходимо вовремя обратиться к врачу, который назначит обследование.
Одним из важнейших при диагностике астмы является исследование мокроты. Оно помогает отличить ее от других заболеваний и назначить правильное лечение.
источник
Анализ мокроты при бронхиальной астме — один из компонентов программы обследования пациента. Стандартные методы обследования имеют относительно небольшую стоимость и являются обязательными для диагностики заболевания.
Бронхиальная астма представляет собой хроническое заболевание дыхательных путей. Предпосылками развития болезни служат аллергические и неаллергические факторы. Исходя из этого бронхиальная астма бывает инфекционно-аллергической, неинфекционно-аллергической или атопической.
Характерными признаками является образование мокроты. Ее анализ позволяет установить истинное происхождение заболевания, оценить эффективность лекарственных препаратов, уточнить причины частых приступов.

Цвет слизи может быть желтым, желто-зеленым, однако он не является прямым показателем инфекции или развития заболевания. Просто указывает на процесс распада эозинофилов. Обострение болезни приводит к увеличению количества мокроты. Однако слишком большое отхождение слизи больше свидетельствует о другом заболевании, нежели о бронхиальной астме. Слизь становится более густой, что может способствовать блокированию дыхательных путей.
Программа обследования пациента включает:
- общий анализ крови: клинический и биохимический;
- иммунологическое обследование;
- составление коагулограммы;
- клинический анализ мокроты.

- за сутки перед сдачей анализов необходимо выпивать много жидкости в течение дня;
- перед сбором мокроты прополоскать рот раствором из воды и соды;
- вдохнуть несколько раз глубоко;
- собирать в емкость необходимо только выделения мокроты, слюна не подойдет;
- требуется собрать 3-5 мл в идеале, однако обследование делают и при меньшем объеме;
- анализ нужно доставить в течение 2 часов после сбора.
Бывают случаи, когда отхождение мокроты затруднено. Способствует облегчению ингаляция с физиологическим раствором, или делают перкуссионный массаж. Если такие мероприятия не дают результата, материал перед исследованием получают с помощью катетера. Устройство вводится в просвет трахеи и выкачивается нужное количество. Однако такие манипуляции чреваты бронхиальным спазмом, поэтому осуществляться они должны строго в стенах медицинского учреждения. В случае необходимости оказывается экстренная помощь.
Образец мокроты высушивают и проводят анализ, после которого можно установить количество:
- нейтрофилов;
- эпителиальных клеток;
- бактерий;
- фибринов;
- макрофагов;
- слизи.
Для исследования берут 5-10 экземпляров. Используют иглу и стекло. Высушивают с помощью метилового спирта около 10 минут. Окрашивание проводят по методу Грама или Романовского-Гимзе.

В совсем малом количестве эозинофилы присутствуют в мокроте любого характера и происхождения, однако показатель в 50-90% всех лейкоцитов говорит о присутствии бронхиальной астмы.
Эритроциты возникают в процессе разрушения тканевой основы легких, а также при пневмониях, инфаркте легкого.
Особое внимание уделяется цилиндрическому мерцательному эпителию. Он существует в любой мокроте в малом количестве. Показатель свыше 25 указывает на бронхиальную астму или бронхит. Плоский эпителий для диагностики бронхиальной астмы значения не имеет.
Если во время анализа материала обнаружен хотя бы 1 макрофаг, можно говорить о бронхиальной астме.
Острая форма заболевания характеризуется увеличением общего количества клеток в мокроте. Однако соотношение между ними не нарушается. Экзогенная форма астмы предполагает увеличение количества только эозинофилов.

Кристаллы Шарко-Лейдена наблюдаются в мокроте при аллергических процессах, бронхиальной астме.
Мокрота не должна содержать вредных бактерий и других микроорганизмов болезнетворного характера. Выявление таких показателей дает возможность установить происхождение легочной инвазии.
Таким образом, показатели бронхиальной астмы выглядят примерно так:
- обнаружены спирали Куршмана;
- присутствуют кристаллы Шарко-Лейдена;
- эозинофилы имеют показатель от 50 до 90% всех лейкоцитов;
- более 25 нейтрофилов, что говорит о наличии инфекции;
- 25 клеток и выше плоского эпителия говорит о примеси, которая поступает из полости рта;
- найдены макрофаги.
Результат исследования может оказаться недостоверным по нескольким причинам:
- нарушение правил сбора материала;
- несвоевременная доставка мокроты в лабораторию;
- прием лекарственных средств.
В процессе приема кортикостероидных препаратов количество эозинофилов постепенно уменьшается и можно говорить об эффективности лечения. Однако при наличии инфекции процесс значительно усложняется. Дополнительно делают посев мокроты для определения возбудителя и выявления его чувствительности к антимикробным средствам.

- тяжелое, затрудненное дыхание;
- ощущение дефицита кислорода;
- частый назойливый кашель;
- присутствие свиста во время дыхания;
- сдавливание грудной клетки;
- выделение мокроты.
Первым признаком заболевания является затрудненное дыхание. Меняется ритм, темп, вдох становится более длинным и глубоким. Это происходит по причине сужения дыхательных проходов. Для выталкивания воздуха требуется прикладывать больше усилий. Кашель может быть сухой, тяжелый и приступообразный. Во время приступа может казаться, что человек задыхается. Провоцировать появление кашля может смех, физическая нагрузка, активная речь, возбуждение.
Свист и хрипота присутствуют на любом этапе болезни. Их можно заметить, когда человек спит, смеется, занимается физическим трудом. Во время выдоха сдавливает грудную клетку, и человек не может полноценно избавиться от воздуха в легких.
Мокрота скудная, бело-желтого цвета, без запаха. Может ее не быть и вовсе.
При любом подозрении на заболевание следует обратиться к доктору. В лаборатории должны выдать емкость для сбора мокроты, рассказать правила сбора. Кроме того, придется сдать кровь на анализ. После подтверждения диагноза будет назначено лечение.
По истечении некоторого времени делается повторный анализ, чтобы определить эффективность лечения.
Если результаты будут отрицательными, вносятся коррективы в тактику лечения. А также проводят дополнительное исследование на выявление причин заболевания.
источник
Застойные процессы в бронхах, наблюдаемые во время обострения астмы или развития сопутствующих заболеваний, представляют значительную опасность для человека из-за выраженных нарушений дыхательной функции.
Мокрота при бронхиальной астме имеет слизистую консистенцию и отличается большим количеством специфических формаций, представленных спиралями Куршмана и кристаллами Шарко-Лейдена.
Мокрота – биологическая смесь, состоящая из накопленного трахеобронхиального секрета, слюны, слизистых жидкостей носа и околоносовых пазух. Слюна и слизь, образующиеся в полости носа, отличаются выраженными бактерицидными свойствами, в то время как образование секрета бронхов и трахей направлено на очищение организма от продуктов клеточного метаболизма.
Объем образованного трахеобронхиального секрета варьирует от 10 до 100 мл в сутки. Стоит отметить, что при нормализованной работе дыхательной системы вся продуцируемая слизь проглатывается.
Появление слизевых застоев связано с:
- увеличением количества синтезируемого секрета;
- изменением состава слизи из-за развития воспалительных процессов в области бронхов (аллергия, инфекционное заражение);
- нарушением механизма выхода жидкости из трахеобронхиальных структур.
В случае развития острого воспалительного процесса наблюдается ослабевание работы реснитчатого эпителия, приводящее к образованию застойных явлений в бронхах.
Стадия и форма бронхиальной астмы определяется по функциональным способностям внешнего дыхания и частоте приступов, в то время как характеристики мокротных масс позволяют выявить наличие сопутствующих патологий.
В зависимости от масштабов развития сопутствующих болезней мокрота может отличаться по:
Именно эти критерии, а также проведение лабораторного анализа способствуют постановке диагноза.
Особенности мокротных образований:
- начальная стадия бронхиальной астмы: пенистая слизь прозрачная или белого цвета в случае отсутствия сопутствующих инфекционных заболеваний;
- развитие вторичной инфекции: слизь имеет неприятный, резкий запах, наблюдаются гнойные вкрапления желтоватого оттенка;
- обширное распространение воспаления в области органов дыхания: наблюдаются гнойные вкрапления зеленоватого цвета, слизь густой консистенции, трудноотделяемая (в случае наличия резкого неприятного запаха возможно развитие онкологических процессов);
- кровотечения в области органов дыхательной системы: наблюдаются вкрапления коричневого или красного цвета;
- внутренние разрывы кровеносных сосудов: розоватый оттенок слизи.
Также стоит отметить, что образование мокроты не является отличительным признаком бронхиальной астмы, однако при её появлении рекомендуется провести исследование для выявления природы биологического материала и выявления наличия специализированных формаций. В случае неосложненного течения бронхиальной астмы выделения мокроты проявляются в конце приступа, объем слизевой жидкости небольшой.
К специализированным формациям относятся:
- Спирали Куршмана: белые или прозрачные образования штопорообразной формы, наблюдаемые в бронхах у астматиков.
- Кристаллы Шарко-Лейдена: гладкие кристаллы в форме октаэдров, не имеют цвета.
Для обнаружения формаций возможно назначение проведения анализа при помощи бактериального посева.
Образование мокроты у больных астмы значительно усиливается в периоды обострения. Кроме того, затруднение выхода слизи, вызванное увеличением густоты жидкости, способно спровоцировать нежелательные осложнения:
- перекрывание дыхательных ходов;
- нехватка дыхания, удушье;
- появление хрипов во время приступов;
- деформация бронхиальных просветов, непроходимость бронхов;
- структурные изменения бронхов.
Изучение микробиологической природы мокроты и наличия инфекции позволяет составить правильную стратегию лечения для более эффективной терапии.
Основной задачей лечения застоев является устранение накопленной жидкости из бронхов при помощи различных методик и медикаментозной терапии, направленной на улучшение отхаркивания.
Возможные способы лечения:
- Медикаментозная терапия.
- Лечебный массаж в области грудной клетки.
- Дыхательная гимнастика.
- Физиотерапия.
- Применение народных рецептов.
Перед использованием домашних методов необходимо убедиться в отсутствии аллергии на компоненты средств и проконсультироваться с врачом.
Медикаментозная терапия включает:
- стимулирующие отхаркивание средства и муколитики (способствуют разжижению и выведению мокроты) — Лазолван, Амбробене, Амброксол, Флюдитек, Либексин-Муко;
- антигистаминные средства – Телфаст, Тайлед, Интал;
- травяные сборы для разжижения и выведения мокроты.
Антигистаминные средства необходимо использовать при развитии удушья и застоев мокроты из-за реакции на аллерген.
Кроме того, если лечение направлено на устранение инфекционного заболевания, стоит помнить, что комбинировать разжижающие мокроту средств и кашлевые блокаторы строго запрещается.
Лабораторная диагностика мокротных масс назначается в случае:
- длительного кашля с выделением мокроты;
- подозрений на развитие бронхита, пневмонии и других инфекционных форм воспалительного процесса органов дыхательной системы;
- опасности развития туберкулеза легких;
- подозрений на развитие злокачественных новообразований в области органов дыхания (при появлении кровяных включений также необходимо пройти диагностику методами бронхоскопии и компьютерной томографии).
Повышенная вязкость слизи является опасной проблемой для людей с бронхиальной астмой. Своевременная диагностика способна не только обезопасить человека от развития тяжелого удушья вследствие перекрывания дыхательных путей, но и быстрее справиться с причиной патологичного состояния.
Застойные процессы в бронхах — патологичный процесс, развивающийся на почве аллергической реакции или воспаления инфекционной природы. Накопление мокротных масс в бронхах является особенно опасным состоянием для астматиков, так как патология может стать причиной развития удушья и тяжелых нарушений дыхания. Лечение направлено на стимуляцию отхаркивания, восстановления дыхания и разжижение слизи при помощи физиотерапевтических методов и лекарственных препаратов.
источник
В главе о функциях органов дыхания мы уже приводили некоторые данные о мокроте больных бронхиальной астмой.
По-видимому, специфичность аллергической реакции, развивающейся в легких, частично будет проявляться появлением в мокроте эозинофилов и продуцируемых из них элементов, а также наличием в мокроте бактериальной флоры.
Изучение мокроты больных бронхиальной астмой началось с прошлого столетия. В 1872 г. Лейден выявил в мокроте больных кристаллы, названные впоследствии кристаллами Шарко — Лейдена В 1883 г. Куршман обнаружил в мокроте больных бронхиальной астмой спирали, которые получили название спиралей Куршмана. Через 6 лет, в 1889 г. Мюллер и его ученики нашли в мокроте эозинофилы. Вскоре после открытия в мокроте элементов, характерных для бронхиальной астмы, были подробно описаны физические свойства этих элементов и методы их выделения из мокроты больных бронхиальной астмой.
Вопросу об организации элементов мокроты при бронхиальной астме был посвящен ряд работ в России и за границей.
В России впервые описал и объяснил строение кристаллов Шарко — Лейдена и спиралей Куршмана В. Е. Предтеченский (1905). По его представлению, «главную массу типичных спиралей Куршмана и кристаллов Шарко — Лейдена составляют эозинофильные лейкоциты, слизь же является связующим элементом. Кристаллы Шарко — Лейдена и спирали Куршмана образуются во время припадка бронхиальной астмы».
Специфические для бронхиальной астмы форменные элементы мокроты встречаются, однако, не у всех больных бронхиальной астмой.
Н. Ф. Голубов (1898) находил в мокроте у больных бронхиальной астмой спирали Куршмана у 9 из 10 больных, М. Я. Арьев (1926) — у 18 из 52, Ф. Я. Ноткина и Н. К. Боголепов (1934) —у 22 из 50, Б. Б. Коган (1959)—у 68% больных. По данным С. Г. Звягинцевой (1958), спирали Куршмана в мокроте детей, больных бронхиальной астмой, встречаются редко.
Аналогичные данные были получены при исследовании мокроты больных бронхиальной астмой на кристаллы Шарко — Лейдена. Н. Ф. Голубов (1898) находил кристаллы в мокроте у 9 из 10 больных, М. Я. Арьев (1926) —у 13 из 52, Ф. Я. Ноткина и Н. К Боголепов (1934)—у 12 из 50, М. М. Орлов (1935) — у 1 из 31, Б. Б. Коган (1959)—у 44,55% больных. По данным С. Г. Звягинцевой (1958), кристаллы Шарко — Лейдена встречались в мокроте у 25% больных бронхиальной астмой.
Эозинофилы в мокроте больных бронхиальной астмой большинство авторов находило чаще, чем другие элементы. Н. Ф. Голубов (1898) нашел их у 10% больных. М. Я. Арьев (1926) находил эозинофилы в мокроте у больных во время приступа бронхиальной астмы постоянно, вне приступов — не у всех больных, но довольно часто. Б. Б. Коган (1959) находил эозинофилы в мокроте во время приступов у 72,59%, вне приступов—у 8,1% больных. С. Г. Звягинцева (1958) во время приступа бронхиальной астмы в мокроте у детей находила эозинофилы у 90% больных. Увеличение количества эозинофилов в мокроте и крови часто происходило одновременно.
Кнотт (Knott, 1930) нашел эозинофилы в мокроте у 85 больных из 132. Кнотт (1930) и Персон (Pearson, 1958) при исследовании мокроты 222 больных, выделенной во время приступа бронхиальной астмы, отметили следующее: 1) у больных без явлений вторичной инфекции в бронхах в мокроте было большое количество эозинофилов, 2) у больных с инфекционными поражениями бронхов в мокроте были найдены эозинофилы и нейтрофильные лейкоциты и 3) у больных с тяжелыми инфекционными поражениями бронхов в мокроте встречались единичные эозинофилы или они отсутствовали, мокрота по своему характеру была гнойной.
Примесь крови в мокроте у больных бронхиальной астмой наблюдается редко, чаще всего она зависит от обострения бронхоэктатической болезни, реже можно наблюдать незначительную примесь крови после тяжелых, остро протекающих приступов бронхиальной астмы как следствие разрыва мелких сосудов слизистой верхних дыхательных путей.
В большинстве случаев запаха мокрота не имеет, в очень редких случаях в периоде осложнений может появляться гнилостный запах.
У 100 больных, находившихся под нашим наблюдением, из которых у 80 были осложнения, во время приступов бронхиальной астмы и при астматическом состоянии в мокроте были найдены кристаллы Шарко — Лейдена, спирали Куршмана и эозинофилы. Вне приступов бронхиальной астмы, при отсутствии спастических явлений в бронхах, кристаллы Шарко — Лейдена в мокроте мы обнаруживали у 37% больных, спирали Куршмана — у 24% и эозинофилы — у 55% больных.
Если сравнить полученные нами данные с данными лабораторных анализов, выданных нашим больным в лабораториях поликлиник города, то можно убедиться в том, что в городских лабораториях процент нахождения элементов бронхиальной астмы колеблется между 10 и 15. По-видимому, при массовых исследованиях трудно отыскать в мокроте форменные элементы, характерные для бронхиальной астмы; кроме того, больные недостаточно точно выполняют правила и распоряжения врача по собиранию мокроты.
Еще в прошлом столетии Н. Ф. Голубов (1898) рекомендовал искать в мокроте элементы, характерные для бронхиальной астмы, более тщательно. Он предупреждал, что они бывают малыми, и приходится пользоваться иммерсионными системами микроскопа для их отыскания.
С нашей точки зрения, важен вопрос и о влиянии на образование, форменных элементов бронхиальной астмы средств, купирующих приступы бронхиальной астмы (адреналин, эфедрин, атропин и ряд других), изменяющих одновременно и сократительную способность стенки бронхов и бронхиол и условия для прохождения эозинофилов из крови в просвет бронхов и бронхиол. Также интересен вопрос о зависимости количества отделяющейся мокроты у больных бронхиальной астмой от применяемых фармакологических препаратов и физических методов лечения больных бронхиальной астмой.
Большое количество мокроты мы наблюдали у больных бронхиальной астмой в периоде осложнений. Мокрота отделялась после самопроизвольного купирования приступа или после инъекции адреналина.
Механизм отделения мокроты после приступа бронхиальной астмы можно объяснить следующим образом. Слизистые железы бронхов лежат между хрящом и мышечным слоем, и их протоки пробиваются в просветы бронхов через мышечный слой. Во время приступа астмы бронхиальная мускулатура спастически сокращена, что ведет к закрытию протоков желез и поэтому, пока приступ не окончился, слизистое содержимое желез не имеет выхода. Вот почему в момент окончания спазма мускулатуры бронхов, совпадающего с окончанием приступа бронхиальной астмы, и начинает отделяться тягучая, густая желеобразная мокрота.
В заключение вернемся к обсуждению диагностической ценности эозинофилов и других элементов мокроты больных бронхиальной астмой.
У большинства больных бронхиальной астмой можно установить определенные соотношения эозинофилов в мокроте с эозинофилами крови. Установлено, что во время приступов бронхиальной астмы продуцируется мокрота с большим количеством эозинофилов, в то же время количество эозинофилов в крови также нарастает. Это дает нам возможность считать патогномоничной для острой аллергической реакции — приступа бронхиальной астмы — местную эозинофилию, находящуюся в прямой связи с общей эозинофилией, столь характерной для бронхиальной астмы.
В нашей клинике Л. А. Глинская (1956) определяла количество белка в мокроте у больных бронхиальной астмой. Она установила, что у больных, которые выделяли значительное количество мокроты, потеря белка с мокротой небольшая. У этих больных содержание общего белка в сыворотке крови оставалось в пределах нормальных цифр.
Изучение бактериальной флоры мокроты у больных бронхиальной астмой началось более 40 лет тому назад М. М. Штуцером (1923). В 1922—1923 гг. у 18 больных бронхиальной астмой он обнаружил в мокроте 36 видов микроорганизмов. На первом месте были стрептококки и пневмококки, на втором — стафилококки, бациллы Фридлендера и псевдодифтерийные палочки. Бациллы Фридлендера были выявлены у больных тяжелой формой бронхиальной астмы, и М. М. Штуцер высказал предположение, что они могут быть причиной сенсибилизации организма.
Уильмер и Кобе (1933) изучили и сравнили количественный и качественный состав микроорганизмов мокроты у 500 больных бронхиальной астмой с составом мокроты у 200 здоровых людей. Соотношение микроорганизмов в мокроте у больных бронхиальной астмой и у здоровых людей оказалось следующим: стафилококков у здоровых —54%, у больных бронхиальной астмой — 28,6%; катаральных микрококков соответственно — 63,6 и 34,5%; пневмококков — 54,5 и 62,4%; грамотрицательных бацилл —24,0—20,2%; стрептококков —46,0—67,4%; у 23,4% больных бронхиальной астмой были обнаружены сарцины, у здоровых их не было. Культуры микроорганизмов из мокроты больных бронхиальной астмой состояли: из одного вида микроорганизмов— у 50 больных, из 2 видов — у 192, из 3 видов — у 169, из 4 видов — у 61, из 5 видов —у 40, из 6 видов — у 20 и из 7 видов — у 20 больных.
Стрептококки, стафилококки и пневмококки из мокроты больных бронхиальной астмой выделил Ракеман (1945).
Различные виды стрептококков, стафилококков, атипичных грамотрицательных кокков и атипичных грамотрицательных бацилл, пневмококков и других микроорганизмов находили в мокроте у больных бронхиальной астмой Томас и Туарт (Thomas, Touart, 1933), Нитти (Nitti, 1934).
В 80% наблюдений Гебом (1939) был получен из мокроты детей, больных бронхиальной астмой, особого вида гемолитический стрептококк. Зеленящий стрептококк в мокроте больных бронхиальной астмой, страдавших насморком и пневмонией, находил Кеммерер (1936).
«Грамотрицательные бациллы» в мокроте у 51 больного бронхиальной астмой обнаружил Кнотт (1930). Грамотрицательной бацилле Кнотт (1930), Гаркави (Harkavy, 1930) придавали особое значение, так как этот вид бацилл выделяет гистамин, который, как известно, вызывает спазм гладкой мускулатуры.
Если найденные у больных бронхиальной астмой микроорганизмы распределить по частоте их обнаружения, то на первом месте следует поставить стрептококки, на втором— катаральные микрококки, на третьем и четвертом — пневмококки и стафилококки. У здоровых людей распределение микроорганизмов будет иным: на первом месте окажутся стафилококки, на втором — пневмококки, на третьем и четвертом — стрептококки и катаральные микрококки.
Мы производили бактериологические исследования мокроты у 58 больных бронхиальной астмой в период до применения антибиотиков. У 38 больных из мокроты был высеян зеленящий стрептококк, у 16 — гемолитический стрептококк, у 23 — пневмококк, у 8 — стафилококки, у 38 больных — прочие виды. У 16 больных был выделен один вид микроорганизмов, преимущественно стрептококк, у 24 —2 вида, у 15 — 3 вида, у 3 больных — 6 и больше видов микроорганизмов.
Несколько иные результаты были получены при исследовании мокроты у больных бронхиальной астмой за период с 1960 по 1962 г. Была обследована мокрота у 122 больных бронхиальной астмой в период обострения хронической неспецифической пневмонии. При этом обнаружены: стрептококк гемолитический — у 88,0% больных, стрептококк негемолитический — у 30,6%, стрептококк зеленящий — у 56,4%, стрептококк золотистый— у 76,1%, стафилококк белый — у 17,7%, стафилококк лимонно-желтый — у 6,4%. пневмококк —у 10,3%, диплококк грамположительный — у 22,5%, кишечная палочка — у 43,5%, микрококк катаральный — у 17,7% больных и другие виды микробов. Дрожжевые клетки были обнаружены у 40% больных. Флора мокроты состояла в среднем из 5—6 видов микроорганизмов. Если сопоставить данные, полученные в период до применения антибиотиков и в период 1960—1962 гг., то можно отчетливо видеть, как изменилась бактериальная флора мокроты, в основном за счет увеличения количества различного вида стрептококков, кишечной палочки и дрожжевых клеток.
Таким образом, если подытожить полученные нами и другими исследователями данные, можно сделать следующий вывод: основным видом микроорганизмов, высеянных из мокроты больных бронхиальной астмой, являются стрептококки. Надо полагать, что с этим видом микроорганизмов чаще всего и связаны токсикоинфекционные процессы в дыхательных путях.
Как писал Н. Д. Стражеско (1937), «. стрептококковый (пневмококковый) сепсис всегда развивается из первичного очага, воротами для которого является место нарушения целости на слизистых оболочках». У больных бронхиальной астмой такими воротами являются в основном бронхи и верхние дыхательные пути, через эти «ворота» идет сенсибилизация организма.
Сенсибилизация из очага может тянуться длительное время без клинических проявлений, давая по временам повышение температуры, иногда ощущение разбитости и другие неясные симптомы. В дальнейшем инфекция может принять хронический характер, из ее очага будет происходить постоянная сенсибилизация организма с постоянным отделением микроорганизмов в мокроте больных бронхиальной астмой.
Эозинофилия же и специфические для бронхиальной астмы элементы в мокроте, наблюдаемые нами и другими исследователями у больных бронхиальной астмой, могут рассматриваться как выражение местного инфекционного аллергического процесса.
Мы полагаем, что вопрос о флоре мокроты больных бронхиальной астмой подлежит дальнейшему изучению. Обычно мокрота собирается самими больными и имеет примесь бактериальной флоры полости рта. Мокроту следует брать непосредственно из бронхов первого или второго порядка при бронхоскопии, тогда с достоверностью можно будет судить о наличии бактериальной флоры именно бронхов и легких.
источник
ДИФФЕРЕНЦИАЛЬНО-ДИАГНОСТИЧЕСКИЕ ОСОБЕННОСТИ ИССЛЕДОВАНИЯ МОКРОТЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ
При аллергическом воспалении ключевой фигурой клеточного ответа на воздействие различных полютантов является эозинофил. Основным повреждающим фактором выступает главный основной белок эозинофилов, который вызывает деструкцию мукоцилиарного аппарата и нарушает мукоцилиарный клиренс. При дегрануляции тучных клеток образующиеся оксиданты повреждают мембраны эпителиальных клеток, приводя их к гибели и слущиванию эпителия. Конгломераты этих слущенных, измененных эпителиальных клеток формируют тельца Креола, выявляемые в мокроте. Отслойка эпителия обнажает ирритантные рецепторы блуждающего нерва, что способствует усилению секреции слизи.
Для больных бронхиальной астмой (БА) характерно выделение небольшого количества слизистой бесцветной мокроты. Она не содержит гноя, пока не присоединяется сопутствующая инфекция. После приступа можно наблюдать отхождение «стекловидной» мокроты. При атопическом варианте БА мокрота бывает ярко-желтого или канареечного цвета. Присоединение гнойного компонента придает ей зеленоватый оттенок.
При микроскопическом исследовании мокроты обнаруживаются:
1. Клетки эпителия: плоского, выстилающего ротовую полость, — не имеют диагностического значения; цилиндрического, реснитчатого — характерны для мокроты при остром приступе БА. Бокаловидные клетки встречаются при гиперпродукции слизи. Клетки бронхиального эпителия часто единичные, с гидрошгческим перерождением и плохо определяемой морфологией. При обострениях эти клетки собираются в более крупные скопления, имеют вакуолизированную цитоплазму с реснитчатыми краями, их называют Тельцами Креола (Creola) и считают неблагоприятным прогностическим признаком.
2. Альвеолярные макрофаги —- нередко называемые «чистильщиками» трахеобронхиально-го дерева, поскольку выполняют свою функцию путем фагоцитоза инородных компонентов тра-хеобронхиального содержимого. Наличие липид-ньгх капе\ь в цитоплазме альвеолярных макрофагов (липофагов) расценивают как признак обструктивного компонента в бронхах или бронхиолах
3. Эозинофильные лейкоциты.
4. Кристаллы Шарко—Лейдена — возникают вследствие распада эозинофильных лейкоцитов и кристаллизации белков, находящихся в них
5. Нейтрофильные лейкоциты — при инфекционном воспалении.
6. Моноциты и гистиоциты появляются в значительных количествах в фазе выздоровления (регенерации).
7. Спирали Куршмана — уплотненные, закрученные в спираль образования из слизи.
При обострении БА наблюдается так называемая «астматическая триада», включающая в себя эозинофилию мокроты, наличие спиралей Куршмана и кристаллов Шарко—Лейдена.
Микозы органов дыхания по клиническим симптомам и рентгенологическим признакам часто имитируют воспалительные или опухолевые поражения. Лучше исследовать первую утреннюю порцию мокроты, так как она представляет собой выделения трахеобронхнального дерева за ночь. В диагностике пневмомикозов преимущественно применяются исследования нативных препаратов мокроты на наличие в них элементов грибов (дрожжевые клетки, споры, почкующиеся формы мицелий — сферулы).
Это не настоящий грибок, а грамположительный микроорганизм, который медленно растет с ответвлением филаментов. Он является комменсалом, но может стать патологическим. Макроскопически выглядит в виде желтых (зеленовато-желтых) гранул в диаметре менее 1 мм.
Мукоромикоз редко поражает легкие и чаще встречается при диабете. Во влажном нативном препарате можно видеть огромные (15 мкм в диаметре) несептированные гифы. Необходимо выделение культуры.
Пневмоцистоз — плазмоклсточная пневмония, вызываемая Pneumocystis carinii, встречающаяся предогущественно у ослабленных больных, страдающих хроническими болезнями крови, онкологическими заболевании, при различных иммунодефицитах, особенно при ВИЧ инфекции, а также у детей раннего возраста, у недоношенных, ослабленных вследствие других заболеваний и на фоне приема глюкокортикоидов и иммунодепрессантов. Pneumocystis carinii вызывает воспалительную инфильтрацию межальвеолярных перегородок, что приводит к нарушению газообмена, заполнению альвеол пенистой массой и развитию гипоксии.
Образование слизисто-гнойной мокроты — это один из кардинальных признаков бронхшктазов, а откашливаемый объем зависит от положения тела. Типичен утренний кашель. Мокрота обычно гнилостная, серо-зеленого цвета (50— 250 мл в день), временами с примесью крови, при отстаивании разделяется на три слоя: 1) верхний пенистый, который позже оседает, 2) средний — густой (мутный) слизистый и 3) нижний — слой клеток гноя и микробов. Микроскопическое исследование данного слоя выявляет клетки бронхиального эпителия, кристаллы жирных кислот, бактерии и иногда пробки Дитриха. При раздавливании они издают гнилостный запах.
Макроскопически мокрота может быть слизистой (белая или прозрачная) либо гнойной (желтая или желто-зеленая). При кровохарка нье, связанном с хроническим бронхитом (ХБ), в мокроте присутствуют прожилки крови. Также можно обнаружить слизистые и гнойные пробки, а при наличии бронхоспастического синдрома — бронхиальные слепки. При фибринозном бронхите характерно откашливание «муляжей бронхиального дерева». Откашливаемый объем зависит от активности воспалительного процесса и в среднем составляет 60 мл в день. В разгар заболевания увеличивается количество лейкоцитов и эпителиальных клеток. Для гнойной мокроты характерно большое количество нейтрофильных лейкоцитов, макрофагов. При вступлении в фазу ремиссии отмечается увеличение гистиоцитов и моноцитов. Окраска по Граму обычно выявляет смешанную микрофлору.
Активная фаза сопровождается ростом активности некоторых ферментов в мокроте. Так, отмечается повышение активности лактатдегидрогеназы (ЛДГ), особенно перед обострением воспалительного процесса и при клиническом ухудшении. Поэтому соответствующие изменения в антибактериальной терапии можно сделать, не дожидаясь микробиологических или клинических признаков. Отклонение показателей вязкости и эластичности мокроты в сторону их уменьшения или увеличения приводит к значительному замедлению транспорта слизи.
Межклеточное взаимодействие играет важную роль при инфекционном воспалении. Так, защитная функция нейтрсфилов обусловлена их способностью генерировать цитотоксические агенты, такие, как активные формы кислорода, протеолитические ферменты, катионные протеины. В то же время их воздействие на ткани может носить поражающее действие. Существенное влияние на интенсивность образования ТВС оказывают протеазы. Так, химаза, выделяемая тучными клетками, является сильным секретогенным фактором для серозных клеток, подслизистых желез бронхов. Такой же эффект оказывают эластаза и катепсин G нейтрсфилов, которые действуют не только на серозные, но и на бокаловидные клетки.
Несомненное воздействие на формирование ТВС при инфекционном воспалении оказывает микрофлора дыхательных путей. Некоторые бактерии, в частности Pseudomonas aeruginosa, выделяют вещество, стимулирующее секрецию железами трахеи и бронхов муцина, но ингибирую-щее подвижность ресничек слизистой оболочки. Воздействие микрофлоры может быть опосредованным. Так, выделение медиаторов воспаления может стимулироваться через рецепторы с помощью анафилатоксинов СЗа и С5а, которые являются компонентами системы комплемента при его активации по классическому и неальтернативному пути. Активаторами систем комплемента по альтернативному пути выступают полисахариды бактерий, антигены некоторых видов грибков и компоненты аллергенов домашней пыли.
Т.е. при инфекционном воспалении с характерным присутствием нейтрофилов, выполняющих свою биологическую роль в борьбе с инфекционным патогеном, изменяются условия формирования ТБС под действием цитокинов и БАБ, выделяемых клетками, что приводит и к активации систем местной защиты. Наряду с активацией оксида нтной и протеолитической систем и стимуляцией выработки ТБС в зоне воспаления в силу вазодилятирующего эффекта БАВ увеличивается интенсивность кровотока и усиливается пропотевание плазмы из сосудистого русла.
В результате такого взаимодействия защитных механизмов при инфекционном воспалении, наряду с компонентами плазменного происхождения, количество которых увеличивается при экссудации, в бронхиальном секрете появляются продукты жизнедеятельности и распада микроорганизмов. Бактериальные энзимы, протеазы разрушенных клеток могут вторично видоизменять сиаломуцины и приводить к утрате их способности формировать волокнистые структуры, т. е. нарушению каркаса слизи.
В итоге для инфекционного воспаления, например при ХБ, характерна мокрота как с максимальной суммарной осмотической концентрацией, так и основных ее компонентов: натрия, калия, хлоридов и бикарбонатов, обусловливающих сдвиг рН среды в щелочную сторону.
Цель последовательных и в то же время одновременных событий с образованием клеточных коопераций в ответ на патоген при развитии инфекционного воспаления в бронхах представляется в интенсивной альтерации, выполняющей роль защиты и проявляющейся путем «вылущивания» части эпителиальной выстилки слизистой (как правило, до базального эпителия) как пути элиминации патогена.
Чем ярче проявления ответа организма на воздействие инфекционного возбудителя в виде активного привлечения лимфоцитов, мобилизации макрофагов, тем меньше проявления альтерации, десквамации эпителия. При снижении остроты воспалительного процесса в бронхах то есть снижении количества нейтрофилов в мокроте, возрастает пред ста вигельство «чистильщиков бронхиального дерева», какими являются макрофаги, а также лимфоцитов.
При этом и изменения химического состава ТБС, несомненно, носят закономерный характер. Преобладание щелочных валентностей над кислыми в составе ТБС может быть расценено как результат целенаправленной функции эпителия по регуляции активности протеаз, выделяемых нейтрофилами, а также обеспечении оптимального объема реакций оксидантных систем. Известно, что оптимизацию реологических свойств ТБС, существенно измененных при развитии ХБ из-за присутствия ДНК из лизированных клеток, можно достичь за счет усиления щелочной pea к-ции в бронхах (щелочное питье, ингаляции). При отсутствии причин для выраженного поражения базальной мембраны регенерация эпителия, а следовательно, восстановление целостности слизистой происходит достаточно быстро.
Мокрота появляется только при прорыве абсцесса в бронх. Необходимо ежедневно измерять суточное количество мокроты, которая со-бираегся в плевательницу с завинчивающейся крышкой. Мокрота, как правило, гнойная, нередко появляются прожилки крови или кровохарканье. При благоприятном течении постепенно исчезает зловонный запах, все более тонким становится слой осадка на дне банки. Необходимо помнить, что кровохарканье в более поздние фазы процесса служит нередко предвестником профузного легочного кровотечения. При микроскопическом исследовании осадка обнаруживают большое количество разрушающихся лейкоцитов, кристаллы гематоидина, холестерина, жирных кислог.
Этиологическими агентами обычно являются Klebsiella pneumoniae, Hemophilus influenzae, Staphylococcus aureus, Streptococcus hemoli-ticus. Микроорганизм считается этиологически значимым при концентрации его в мокроте 10 6 микробных тел в 1 мл или смыве из бронхиального дерева 10 4 микробных тел в 1 мл. Чаще всего в мокроте присутствует смешанная микрофлора. Необходимо исключить наличие туберкулезного процесса и злокачественных опухолей.
Для ранней диагностики пневмоний исследуют обычно мокроту, окрашенную по Граму. Мокроту предварительно гомогенизируют для лучшего распределения патогенных микробов. При пневмониях, вызванных грамположительной флорой, чаще всего выявляется Pneumococcus (streptococcus) pneumoniae; реже стафилококки и другие стрептококки.
При пневмококковой пневмонии свойства мокроты изменяются в зависимости от стадии болезни. Мокрота при начинающейся долевой пневмонии скудная, с примесью крови. В стадии красного опеченения мокрота становится ржавой, вязкой и слизисто-гнойной. Микроскопически выявляется много вне- и внутриклеточных микробов, эпителиальных клеток, лейкоцитов и эритроцитов. В стадии разрешения мокрота становится более обильной, менее вязкой и выгля дит как при хроническом бронхите. Повторное появление ржавой окраски указывает на прегрессирование заболевания или вовлечение в патологический процесс другого легкого. Таким пациентам с целью контроля за эффективностью лечения и исключения вторичной инфекции необходимо ежедневно исследовать мокроту, окрашенную по Граму.
Для обеспечения результативности бактериологического исследования мокроты необходимо выполнение нескольких условий: исследование утренней мокроты не позже чем через 1 час с момента ее откашливания
Дата добавления: 2014-11-16 ; Просмотров: 590 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
источник