Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
При типичных жалобах пациента используют определённый алгоритм диагностики бронхиальной астмы.

Вероятность бронхиальной астмы возрастает, если в анамнезе присутствуют:
- атопический дерматит;
- аллергический риноконъюнктивит;
- отягощенный семейный анамнез по бронхиальной астме или другим атопическим заболеваниям.
Диагноз бронхиальной астмы часто можно предположить, если у пациента присутствуют следующие симптомы:
- эпизоды одышки;
- свистящие хрипы;
- кашель, усиливающийся преимущественно в ночные или предутренние часы;
- заложенность в грудной клетке.
Появление или усиление симптомов бронхиальной астмы:
- после эпизодов контакта с аллергенами (при контакте с животными, клещами домашней пыли, пыльцевыми аллергенами);
- в ночные и предутренние часы;
- при контакте с триггерами (химические аэрозоли, табачный дым, резкий запах);
- при перепадах температуры окружающей среды;
- при любых острых инфекционных заболеваниях дыхательных путей;
- при сильных эмоциональных нагрузках;
- при физической нагрузке (пациенты отмечают типичные симптомы бронхиальной астмы или иногда длительный кашель, обычно возникающий через 5-10 мин после прекращения нагрузки, редко — во время нагрузки, который самостоятельно проходит в течение 30-45 мин).
При осмотре необходимо обратить внимание на следующие признаки, характерные для бронхиальной астмы:
- одышка;
- эмфизематозная форма грудной клетки;
- вынужденная поза;
- дистанционные хрипы.
При перкуссии возможен коробочный перкуторный звук.
Во время аускультации определяют удлинение выдоха или свистящие хрипы, которые могут отсутствовать при обычном дыхании и обнаруживаться только во время форсированного выдоха.
Необходимо учитывать, что в связи с вариабельностью астмы проявления болезни могут отсутствовать, что не исключает бронхиальную астму. У детей в возрасте до 5 лет диагноз бронхиальной астмы основан главным образом, на данных анамнеза и результатах клинического (но не функционального) обследования (большинство педиатрических клиник не располагают такой точной аппаратурой). У детей грудного возраста, имевших три эпизода свистящих хрипов и более, связанных с действием триггеров, при наличии атопического дерматита и/или аллергический ринит, эозинофилии в крови следует подозревать бронхиальную астму, проводить обследование и дифференциальную диагностику.

У детей старше 5 лет необходимо проводить оценку функции внешнего дыхания. Спирометрия позволяет оценить степень обструкции, её обратимость и вариабельность, а также тяжесть течения заболевания. Однако спирометрия позволяет оценивать состояние ребёнка только на момент осмотра. При оценке показателей ОФВ1 и форсированной жизненной ёмкости лёгких (ФЖЁЛ) важно ориентироваться на должные показатели, полученные в ходе популяционных исследований, которые учитывают этнические особенности, пол, возраст, рост.
Таким образом, оценивают следующие показатели:
- ОФВ ;
- ФЖЕЛ;
- отношение ОФВ,/ФЖЁЛ;
- обратимость бронхиальной обструкции — увеличение ОФВ, по крайней мере на 12% (или 200 мл) после ингаляции сальбутамола либо в ответ на пробное лечение глюкокортикостероидами.
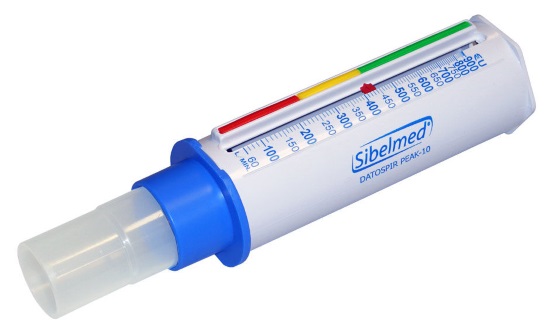
Пикфлоуметрия (определение ПСВ) — важный метод диагностики и последующего контроля лечения бронхиальной астмы. Последние модели пикфлоуметров относительно недороги, портативны, выполнены из пластика и идеально подходят для использования пациентами старше 5 лет в домашних условиях с целью ежедневной оценки течения бронхиальной астмы. При анализе показателей ПСВ у детей используют специальные номограммы, но более информативен ежедневный мониторинг ПСВ в течение 2-3 нед для определения индивидуального наилучшего показателя. ПСВ измеряют утром (обычно наиболее низкий показатель) до ингаляций бронхолитиков, если ребёнок их получает, и вечером перед сном (как правило, наиболее высокий показатель). Заполнение больным дневников самоконтроля с ежедневной регистрацией в нём симптомов, результатов ПСВ играет важную роль в стратегии лечения бронхиальной астмы. Мониторинг ПСВ может быть информативен для определения ранних симптомов обострения заболевания. Дневной разброс показателей ПСВ более 20% рассматривают как диагностический признак бронхиальной астмы, а величина отклонений прямо пропорциональна тяжести заболевания. Результаты пикфлоуметрии свидетельствуют в пользу диагноза бронхиальной астмы, если ПСВ увеличивается по крайней мере на 15% после ингаляции бронхолитика или при пробном назначении глюкокортикосетроидов.
Таким образом, важно оценить:
- суточную вариабельность ПСВ (разность между максимальным и минимальным значениями в течение дня, выраженную в процентах от средней за день ПСВ и усреднённую за 1-2 нед);
- минимальное значение ПСВ за 1 нед (измеряемой утром до приёма бронхолитика) в процентах от самого лучшего в этот же период показателя (Min/Max).
У пациентов с симптомами, характерными для бронхиальной астмы, но с нормальными показателями функции лёгких, в постановке диагноза БА может помочь исследование реакции дыхательных путей на физическую нагрузку.
У некоторых детей симптомы бронхиальной астмы провоцирует только физическая нагрузка. В этой группе полезно проведение нагрузочного теста (6-минутный протокол нагрузки бегом). Использование этого метода исследования совместно с определением ОФВ, или ПСВ может быть полезно для постановки точного диагноза бронхиальной астмы.
Для выявления бронхиальной гиперреактивности можно применять тест с метахолином или гистамином. В педиатрии их назначают крайне редко (в основном у подростков), с большой осторожностью, по особым показаниям. При диагностике бронхиальной астмы эти тесты имеют высокую чувствительность, но низкую специфичность.
Специфическую аллергологическую диагностику проводят врачи-аллергологи/иммунологи в специализированных учреждениях (отделениях/кабинетах).
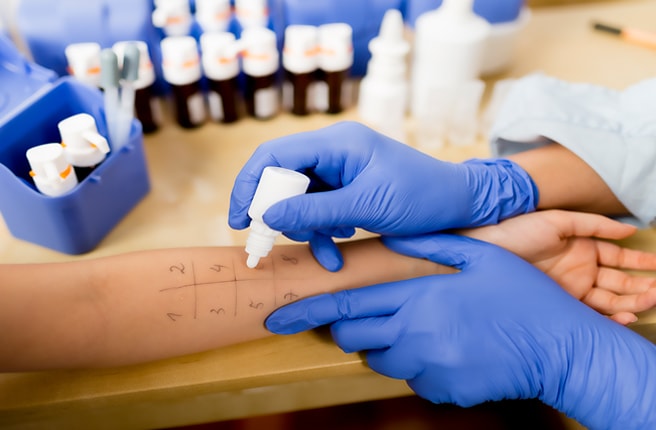
Аллергологическое обследование обязательно для всех больных с бронхиальной астмой, оно включает: сбор аллергологического анамнеза, проведение кожного тестирования. определение уровня общего IgE (и специфических IgE в случаях, когда невозможно проведение кожных проб).
Кожные тесты с аллергенами и определение уровней специфических IgE в сыворотке крови помогают выявить аллергический характер заболевания, установить причинно-значимые аллергены, на основании чего рекомендуют соответствующий контроль факторов окружающей среды (элиминационный режим) и разрабатывают схемы специфической иммунотерапии.
Неинвазивное определение маркёров воспаления дыхательных путей (дополнительные диагностические методы):
- исследование мокроты, спонтанно продуцируемой или индуцированной ингаляцией гипертонического раствора натрия хлорида, на клетки воспаления (эозинофилы или нейтрофилы);
- определение уровня оксида азота (NО) и окиси углерода (FeCO) в выдыхаемом воздухе.

Определение степени тяжести обострений бронхиальной астмы и показаний к госпитализации при обострении
Определение тяжести обострений бронхиальной астмы
источник
Для того чтобы начать эффективное лечение заболевания, важно сначала поставить правильный диагноз. И в первую очередь требуется исключить болезни, которые имеют такую же симптоматику, как и бронхиальная астма.
Именно для этого и была разработана и успешно применяется дифференциальная диагностика. Подтверждение диагноза при бронхиальной астме – это важный этап, предшествующий лечению болезни.
Бронхиальная астма – это хроническое неинфекционное заболевание. Воспалительный процесс, протекающий в бронхах, вызывает увеличенное выделение густого, трудно выводящегося секрета. Кроме этого, возможен отек слизистой бронхов.
Пациент испытывает затруднения при дыхании, у него появляется сухой кашель, возможно развитие одышки. Дыхание становится свистящим, выдох значительно длиннее вдоха. Приступ бронхиальной астмы сопровождается удушьем.
Дифференциальная диагностика при бронхиальной астме позволяет исключить заболевания, проявляющиеся похожими симптомами, но требующие совершенно другого лечения.
Бронхиальная астма на ранних стадиях имеет слабовыраженную симптоматику. Приступы случаются редко. Одышка если и появляется, то только после физической нагрузки.
В этот период ее легко спутать с респираторными заболеваниями, вызывающими подобные симптомы.
Больной чаще всего не обращается к врачу, предпочитая справляться с недомоганием собственными силами.
Однако астма требует совершенно иного лечения, чем инфекционные заболевания. Так как чаще всего приступы развиваются на фоне аллергических реакций, в первую очередь необходимо бороться именно с этой проблемой.
Для того чтобы точно определить заболевание и подтвердить или опровергнуть диагноз «бронхиальная астма», необходима дифференциальная диагностика.
Только после этого врач может назначить правильное лечение и подобрать эффективные препараты.
Бронхиальная астма – заболевание, которое достаточно трудно диагностировать. Для подтверждения или опровержения диагноза врачу необходимо провести дифференциальную диагностика. Она состоит из следующих этапов:
- Сбор и систематизация жалоб пациента.
- Осмотр больного.
- Выяснение информации о наличии одышки, условиях ее появления.
- Изучение анамнеза пациента, выявление случаев аллергических реакций.
- Проведение клинических исследований крови и мочи, анализ их результатов.
- Оценка функции дыхания. Для этого применяют спирографию и другие методы.
Дифференциальная диагностика требует проведения комплексного обследования. Только опираясь на все собранные данные, можно утверждать, что пациент страдает бронхиальной астмой.
Так как бронхиальная астма по своим симптомам очень похожа на некоторые другие заболевания, важно провести ряд исследований. На основании полученных данных можно поставить дифференциальный диагноз.
Симптомы при бронхиальной астме схожи с проявлениями бронхита, сердечной астмы и других патологий.
Кроме того, состояние удушья, например, может вызвать и перекрывание дыхательных путей инородным телом.
Для того чтобы поставить правильный диагноз, важно учитывать всю совокупность признаков. У пациента должны присутствовать характерные для БА симптомы. К ним относят:
- приступы сухого кашля;
- одышку, появляющуюся даже при незначительной физической активности;
- состояние удушья, купирующееся только с помощью расширяющих бронхи лекарственных препаратов.
Все эти симптомы доставляют сильный дискомфорт пациенту и вынуждают обратиться его за врачебной помощью.
Для постановки диагноза врач использует методы дифференциальной диагностики. При этом он в первую очередь обращает внимание на симптомы, которые всегда связаны с бронхиальной астмой.
Бледность кожных покровов, увеличение частоты сердечных сокращений, изменение ритма дыхания – все это относят к типичным симптомам БА у взрослых и детей. Очень часто при аускультации врач может услышать хрипы (свистящие, слышимые с обеих сторон грудной клетки).
Однако важно помнить, что подобную симптоматику могут давать и другие болезни, не связанные с хроническим воспалительным процессом в бронхах. Из наиболее часто встречающихся патологий следует отметить:
- сердечную астму;
- ХОБЛ;
- хронические неспецифические заболевания легких;
- новообразования в легких.
Именно поэтому дифференциальная диагностика является важным инструментом для постановки правильного диагноза.
Бронхиальная астма по своей симптоматике очень похожа на хронический бронхит. Но при этих патологиях используют совершенно разные схемы лечения.
Именно поэтому очень важно правильно дифференцировать заболевание и не только установить его первопричину, но и определить пути лечения.
При дифференциальной диагностике выявляется ряд принципиальных отличий бронхита от бронхиальной астмы:
- Появление одышки при бронхите не связано с наличием аллергена. Приступообразность проявлений отсутствует.
- Сухие хрипы появляются в первой фазе дыхания и слышны даже на расстоянии.
- При бронхите отсутствует обратимость симптомов.
Для окончательной постановки диагноза следует провести ряд лабораторных исследований. Врач назначает:
- исследование мокроты;
- рентгенографию легких;
- пикфлоуметрию;
- анализ крови и мочи.
Дифференциальная диагностика имеет большое значение и для различия сердечной и бронхиальной астмы. Установлено, что многие заболевания сердечно-сосудистой системы, например, левожелудочковая недостаточность, могут давать симптомы, схожие с приступом БА.
Такое состояние пациента называется сердечной астмой. При этом больной страдает от одышки, сильного кашля и учащенного сердцебиения. Могут наблюдаться и приступы удушья.
При развитии приступа сердечной астмы возможен отек легких и бронхов и выделение пенистой мокроты. В этом случае, в отличие от приступа бронхиальной астмы, больному труднее сделать вдох, чем выдох.
Также нет никакой связи между ухудшением состояния больного и воздействием аллергенов или других провоцирующих факторов.
Для снятия приступа зачастую достаточно принять препарат нитроглицеринового ряда.
Из-за схожести симптомов пациенту в обязательном порядке назначают ЭКГ, УЗИ сердца и рентгенографию. Это поможет подтвердить или исключить сердечную астму.
ХОБЛ (хроническая обструктивная болезнь легких) – заболевание дыхательной системы, сопровождающееся не полностью обратимой обструкцией дыхательных путей. Для него характерен воспалительный процесс в тканях легких.
Данная болезнь неизлечима. По своим проявлениям она может быть похожа на ряд других не менее опасных заболеваний, таких как, например, бронхиальная астма.
Именно поэтому постановка дифдиагноза в этом случае является необходимым действием для назначения правильного лечения.
Проще всего проводить дифференциальную диагностику на ранних стадиях заболевания, до появления осложнений. Если у пациента подозревают ХОБЛ, обязательна проверка и на БА, так как симптомы этих болезней сходны.
Методы исследования врач выбирает, исходя из состояния больного. Однако в любом случае есть ряд анализов, проведение которых необходимо:
- анализ крови;
- рентгенография легких;
- исследование мокроты;
- оценка функции внешнего дыхания.
К основным отличиям ХОБЛ от БА следует отнести:
- Одышка при бронхиальной астме является приступообразной. При ХОБЛ она постоянная. При отсутствии лечения симптомы медленно нарастают.
- В развитии БА большую роль играет наследственная предрасположенность. ХОБЛ не связана с генетическими факторами.
- ХОБЛ часто развивается у курильщиков.
- БА чаще всего диагностируется в детстве, а ХОБЛ — после 40 лет.
- Астму могут сопровождать проявления аллергии.
- При ХОБЛ обструкция бронхов необратима.
- Тяжелая форма ХОБЛ вызывает поражения сердца.
Для диагностики часто назначают тест на диффузную емкость легких. При ХОБЛ она ниже нормы.
Кроме ХОБЛ, похожую симптоматику могут вызывать и другие заболевания легких. Чаще всего встречаются:
- бронхоэктатическая болезнь;
- пневмокониозы.
Дифференциальная диагностика позволяет точно определить заболевание. Это необходимо для назначения корректного лечения.
Методы дифференциальной диагностики бронхиальной астмы достаточно разнообразны. Для уточнения диагноза врач использует не только изучение и сопоставление симптомов. Пациенту назначаются разнообразные анализы и обследования.
В обязательном порядке пациент сдает анализы крови и мочи. При этом при бронхиальной астме будет наблюдаться повышенный уровень иммуноглобулина Е, эозинофилов и СОЭ (в период обострения).
Важное значение для дифдиагностики имеет и анализ отделяемой мокроты. В ней также будет выявлен повышенный уровень эозинофилов.
Кроме этого, пациенту назначают:
- Кожные пробы для выявления провоцирующего заболевание аллергена.
- Пикфлоуметрию для оценки скорости выдоха.
- Спирометрию для исследования функции внешнего дыхания.
- Рентгенографию легких.
На основании всех полученных результатов врач ставит пациенту диагноз и назначает лечение.
Дифференциальная диагностика бронхиальной астмы у детей зачастую затруднена из-за того, что маленький пациент не всегда может точно описать свои симптомы.
Вероятность постановки точного диагноза увеличивается, если у пациента есть родственники, страдающие БА, или были документально зафиксированы:
- случаи атопической формы дерматита;
- проявления аллергического ринита, конъюнктивита.
Но даже если такие данные отсутствуют, а у ребенка наблюдается одышка, хрипящее дыхание, сухой кашель и ощущение заложенности грудной клетки, исследования для подтверждения или исключения БА необходимы.
При постановке диагноза следует исключить:
- попадание инородного тела в дыхательные пули;
- воспаление легких и другие инфекционные заболевания;
- кистозный фиброз;
- дисплазию легких и бронхов;
- иммунную недостаточность.
После сбора всех данных, разговора с родителями и ребенком и проведенных исследования врач ставит диагноз.
Если с помощью дифференциальной диагностики врач установил диагноз «бронхиальная астма», назначается соответствующее лечение. В зависимости от тяжести заболевания и состояния пациента врач назначает лекарственную терапию, направленную на купирование симптомов.
Лечение бронхиальной астмы проводится в течение всей жизни пациента. Даже в состоянии ремиссии необходимо принимать меры по предотвращению приступов. Отказ от медикаментов может вызвать обострение болезни и развитие тяжелых осложнений.
Кроме этого, больному следует пересмотреть свой образ жизни, выделить время для полноценного сна и отдыха, отказаться от вредных привычек и начать укреплять иммунитет.
Дифференциальная диагностика бронхиальной астмы – важнейший врачебный инструмент, позволяющий точно установить диагноз. Это необходимо для максимально эффективной помощи больному.
Так как многие заболевания разных органов и систем имеют похожую симптоматику, но требуют разного лечения, врач должен провести все этапы диагностики для постановки дифдиагноза.
источник
Диагностика бронхиальной астмы у детей, особенно в раннем возрасте, представляет значительные трудности, так как периодически появляющиеся эпизоды бронхиальной обструкции могут быть проявлением самой разнообразной патологии органов дыхания. При этом следует иметь в виду, что чем меньше возраст ребенка, тем выше вероятность того, что повторяющиеся эпизоды обструктивного синдрома бронхиальной астмой не являются. Дифференциально — диагностический ряд включает большой перечень заболеваний (табл. 5.4)
Таблица 5.4. Дифференциальная диагностика бронхиальной астмы у детей
Заболевания верхних дыхательных путей
Заболевания нижних дыхательных путей
Гипертрофия аденоидов и/или тонзиллярных миндалин
Новообразования гортани и глотки
Дисфункция голосовых связок
Обструктивный бронхит вирусной и бактериальной этиологии, в том числе микоплазменной и хламидийной
Сдавление трахеи и крупных бронхов извне, в том числе аномально расположенными сосудами, объемными образованиями
Трахеобронхомаляция и другие пороки развития крупных, средних и мелких бронхов
Хронический бронхит вследствие ингаляции табачного дыма и токсичных газов
Интерстициальные заболевания легких
Иммунодефицитные состояния, протекающие с поражением легких
Синдром цилиарной дискинезии
Синдром хронической аспирации
Дифференциальная диагностика астмы зависит от возраста больного. У детей младше пяти лет эпизоды БОС встречаются очень часто и далеко не всегда являются первыми признаками астмы. Рассматривают три группы БОС. Один — преходящий, непостоянный БОС у детей младше трех лет. Это состояние чаще всего связано с курением матери во время беременности и пассивным курением после родов. Второй — постоянный, повторяющийся БОС у ребенка без проявлений атопии и с неотягощенной наследственностью по атопии — чаще связан с повторными эпизодами респираторной вирусной инфекции. Частота эпизодов снижается с возрастом, и они редко повторяются у детей старше 11 лет, 3 — повторные эпизоды БОС у ребенка с отягощенной наследственностью по аллергическим заболеваниям и с проявлениями атопии. В этом случае высока вероятность бронхиальной астмы.
Заподозрить отличное от бронхиальной астмы заболевание может помочь выявление следующих симптомов:
появление симптомов заболевания с рождения;
респираторный дистресс синдром и/или применение ИВЛ в периоде новорожденности;
неврологическая дисфункция в неонатальном периоде;
отсутствие эффекта от применения бронхолитиков и отсутствие ответа на терапию даже высокими дозами ингаляционных и пероральных глюкокортикостероидов;
свистящие хрипы, связанные с кормлением или рвотой;
затруднение глотания и/или рецидивирующая рвота;
плохая прибавка массы тела;
длительно сохраняющаяся потребность в оксигенотерапии;
по данным физикального обследования:
деформация концевых фаланг пальцев в виде «барабанных палочек»;
очаговые изменения в легких;
крепитация при аускультации;
по результатам лабораторных и инструментальных исследований:
очаговые или инфильтративные изменения на рентгенограмме органов грудной клетки;
необратимость обструкции дыхательных путей;
Следующие признаки весьма характерны для дебюта астмы:
частые эпизоды БОС (чаще одного раза в месяц);
кашель или одышка, появляющиеся при физической нагрузке;
кашель и одышка, повторяющиеся вне ОРВИ и не связанные с определенным сезоном;
эпизоды БОС, сохраняющиеся у ребенка старше 3 лет.
Сочетание эпизодов БОС у ребенка в возрасте до трех лет и одного значимого фактора риска (наследственная отягощенность по астме или атопии) или двух менее значимых (эозинофилия, эпизоды шумного дыхания вне ОРВИ, аллергический ринит) предполагают наличие у ребенка астмы и возможность сохранения симптомов заболевания в более старшем возрасте. В настоящее время нет данных, что применение глюкокортикоидов способствует предотвращению развития астмы у детей из групп риска.
У детей старше пяти лет помочь в дифференциальной диагностике может исследование функции внешнего дыхания, а также оценка реакция на терапию бронходиллятаторами, глюкокортикостероидами и элиминационные мероприятия.
источник
Под бронхообструктивным синдромом (БС) понимают совокупность клинических симптомов, отражающих нарушение проходимости бронхов вследствие сужения их просвета. БС нередко встречается у детей раннего возраста. От 30 до 50% детей первых трех
Под бронхообструктивным синдромом (БС) понимают совокупность клинических симптомов, отражающих нарушение проходимости бронхов вследствие сужения их просвета. БС нередко встречается у детей раннего возраста. От 30 до 50% детей первых трех лет жизни имеют те или иные проявления бронхообструктивного синдрома, вследствие чего проблемы дифференциальной диагностики этого состояния крайне важны.
БС — это ведущий признак, который объединяет группу острых, рецидивирующих и хронических заболеваний легких, но он не является самостоятельной нозологической формой и не может фигурировать в качестве диагноза. Следует отметить, что БС не синоним бронхоспазма, хотя во многих случаях бронхоспазм играет важную, а иногда ведущую роль в генезе заболевания. Обычно БС выявляется у детей первых четырех лет жизни, но может диагностироваться и в более старшем возрасте.
В таблице 1 указаны основные причины возникновения БС у детей.
Наиболее важное значение имеют возрастные особенности респираторной системы ребенка. Бронхи у маленьких детей имеют меньший диаметр, чем у взрослых. Слизистая трахеи и бронхов быстро реагирует отеком и гиперсекрецией слизи в ответ на развитие вирусной инфекции. Узость бронхов и всего дыхательного аппарата значительно увеличивает аэродинамическое сопротивление. Так, отек слизистой бронхов всего на 1 мм вызывает повышение сопротивления току воздуха в трахее более чем на 50% [1].
Для детей раннего возраста характерны податливость хрящей бронхиального тракта, недостаточная ригидность костной структуры грудной клетки, свободно реагирующей втяжением уступчивых мест на повышение сопротивления в воздухоносных путях, а также ряд особенностей положения и строения диафрагмы. Несомненное влияние на функциональные нарушения органов дыхания у маленького ребенка оказывают и такие факторы, как более длительный сон, частый плач, преимущественное положение лежа на спине в первые месяцы жизни.
Важную роль играет респираторная вирусная инфекция. К числу вирусов, наиболее часто вызывающих БС, относят респираторно-синцитиальный вирус (около 50%), вирус парагриппа, микоплазму пневмонии, реже — вирусы гриппа и аденовирус.
Среди факторов окружающей среды, которые могут приводить к развитию обструктивного синдрома, особо важное значение придается пассивному курению в семье. Под влиянием табачного дыма происходит гипертрофия бронхиальных слизистых желез, нарушается мукоцилиарный клиренс, замедляется продвижение слизи. Пассивное курение провоцирует деструкцию эпителия бронхов. Особенно ранимыми в этом плане считаются дети первого года жизни.
Другим важным неблагоприятным фактором является загрязнение окружающей атмосферы индустриальными газами, а также органической и неорганической пылью.
Большинство исследователей признают влияние факторов преморбидного фона на развитие БС. Это — токсикозы беременных, осложненные роды, гипоксия в родах, недоношенность, отягощенный аллергологический анамнез, гиперреактивность бронхов, рахит, дистрофия, гиперплазия тимуса, перинатальная энцефалопатия, раннее искусственное вскармливание, перенесенное респираторное заболевание в возрасте 6—12 месяцев.
В таблице 2 представлены основные нозологические формы, при которых бронхообструктивный синдром может иметь место и в значительной степени определять клиническую симптоматику болезни.
Бронхиальная астма представляет собой заболевание, проявляющееся обратимой (полностью или частично) обструкцией бронхов, патогенетическую основу которого составляют аллергическое воспаление дыхательных путей и, в большинстве случаев, гиперреактивность бронхов. Оно характеризуется в типичных случаях периодическим возникновением приступов нарушения проходимости бронхов в результате их спазма, отека слизистой оболочки бронхов и гиперсекреции слизи.
Бронхиальная астма может протекать также в виде астматического бронхита без типичных приступов, спастического кашля (в том числе ночного), астмы физического напряжения.
Критерии диагностики: приступы удушья, астматический статус, астматический бронхит, приступы спастического кашля, сопровождающиеся острым вздутием легких и затруднением выдоха. Рентгенологически во время приступа обычно определяется вздутие легких, на фоне которого нередко выявляется усиление бронхососудистого рисунка.
Под обструктивным бронхитом понимают острое поражение бронхов, сопровождающееся клиническими признаками бронхиальной обструкции. Термин «бронхиолит» используется для обозначения тех форм обструктивного бронхита, которые сопровождаются большим количеством рассеянных мелкопузырчатых хрипов, что нередко наблюдается у детей первых месяцев жизни при первом эпизоде обструктивного заболевания.
Наибольшие сложности представляет дифференциальная диагностика обструктивного бронхита и бронхиальной астмы.
До 70-х г. прошлого века термин «обструктивный бронхит» и его аналоги (астматический бронхит, спастический бронхит и др.) широко использовались педиатрами. Однако в начале 70-х гг. была проведена серия эпидемиологических исследований, которые показали, что отличить обструктивный бронхит и бронхиальную астму в широкой педиатрической практике почти невозможно. Таким образом, был поставлен знак равенства между этими состояниями. Данный подход у детей старшего возраста в значительной степени себя оправдал, так как позволил избавить многих больных от антибактериальной терапии. Но у детей младшего возраста проблема стоит сложнее. Выяснилось, что кромогликат у этих больных недостаточно эффективен или неэффективен вовсе. Ингаляционные бронходилятаторы, такие, как сальбутамол, малоэффективны или не эффективны при свистящем дыхании у детей первых трех лет жизни. Сведения относительно действенности применения ингаляционных стероидов при остром или хроническом бронхиолите оказались противоречивыми.
К тому же многочисленные исследования в нашей стране и за рубежом показали, что исходы обструктивного бронхита в целом благоприятны. 54% детей с повторными эпизодами обструктивного бронхита перестают болеть после четырех лет, а еще 37% — в более позднем возрасте; таким образом, выздоравливают более 90% пациентов. Кроме того, наличие обструктивного синдрома в первые три года жизни не может рассматриваться как фактор, предрасполагающий к возникновению астмы в дальнейшем. Т. е. выяснилось, что механизм развития свистящего дыхания у детей раннего возраста другой, чем у более старших детей, и основную роль здесь играют не гиперреактивность слизистой бронхов и спазм мышц, а тонус бронхиальной стенки и отек слизистой бронхов. Это отражало тот факт, что «свистящее дыхание» у маленьких детей является следствием различных причин, в том числе аномалий респираторной системы и воспалительных процессов иной этиологии.
Значит ли это, что у малышей не бывает астмы? По-видимому, нет, так как примерно у 10% больных, у которых на фоне вирусной инфекции отмечался БС, в дальнейшем могли развиваться симптомы астмы. Рецидивы обструкции обусловлены наследственной отягощенностью по аллергии и аллергическими реакциями у ребенка и не связаны с кожными тестами и уровнем IgE. Таким образом, можно утверждать, что обструктивный бронхит, как нозологическая форма, существует. Его основные отличия от астмы представлены в таблице 3.
 |
| Таблица 3. Дифференциальная диагностика бронхиальной астмы и обструктивного бронхита. |
Дифференциальную диагностику обструктивного бронхита и острой пневмонии облегчает тот факт, что при пневмонии, вызванной основными возбудителями, как правило, не наблюдается обструкции. Сопровождаться обструкцией могут, в основном, внутрибольничные пневмонии, обусловленные некоторыми грамотрицательными возбудителями кишечной группы (см. таблицу 4).
 |
| Таблица 4. Дифференциальная диагностика обструктивного бронхита и острой пневмонии. |
Одна из наиболее распространенных причин развития БС у грудных детей — синдром привычной микроаспирации жидкой пищи, связанный с дисфагией, часто в сочетании с желудочно-пищеводным рефлюксом. До 30% всех случаев рецидивирующего кашля у детей раннего возраста связаны с аспирационным синдромом. Выяснить причину бывает сложно. В диагностике аспирации помогают данные анамнеза, обычно у этих детей имеется отягощенный неврологический анамнез и такие признаки, как приступообразный кашель, развивающийся у ребенка во время кормления, появление сухих или влажных хрипов в легких после еды. Подтверждается диагноз при обследовании в стационаре.
До 50% всех аспираций инородных тел вовремя не выявляется. Поздняя диагностика связана с тем, что после аспирации у ребенка на фоне полного здоровья, без катаральных явлений, возникает острый приступ кашля, затем, если инородное тело проникает глубже, через несколько дней появляются симптомы обструктивного бронхита или пневмонии с обструктивным синдромом, имеющих затяжное, трудно поддающееся терапии течение.
В диагностике помогают анамнез, рентгенологическое исследование и бронхоскопия.
Критерии диагностики: продуктивный кашель, постоянные разнокалиберные влажные хрипы в легких (в течение нескольких месяцев) при наличии двух-трех обострений заболеваний в год на протяжении двух лет.
У взрослых основные причины ХБ — это курение и профессиональные вредности. Причем у половины больных это заболевание протекает с признаками бронхообструктивного синдрома. В детском возрасте первичный хронический бронхит — большая редкость. В большинстве случаев он является следствием других причин (пороков развития легких, иммунодефицитных состояний и др.), т. е. является «вторичным». Поэтому диагноз «первичный хронический бронхит» может ставиться только после тщательной дифференциальной диагностики.
Хроническая пневмония представляет собой хронический воспалительный неспецифический процесс, имеющий в своей основе необратимые морфологические изменения в виде деформации бронхов и пневмосклероза в одном или нескольких сегментах и сопровождающийся рецидивами воспаления в бронхах и легочной ткани. Хроническая пневмония чаще всего развивается как результат неполного излечения острой пневмонии, ателектаза, а также вследствие попадания инородного тела в бронхи.
Особенностью этого заболевания в настоящее время является его благоприятное течение и высокая частота сопутствующего бронхообструктивного синдрома (30—35%). Диагностика этой болезни основывается на клинической симптоматике, рентгенологических и бронхологических данных и осуществляется в специализированном стационаре.
Заболевание, развивающееся вследствие острого облитерирующего бронхиолита, морфологическим субстратом которого является облитерация бронхиол и артериол одного или нескольких участков легких, приводящая к нарушению легочного кровотока и развитию эмфиземы. Синдром одностороннего сверхпрозрачного легкого (синдром МакЛеода) представляет собой частный случай данного заболевания.
Клинически проявляется одышкой и другими признаками дыхательной недостаточности разной степени выраженности, локальными физикальными данными в виде стойкой крепитации и мелкопузырчатых хрипов. У детей старшего возраста может сопровождаться бронхообструктивным синдромом, имеющим торпидное, плохо поддающееся лечению бронходилятаторами течение.
При наличии клинических данных и рентгенологических признаков сверхпрозрачности сцинтиграфически определяется резкое снижение легочного кровотока в пораженных отделах легких.
Заболевание проявляется рецидивирующими синуситами и отитами и хроническим поражением легких — это хронический бронхит с образованием бронхоэктазов. Типичное проявление этой болезни — синдром Картагенера, когда у пациента имеет место еще и обратное расположение внутренних органов. В основе синдрома лежит врожденный дефект цилиарного эпителия, приводящий к дисфункции мукоцилиарного транспорта и застою секрета в бронхах. Почти у всех больных могут отмечаться эпизоды приступообразного кашля, одышки.
Дифференциальная диагностика основывается на обратном расположении внутренних органов, рентгенологических данных и исследовании функции цилиарного эпителия.
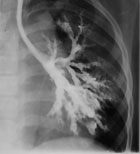 |
| Рисунок 1. Бронхограмма левого легкого ребенка с синдромом Вильямса-Кемпбелла. |
Из этой многочисленной группы заболеваний наибольший интерес представляют пороки развития трахеи и бронхов. Недоразвитие хрящей трахеи и \или бронхов приводит к тому, что бронхи спадаются на выдохе, обуславливая поведение симптоматики БС. Первые клинические проявления заболевания возникают на первом году жизни — это либо повторные обструктивные бронхиты, либо пневмонии. В дальнейшем формируется деформация грудной клетки, появляется влажный постоянный кашель, выслушиваются влажные и сухие хрипы в легких. Диагноз обычно ставится в младшем или старшем школьном возрасте, когда клиническая симптоматика ярко выражена. В дифференциальной диагностике, наряду с клинической симптоматикой, важны рентгенологическое исследование и бронхоскопия, а также резистентность к бронходилятаторам и высокая эффективность антибактериальной терапии. На рисунке показана бронхограмма больного с недоразвитием хрящей бронхов 3—8 генерации (синдром Вильямса-Кемпбелла). Хорошо видно чрезмерное расширение бронхов в зоне поражения.
Стенозы трахеи и бронхов — это состояние, встречающееся достаточно редко. Их отличает постоянное шумное дыхание у ребенка и на вдохе и на выдохе, усиливающееся при присоединении ОРВИ. Диагноз подтверждается при рентгенологическом и бронхологическом обследовании.
Опухоли трахеи и бронхов у детей также диагностируются нечасто. Опухоли могут приводить к сужению просвета дыхательных путей как при сдавлении извне, так и при прорастании внутрь просвета. Помочь в диагностике может постепенное нарастание синдрома «шумного дыхания», которое вначале появляется при ОРВИ, а затем и в состоянии покоя.
Диагноз подтверждается при рентгенологическом и бронхологическом обследовании.
Муковисцидоз (МВ) — генетическое, аутосомно-рецессивное моногенное заболевание, обусловленное мутацией гена трансмембранного регулятора МВ (МВТР). Характеризуется нарушением секреции экзокринных желез жизненно важных органов с поражением, прежде всего, дыхательного и желудочно-кишечного трактов, тяжелым течением и неблагоприятным прогнозом. Особенность клинических проявлений болезни заключается в приступообразном коклюшеподобном кашле с вязкой мокротой, вследствие чего иногда путают с бронхиальной астмой.
Дифференциальная диагностика: наличие кишечного синдрома (нейтральный жир в стуле), прогрессирующая дыхательная недостаточность, изменения на рентгенограммах и положительный потовый тест.
Хроническое заболевание, развивающееся вследствие поражения легких при проведении жестких режимов искусственной вентиляции легких с высокими концентрациями кислорода, главным образом у недоношенных детей. В основе заболевания лежат нарушение архитектоники легочной ткани и, часто, бронхиальная гиперреактивность. Клинически проявляется гипоксемией, дыхательной недостаточностью, симптомами бронхиальной обструкции; рентгенологически обычно выявляются грубые изменения в виде фиброза, кист, изменений прозрачности легочной ткани, деформаций бронхов. Диагностика осуществляется на основании анамнестических, клинических и рентгенологических данных.
Внелегочные причины БС диагностируются при обследовании больного в стационаре.
Таким образом, БС нередко сопровождает легочные и внелегочные патологические процессы. Дифференциальная диагностика при этих состояниях включает ряд нозологических форм. При затяжном течении БС, а также при повторных эпизодах обструкции больной должен быть обследован в специализированном пульмонологическом стационаре и наблюдаться там в дальнейшем.
- От 30 до 50% детей первых трех лет жизни имеют те или иные проявления бронхообструктивного синдрома.
- числу вирусов, наиболее часто вызывающих БС, относят респираторно-синцитиальный вирус, вирус парагриппа, микоплазму пневмонии, реже — вирусы гриппа и аденовирус.
- Наибольшие сложности представляет дифференциальная диагностика обструктивного бронхита и бронхиальной астмы.
И. К. Волков, доктор медицинских наук
Отд. пульмонологии НИИ педиатрии, Научный центр здоровья детей РАМН, Москва
источник
С какими заболеваниями необходимо дифференцировать тяжелую БА? Какие дополнительные методы исследования помогают в постановке диагноза? В 1999 году Европейским респираторным обществом был разработан документ, озаглавленный «Тяжелая/терапевтически рези
С какими заболеваниями необходимо дифференцировать тяжелую БА?
Какие дополнительные методы исследования помогают в постановке диагноза?
В 1999 году Европейским респираторным обществом был разработан документ, озаглавленный «Тяжелая/терапевтически резистентная астма» [4]. Год спустя Американская торакальная ассоциация стала инициатором создания «Протоколов о рефрактерной астме» [8]. Согласно принятым документам, тяжелой астмой страдают больные, имеющие стероид-зависимую и/или стероид-резистентную астму, трудноконтролируемую астму, фатальную или близкофатальную астму, тяжелую хроническую астму, острую тяжелую астму, астматическое состояние.
Эксперты Европейского респираторного общества дают следующее определение тяжелой/терапевтически резистентной астмы: недостаточно контролируемое состояние (эпизодические обострения, персистирующая и варьирующая обструкция дыхательных путей, постоянная потребность в β2-агонистах короткого действия), несмотря на применение адекватной дозы глюкокортикостероидов (Гк). Адекватной дозой для детей считаются 800 мкг беклометазона или 400 мкг флютиказона пропионата, при приеме которых на протяжении 6 месяцев должен быть достигнут контроль над течением астмы; в противном случае таких больных следует считать терапевтически резистентными [4].
Распространенность тяжелой бронхиальной астмы (БА) среди детей составляет 1:1000, причем болеют в основном дети старше 10 лет. К факторам риска развития тяжелой БА относят действие триггеров (табачный дым, экспозиция аллергенов, вирусная инфекция, поллютанты, стресс), отсутствие комплаентности (приверженности к терапии), наличие сопутствующих заболеваний [4, 8].
Диагноз тяжелой формы БА требует точного клинико-лабораторного подтверждения (табл. 1) [8].
Особую сложность представляет выявление БА у детей до 3 лет, поскольку клинические симптомы заболевания могут быть нетипичными, а исследование функции легких у детей до 5 лет затруднено.
Дифференциальная диагностика тяжелой БА у детей затруднена из-за наличия широкого круга заболеваний, которые могут вызывать сходную клиническую симптоматику; в подобных случаях следует проводить более полное обследование пациентов.
Эксперты Европейского респираторного общества рекомендуют проводить у детей с тяжелой БА дифференциальную диагностику со следующими заболеваниями (табл. 2) [4].
Прежде всего, следует убедиться в правильности диагноза БА. Анамнестические данные: наследственная отягощенность атопическими заболеваниями, наличие симптомов аллергических заболеваний у ребенка (аллергический ринит, атопический дерматит, поллиноз, пищевая, лекарственная аллергия), эпизоды свистящего дыхания, длительного кашля, затруднения дыхания (диспноэ), уменьшающиеся после ингаляции бронходилатирующими препаратами, а также эффективность антиастматической терапии — свидетельствуют о возможном наличии БА.
Эпизоды обострения БА в виде типичных приступов экспираторного удушья, приступов кашля или персистирующего свистящего дыхания, особенно у детей до 3 лет, связаны чаще всего с ОРВИ и потому могут сопровождаться повышением температуры тела и интоксикацией. С возрастом увеличивается роль триггерных факторов (физической и эмоциональной нагрузки, курения, поллютантов), частота и тяжесть астматических приступов у детей могут прогрессировать.
Обратимость бронхиальной обструкции у детей старше 5 лет подтверждается исследованием функциональных параметров легких после ингалирования β2-агониста (прирост объема форсированного выдоха за 1 с — ОФВ1 — по крайней мере на 12%). Диагноз БА, особенно в случае кашлевого варианта заболевания, подтверждает также позитивный бронхопровокационный тест гистамином (PC20 20%), данные аллергопроб.
Тяжелая БА у детей, как и у взрослых, протекает с частыми обострениями заболевания, выраженным снижением функциональных показателей легких и качества жизни больных (табл. 3) [9].
В связи с неоднократными эпизодами бронхиальной обструкции (чаще в ночное время) таким пациентам врачи неоднократно назначают системные Гк или ингаляционные (иГк) в высоких дозах.
До введения в клиническую практику иГк ранее широко практиковалось назначение системных стероидов продолжительным курсом. В таких случаях БА может сопровождаться симптоматикой синдрома Иценко-Кушинга.
Среди тяжелых астматиков особую сложность представляет лечение так называемых стероид-резистентных больных. Основной критерий постановки диагноза стероид-резистентной астмы — неэффективность преднизолона, назначенного 7-14-дневным курсом перорально (в дозе 40 мг в сутки для взрослых и 2 мг/кг массы в сутки для детей), обусловленная отсутствием прироста ОФВ1 более чем на 15% от исходных показателей [2].
У большинства взрослых больных со стероид-резистентной БА исходно низкий уровень ОФВ1( 60 мэкв/л). При нормальном уровне хлоридов проводят измерение назального трансэпителиального напряжения или генотипирование.
Бронхолегочная форма муковисцидоза может ошибочно приниматься за бронхиальную астму, рефрактерную к традиционной терапии, и, напротив, БА может быть одним из клинико-патологических проявлений поражения респираторного тракта у больных муковисцидозом. В России среди пациентов, страдающих БА, муковисцидоз выявляется в 1-2% случаев [1].
Рентгенографически определяется типичная картина резкого усиления и деформации легочного рисунка в виде линейных и округлых теней, узелково-кистозных изменений, участков ограниченного пневмосклероза; при обострении появляется характерная картина пневмонии, ателектаза, пневмоторакса, абсцесса и т. д.
Дефицит иммуноглобулинов следует подозревать у детей с тяжелыми рецидивирующими или персистирующими инфекциями в анамнезе. Уже в раннем возрасте такие дети переносят серьезные инфекции (менингит, сепсис, генерализованный дерматит), нередко с присоединением гнойных осложнений (пиопневмоторакса, абсцедирующей пневмонии, плеврита, септикопиемии), хронической пневмонии. Пневмосклероз носит полисегментарный характер, рано развиваются бронхоэктазы. В легких выслушиваются рассеянные влажные мелко- и среднепузырчатые хрипы на фоне ослабленного дыхания. Обострения бронхолегочного процесса наблюдаются 4-6 раз в год. У ребенка рано формируются ногти в виде «часовых стекол» и «барабанных палочек». Наряду с бронхолегочной патологией у больных иммунодефицитом выявляют множественные очаги хронической гнойной инфекции (отит, гайморит, пиодермию, фурункулез), упорную диспепсию, резкое отставание в физическом развитии [1].
У таких детей повышен уровень Ig M (и Ig D) или отмечается селективный иммунодефицит Ig А, Ig М, Ig D. При изолированном иммунодефиците респираторные заболевания протекают с менее выраженными симптомами, уже первая пневмония заканчивается развитием ателектатического пневмосклероза, обострения иногда носят астматический характер. Лица с дефицитом Ig А чаще подвержены респираторной инфекции, БА и другим атопическим заболеваниям. Распространенность дефицита Ig А среди детей с атопией в 20-40 раз выше, чем среди здоровых детей. Больные с дефицитом Ig А имеют нормальный или повышенный уровень Ig Е и нередко страдают рецидивирующими инфекциями придаточных пазух носа, бронхов и легких.
Бронхи рентгенографически имеют стойкие изменения в виде деформации, обтурированы гноем.
Диагноз иммунодефицита устанавливают по результатам иммунологического исследования: выявляют резкое снижение или нарушение соотношения основных классов иммуноглобулинов, стойкое снижение показателей клеточного иммунитета, нарушение фагоцитоза, отсутствие ответа иммунной системы на интеркуррентные заболевания и обострения воспаления в легких.
Таким образом, при повторных приступах кашля и свистящего дыхания, связанных с бактериальными инфекциями, ребенка необходимо обследовать для выявления, прежде всего, муковисцидоза и иммунодефицитного состояния.
Первичную цилиарную дискинезию следует заподозрить у детей, имеющих с раннего возраста в анамнезе повторные заболевания верхних дыхательных путей и пневмонии, трудно поддающиеся терапии, а также поражения носоглотки (рецидивирующий риносинусит, аденоидит), деформацию грудной клетки, изменения концевых фаланг пальцев. Рентгенография легких чаще выявляет двусторонний пневмосклероз с деформацией бронхов. Цилиарная дискинезия в отсутствие обратного расположения органов также проявляется повторными бронхитами и пневмонией, развитием хронического бронхита, при этом у многих таких больных грубая патология легких отсутствует (очевидно, из-за меньшей дисфункции ресничек, чем при синдроме Картагенера) [1]. Диагноз подтверждают электронная микроскопия биоптата слизистой оболочки носа или бронхов, а также исследование подвижности ресничек в фазово-контрастном микроскопе.
В качестве скрининга используют сахариновый тест (оценка времени перемещения крупинки сахарина, помещенной на слизистую носа, до носоглотки — испытуемый отмечает появление сладкого вкуса: в норме — не более 30 мин, при цилиарной дискинезии — намного дольше) [1].
Итак, для постановки клинического диагноза ребенку с тяжелой БА следует:
- выяснить, действительно ли у больного имеется БА; для этого необходимо исследовать функцию легких и определить соотношение ОФВ1/ЖЕЛ, в таких случаях оно
источник
Диагноз «бронхиальная астма» (БА) у детей раннего возраста является клинико-анамнестическим, так как не все существующие методы лабораторной и функциональной диагностики могут использоваться в практике врача-педиатра либо в связи с их дороговизной и трудоемкостью, либо вследствие возрастных ограничений [1-3]. Особенности течения БА у детей дошкольного возраста и отсутствие специфических методов диагностики приводят к определенным трудностям у врачей первичного звена здравоохранения при постановке диагноза [1; 4; 5]. Популяционные исследования, которые регулярно проводятся в мире, демонстрируют, что, несмотря на существующий прогресс в изучении и ведении бронхиальной астмы, все еще сохраняется гиподиагностика этого заболевания у детей раннего возраста [1; 4; 6]. Основные трудности возникают при дифференциальной диагностике острого обструктивного бронхита (ООБ) и БА, особенно при первых их проявлениях [1; 7]. Вирусная инфекция является как этиологическим фактором ООБ, так и самым частым триггером БА у детей дошкольного возраста. И в том и в другом случае развивается синдром бронхиальной обструкции, который у детей этой возрастной группы имеет схожие клинические проявления, одинаковые рентгенологические, функциональные и лабораторные изменения [1; 7; 8]. Также обращает на себя внимание субъективность оценки ряда клинических параметров (тяжесть течения обструктивного синдрома, ответ на терапию), отданных на откуп врачу, который на своем рабочем месте, ограниченный временем приема, должен решать как «более» или «менее» выражен тот или иной симптом. В результате практически ни один из этих показателей не может служить достоверным дифференциально-диагностическим критерием ООБ и БА. Заболевание не диагностируется, больные не получают своевременно базисную терапию, что приводит к снижению качества жизни, образования и может приводить к росту инвалидизации от БА. Необходимость разработки новых диагностических критериев позволила нам более десяти лет назад модифицировать и внедрить в алгоритм диагностики бронхиальной астмы у детей раннего возраста метод индуцированной мокроты (ИМ) [9]. В детской практике методы оценки воспаления слизистой оболочки дыхательных путей должны быть простыми, неинвазивными, дающими возможность многократного проведения с отсутствием противопоказаний, ограничений и возможных осложнений. Многие методы являются трудоемкими, устаревшими, не информативными, сложными, инвазивными, очень дорогостоящими и не могут претендовать на роль релевантных. Метод индуцированной мокроты, «пришедший» в педиатрию из взрослой службы, является безопасной процедурой, которая обеспечивает многофункциональной информацией о воспалительном процессе на уровне слизистой оболочки бронхиального дерева, в частности по эозинофильному воспалению, его динамике на фоне лечения, т.е. может являться средством лабораторной диагностики и мониторирования БА во время лечения [9-11].
Цель исследования. Оценить эффективность определения уровня эозинофилов индуцированной мокроты как дополнительного диагностического критерия бронхиальной астмы.
Материалы и методы. Когортное исследование уровня эозинофилов индуцированной мокроты проводилось в течение 10 лет, под наблюдением находилась группа 75 детей в возрасте от 1 года до 5 лет (средний возраст 2,8±1,2 года.) с ООБ в анамнезе, сформированная методом случайной выборки из детей, перенесших один и более эпизодов острого обструктивного бронхита, обратившихся на прием к врачу-аллергологу с целью обследования для исключения бронхиальной астмы. На всех детей была заполнена персональная анкета, содержащая данные анамнеза, объективного осмотра и результаты проведенных исследований. Всем респондентам в декретированные сроки был проведен цитологический анализ назального секрета, индуцированной мокроты, исследование уровня общего IgE крови, уровня эозинофилов крови. Для получения мокроты с целью ее цитологического анализа проводили процедуру индукции мокроты [9; 11; 12]. В данном исследовании за диагностически значимый уровень эозинофилов индуцированной мокроты принят показатель ≥ 5%. Из исследования исключались пациенты с подтвержденной паразитарной инфекцией.
Исследование проводили поэтапно. Повторное обследование детей проведено через 18 месяцев и через 10 лет от начала исследования. По окончании наблюдения пациенты были разделены на две группы. Первая группа (n=46) – дети, у которых бронхиальная астма не сформировалась за время исследования. Вторая группа (n=29) – дети со сформировавшейся бронхиальной астмой.
Статистический анализ полученных результатов проводился при помощи пакетов статистических программ STATISTICA 6.0 (StatSoft, 2001) и SPSS 12.0. Для описания количественных признаков в выборке рассчитывались медиана и квартили (Ме; 25-75%). Для сравнительного анализа данных в двух зависимых группах при распределении количественных признаков, отличных от нормального, использовался критерий Вилкоксона. С целью оценки клинической информативности диагностических тестов проводился ROC-анализ и анализ четырехпольной таблицы для оценки чувствительности и специфичности диагностического критерия. Для всех видов анализа статистически достоверными считались значения p 0,05). У детей второй группы уровень эозинофилов ИМ был изначально высоким — 6,0 (2,4-17,0), и отмечался его статистически значимый рост в динамике через 18 месяцев наблюдения – 12,0 (4,0 — 22,0) (рwilc. 1,0-0,9 – отличное, 0,9-0,8 – очень хорошее, 0,8-0,7 – хорошее, 0,7-0,6 – среднее, 0,6-0,5 – метод неинформативен. Таким образом, чем больше эта площадь, тем эффективнее метод диагностики. В данном исследовании AUC-ROC (рис. 1) площадь под кривой равна 0,944, что говорит о высокой диагностической эффективности этого метода – 94,4%. В аналогичных исследованиях с участием детей старше 5 лет и взрослых было продемонстрировано, что процент эозинофилов в мокроте является наиболее чувствительным и специфичным маркером в сравнении с эозинофилией крови и уровнем общего IgE крови при БА [12-14].
Для того чтобы была возможность сравнить чувствительность и специфичность использующихся в настоящее время показателей для диагностики БА, было проведено построение ROC-кривой по другим диагностическим тестам. Построены ROC-кривые диагностики по уровню эозинофилов ОАК (%) и общему IgE крови (МЕ/мл). Эти показатели были использованы, так как они являются лабораторными критериями, отражающими наличие аллергии и/или атопии, и используются врачами педиатрами и аллергологами при постановке диагноза БА (рис. 2, 3).
Рис. 1. ROC-кривая диагностической эффективности уровня эозинофилов индуцированной мокроты (AUC-ROC 0,944)
Рис. 2. ROC-кривая диагностической эффективности уровня эозинофилов в общем анализе крови (AUC-ROC 0,61)
Рис. 3. ROC-кривая диагностической эффективности уровня общего IgE крови
Таким образом, полученные результаты помогут врачу определиться с количественной оценкой такого критерия, как уровень эозинофилов мокроты, так как даже в пятом пересмотре Национальной программы «Бронхиальная астма у детей. Стратегия лечения и профилактика» (2017) говорится о качественной оценке этого показателя: «у детей с БА средний уровень эозинофилов в индуцированной мокроте достоверно выше и превышает показатели у здоровых». В то же время что такое средний уровень и его количественное отображение не приводится. По данным этого исследования установлено, что уровень эозинофилов ИМ ≥5% является чувствительным и специфичным маркером и поэтому рекомендован для диагностики БА у детей.
источник
Важным отличием бронхиальной астмы от других хронических заболеваний бронхолёгочной системы является обратимость обструкции. Она не имеет неуклонно прогрессирующего течения, а характеризуется изменчивостью.
Дифференциальная диагностика БА у детей
Аспирация пищей или расстройства питания
Врожденные пороки развития бронхолегочной системы
Дискенезия ресничатого эпителия
Показания к госпитализации:
- · Тяжелое обострение астмы (астматический статус).
- · Отсутствие эффекта от проводимой терапии в течение часа.
- · В анамнезе: недавняя госпитализация или тяжёлые приступы астмы.
- · Неблагоприятные социально-бытовые и материальные условия в семье, в том числе невозможность прекращения контакта с причинно-значимым аллергеном в быту.
Лечение обострения астмы в стационаре
- 1. Кислородотерапия. Оксигенотерапия проводится для поддержания адекватного уровня газов крови.
- 2. Ингаляционные в2-агонисты короткого действия по 2 вдоха (2-3 нажатия) повторяющихся каждые 20 мин. в течение часа соответственно клиническому ответу.
- 3.Комбинированные ингаляционные бронходилятаторы — беродуал (раствор для небулайзерной терапии): для детей до 6 лет разовая доза не более 10 капель, до 4-х раз в сутки, детям старше 6 лет — разовая доза10-20 капель, до 4-х раз в сутки (1 мл беродуала содержит 20 капель)
- 4.Если ребёнок в состоянии глотать дайте преднизолон перорально из расчета 0,5 — 1мг/кг. Если ребёнок не может глотать кортикостероид следует ввести в/в или в/м в дозе 1-2 мг/кг. Как только больной сможет принимать препараты внутрь, дайте преднизолон в табл. 0,5 — 1мг/кг в течение 3 дней с последующей одномоментной отменой.
При необходимости длительность курса должна увеличиваться до стабилизации состояния. Затем следует назначить базисную терапию ИГКС.
- 5. При неэффективности терапии вышеизложенными мероприятиями, необходимо ввести препараты второго ряда — аминофиллин (под контролем ЭКГ). Введите в/в начальную дозу 5-6 мг/кг, а затем поддерживающую дозу 3 мг/кг через каждые 6 ч. Начальная доза вводится медленно в течение 30 мин, предпочтительнее в течение 1 ч. Аминофиллин в/в может быть опасным при превышении дозы или слишком быстром введении препарата. Пропустите начальную дозу препарата, если ребенок получал аминофиллин в предыдущие 24 ч. При появлении рвоты, учащении пульса, возникновении головной боли или судорог немедленно прекратите введение препарата.
- 6. Антибиотики назначают детям только при наличии бактериальной инфекции.
- 7. Убедитесь в том, что ребёнок получает ежедневно необходимый объем жидкости, избегайте гипергидратации.
При бесконтрольном применении в2-агонистов короткого действия происходит усиление признаков бронхиальной гиперреактивности, что сопровождается более тяжелым течением заболевания.
Показания к госпитализации в ОРИТ
- 1. Больные с тяжёлым обострением астмы и отсутствием положительного эффекта от начальной терапии в течение 3-х часов.
- 2. Больные с обострением астмы, угрожающим жизни (астматический статус).
Критерии перевода из ОРИТ в соматическое отделение
- 1. Полное купирование астматического статуса
- 2. Улучшение состояние больного (клинических симптомов, ПСВ, SAO2).
Купирования обострения астмы у детей в амбулаторных условиях
- 1.- ингаляционные в2-агонисты короткого действия по 2-4 вдоха детям до 5 лет повторяющихся каждые 20 мин. в течение часа соответственно клиническому ответу. Если применение ингаляционного в2-агониста быстрого действия полностью купирует приступ (для детей старше 5 лет ПСВ возвращается к значению, превышающему 80% от должной или наилучшей индивидуальной величины), и это улучшение сохраняется в течение 3-4 ч, то необходимость в дополнительных лекарственных препаратах отсутствует.
- 2. Если состояние ребёнка не улучшается:
- — ребёнка следует госпитализировать (особенно детей до 5 лет);
- — перед госпитализацией рекомендуется дать ребёнку преднизолон перорально из расчета 0,5 — 1 мг/кг;
- — если ребёнок не может глотать кортикостероид следует ввести в/м или в/в в дозе 1-2 мг/кг.
В случае невозможности госпитализации ребёнка, необходимо продолжить лечение кортикостероидами (0,5 — 1 мг/кг/с) в течение 3-х дней.
При необходимости длительность курса должна увеличиваться до стабилизации состояния.
Раннее использование стероидов при обострении астмы уменьшает необходимость в госпитализации и предупреждает рецидивирование симптомов.
3. После купирования приступов астмы (снижение потребности в в2-агонистах быстрого действия и увеличение ПСВ) назначается базисная терапия ИГКС.
Терапия, направленная на достижение контроля БА.
Лечение бронхиальной астмы подразделяется на 5 ступеней в зависимости от объема терапии. На каждой последующей ступени объем терапии увеличивается.
Так, если текущая терапия не обеспечивает контроля над БА, необходимо увеличивать объем терапии (переход на более высокую ступень) до достижения контроля.
У больных с персистирующей бронхиальной астмой, ранее не получавших поддерживающей терапии, следует начинать лечение со ступени 2, а в случае наличия выраженных симптомов бронхиальной астмы (при неконтролируемой астме) — со ступени 3.
В случае сохранения контроля над симптомами БА в течение 3 месяцев и более возможно уменьшение объема поддерживающей терапии.
В случае достижения частичного контроля над симптомами БА следует рассмотреть возможность увеличения объема терапии (т.е. увеличение доз или добавление других препаратов) с учетом их безопасности, доступности и удовлетворенности пациента (таблица 6).
Ступенчатая терапия БА для детей
Варианты поддерживающей терапии
Контролируемая астма. Легкая интермитирующая астма.
Ингаляционный в2-агонист по требованию.
Начинают при частично контролируемой астме. Легкая персистирующая астма.
Выбрать один из вариантов лечения:
- · Низкие дозы ИГКС или
- · Антилейкотриеновый препарат
Начинают при неконтролируемой астме. Среднетяжелая астма.
Выбрать один из вариантов лечения
- · Низкие дозы ИГКС + в2-агонист длительного действия или
- · Средние или высокие дозы ИГКС или
- · Низкие дозы ИГКС + антилейкотриеновый препарат или
- · Низкие дозы ИГКС + теофиллин пролонгированного действия
Если эффект не достигается на ступени 3, то добавить один или более:
- · Средние или высокие дозы ИГКС + в2-агонист длительного действия и/или
- · Антилейкотриеновый препарат и/или
- · Теофиллин пролонгированного действия
Тяжелая неконтролируемая астма.
Если эффект не достигается на ступени 4, то добавить:
· Минимальная доза перорального глюкокортикостероида
*Примечание: ИГКС в комбинации с в2-агонистами длительного действия назначаются детям с 4-х лет
Рассчитанные эквипотентные суточные дозы (мкг) ИГКС для детей старше 5 лет (мкг)
источник