
БА — хроническое воспалительное заболевание дыхательных путей, характеризующееся обратимой бронхиальной обструкцией и гиперреактивностью бронхов. Воспалительная природа заболевания, связанная с воздействием специфических и неспецифических факторов, проявляется в морфологических изменениях стенки бронхов — инфильтрации клеточными элементами, прежде всего эозинофилами, дисфункции ресничек мирнательного эпителия, деструкции эпителиальных клеток, вплоть до десквамации, дезорганизации основного вещества, гиперплазии и гипертрофии слизистых желез и бокаловидных клеток. В воспалительном процессе участвуют также другие клеточные элементы, в том числе тучные клетки, лимфоциты, макрофаги. Длительное течение воспаления приводит к необратимым морфофункциональным изменениям, характеризующимся резким утолщением базальной мембраны с нарушением микроциркуляции, и склерозу стенки бронхов.
Описанные изменения приводят к формированию бронхообструктивного синдрома, обусловленного бронхоконстрикцией, отеком слизистой, дискринией и склеротическими изменениями. В зависимости от этиологического фактора заболевания, тяжести течения и этапа болезни может преобладать тот или иной компонент бронхиальной обструкции. Основным патофизиологическим признаком считается гиперреактивность бронхов, являющаяся следствием воспалительного процесса в бронхиальной стенке и определяемая как повышенная чувствительность дыхательных путей к стимулам, индифферентным для здоровых лиц. Под специфической гиперреактивностью бронхов понимают повышенную чувствительность бронхиального дерева к определенным аллергенам, поднеспецифической — к разнообразным стимулам неаллергенной природы.
БА может быть классифицирована по этиологии и степени тяжести. До настоящего времени отсутствует единая мировая классификация БА по этиологическому фактору, однако большинство исследователей выделяют БА атоническую (экзогенную, аллергическую, иммунологическую) и неатопическую (эндогенную, неиммунологическую). Под атопическим механизмом развития болезни подразумевают иммунологическую реакцию, опосредуемую специфическим IgЕ. V детей этот механизм развития болезни является основным. Показано, что атония может наследоваться более чем в 30% случаев. Под неатопическим вариантом подразумевают заболевание, не имеющее механизма аллергической сенсибилизации. При этой форме болезни пусковыми агентами могут выступать респираторные инфекции, нарушения метаболизма арахидоновой кислоты, эндокринные и нервно-психические расстройства, нарушения рецепторного баланса и электролитного гомеостаза дыхательных путей, профессиональные факторы и аэрополлютанты неаллергеннои природы. Следует отметить, что, несмотря на очевидность причинной роли большинства этиологических агентов неатопической БА, механизмы формирования этой формы заболевания не до конца изучены. В последние годы особое значение в формировании неаллергической БА придается загрязнению атмосферы продуктами урбанизационной деятельности человека, в том числе диоксидам азота и серы, озону.
По степени тяжести Б А классифицируют на легкое, среднетяжелое и тяжелое заболевание. Тяжесть течения определяется врачом на основании комплекса клинических и функциональных признаков, включающих в себя частоту, тяжесть и продолжительность приступов экспираторного диспноэ, а также состояние больного в периоды, свободные от приступов. Степень тяжести течения заболевания может быть характеризована следующими критериями. При легкой степени тяжести течение заболевания обычно характеризуется отсутствием классических развернутых приступов удушья, симптомы отмечаются реже 1-2 раз в неделю и кратковременны. Ночной сон пациентов характеризуется пробуждением от респираторного дискомфорта реже 1-2 раз в месяц. В межсимптомный период состояние больных стабильное. Оценка функциональных показателей для определ ения тяжести заболевания проводится в период отсутствия эпизодов экспираторного диспноэ. ПОСвыд или ОФВ1> 80% от должных ёеличин, суточный разброс показателей менее 20%. Исследуемые показатели принимают нормальные должные значения после ингаляции бронходилататоров.
источник
А.Н. Цой 1 , В.В. Архипов 1 , А.Г. Чучалин 2
1 — ММА им. И.М. Сеченова, г. Москва
2 — НИИ Пульмонологии МЗ РФ, г. Москва
Выбор источников достоверной информации имеет решающее значение для эффективной медицинской деятельности на всех ее уровнях. Качество имеющейся в распоряжении специалиста информации особенно важно при принятии решения относительно каждого конкретного клинического случая, при создании медицинских стандартов и формуляров, а также общем планировании деятельности здравоохранения [12]. Предложенная в начале 90-х гг. концепция доказательной медицины подразумевает добросовестное, точное и осмысленное использование лучших результатов клинических исследований для выбора лечения конкретного больного [2]. Подобный подход позволяет уменьшить уровень врачебных ошибок, облегчить процесс принятия решения для практических врачей, администрации лечебных учреждений и юристов, а также снизить расходы на здравоохранение и претворять в жизнь крупные социально-ориентированные медицинские проекты и инициативы [2].
Прошло почти 10 лет после появления первого международного руководства по диагностике и лечению бронхиальной астмы (БА) [I]. Российские врачи уже в 1996 г. имели возможность познакомиться с этим документом и применять его в своей практике. Имеется опыт создания аналогичных стандартов по лечению БА, ориентированных на отечественные условия и особенности системы здравоохранения в нашей стране [4]. Можно констатировать, что работа с подобными руководствами заставляет нас во многом пересмотреть вопросы обучения и самообразования практических специалистов, стимулирует отказ от рутинных и недостаточно эффективных методов диагностики и лечения и, в конечном счете, повышает уровень медицинской помощи больным БА.
Стандарты и протоколы по клинической практике предназначены, главным образом, для врачей широкого профиля (терапевты поликлиник и стационаров, врачи скорой помощи) и посвящены наиболее общим вопросам диагностики и лечения. Поэтому для этих руководств характерны строго ограниченный объем теоретических сведений и отсутствие описаний редких форм заболевания и новых экспериментальных методов лечения. Но благодаря этому они выполняют свою основную функцию — предоставляют врачам необходимую и точную информацию, позволяют оптимизировать лечебный процесс и обеспечить одинаково высокое качество медицинской помощи в любом из лечебных учреждений.
Первые руководства по клинической практике [1,3] строились по принципу консенсуса группы специалистов, однако в наши дни этого подхода явно недостаточно. Современный врач нуждается в строго взвешенных рекомендациях, основанных на данных наиболее качественно выполненных клинических исследований. Поэтому применение методов доказательной медицины, и в частности рейтинговой системы рекомендаций, на наш взгляд, более перспективно при подготовке будущих руководств по клинической практике и в дальнейшем обещает стать стандартом при подготовке подобных документов.
Цель настоящего обзора — ознакомить практических врачей с результатами использования концепции доказательной медицины на примере рекомендаций по лечению больных БА. При этом обоснование каждой из рекомендаций проводится с учетом уровня доказательности в соответствии с системой, принятой в доказательной медицине.
Уровень доказательности. Удобным механизмом, который позволяет каждому специалисту легко оценить качество каждого клинического исследования и достоверность полученных данных, является предложенная в начале 90-х гг. рейтинговая система оценки клинических исследований. Для непосредственной оценки исследования используются понятия — уровень доказательности. Обычно выделяют от 3 до 7 уровней доказательности [19], при этом с возрастанием порядкового номера уровня (обозначается латинскими числами) качество клинического исследования снижается, а результаты представляются менее достоверными или имеют только ориентировочное значение [II].
К I уровню в доказательной медицине принято относить хорошо разработанные, крупные, рандомизированные, двойные слепые, плацебоконтролируемые исследования. К этому же уровню доказательности принято относить данные, полученные в ходе мета-анализа нескольких рандомизированных, контролируемых исследований [2].
Небольшие рандомизированные и контролируемые исследования (в том случае, когда получить статистически корректные результаты, не удалось из-за малого числа больных, включенных в исследование) относят ко II уровню доказательности, а исследования «случай-контроль» или когортные исследования — к II или III уровню. Наконец, данные, содержащиеся в отчетах экспертных групп или консенсусах специалистов, принято относить к III или IV уровню [2].
В зависимости от мнения составителей (национальные общества доказательной медицины, общества специалистов) одно и то же исследование в различных рейтингах может относиться к разным уровням, однако общий порядок распределения исследований — практически везде одинаков. Так, в каждом из этих рейтингов первое место принадлежит крупным, рандомизированным, двойным слепым, плацебоконтролируемым исследованиям (как наиболее достоверным источникам информации), а завершается каждый рейтинг мнениями отдельных специалистов и данными крупных руководств по клинической практике.
В системе доказательной медицины отдельные практические рекомендации по диагностике и лечению различных заболеваний также имеют свой рейтинг — степень убедительности рекомендаций (обозначаются латинскими буквами). Система рейтинга рекомендаций в англоязычной литературе обозначается как сила рекомендаций (Strength of recommendation). При этом рекомендации, вытекающие из исследований I уровня, обозначаются как А, II уровня — В и т.д. Кроме того, к рекомендациям В относятся экстраполяции из исследований I категории доказательности, а рекомендации С строятся как на основании исследований III уровня доказательности, так и на экстраполяции данных исследований I и II уровня. Таким образом, рекомендации уровня А представляются вполне убедительными, так как опираются на веские доказательства, у рекомендаций уровня В — убедительность относительная, а для рекомендаций уровня С имеющихся доказательств недостаточно, но и эти рекомендации могут использоваться с учетом определенных обстоятельств. Положения, относимые к уровню D и Е, представляются доказанными недостаточно [2, II].
В настоящем обзоре была принята система оценки клинических исследований Canadian asthma consensus report (1999) [8]. При присвоении отдельным рекомендациям того или иного рейтингового уровня авторы опирались на мнение экспертов Великобритании и Канады [7, 18, 25].
Рекомендации по диагностике, оценке состояния больных и лечению бронхиальной астмы
Общие принципы лечения бронхиальной астмы в амбулаторных условиях
Бронхиальная астма характеризуется значительной вариабельностью тяжести течения. Поэтому для терапии бронхиальной астмы в конце 80-х гг. был предложен ступенчатый терапевтический подход, согласно которому каждой степени тяжести течения заболевания соответствует определенная схема лечения (рис. 1) [I].
Ступенчатый подход к лечению бронхиальной астмы
Первоначально было принято выделять четыре степени тяжести бронхиальной астмы (рис. 2) [ 1, 3]. Впоследствии показалось рациональным выделить группу больных с «очень тяжелым течением БА», т.е. тех, у кого адекватный контроль достигается только при применении пероральных глюкокортикостероидов (ГКС) [8]. К этой категории относят также пациентов с так называемой «трудной /тяжелой/ астмой» (аспириновый вариант астмы, ГКС-зависимая и ГКС-резистентная астма, лабильная астма) [10].
Общий алгоритм лечебного подхода к бронхиальной астме приведен на рис. 2. Он включает диагностический этап, выбор схемы первоначального лечения, подбор долговременной терапии заболевания и последующее наблюдение за больным. Так как бронхиальная астма является хроническим воспалительным заболеванием дыхательных путей [I], эффективность терапии оценивается не как полное излечение, а как адекватный контроль за течением заболевания, предотвращающий обострения ( табл. 1) [8]. Рис. 2
Алгоритм лечения бронхиальной астмы
Диагностика и клиническая оценка бронхиальной астмы
Для подтверждения диагноза бронхиальной астмы и оценки тяжести состояния у всех больных с явлениями бронхообструктивного синдрома следует проводить исследование функции внешнего дыхания (С) [25]. К диагностическим критериям, специфичным для бронхиальной астмы, относятся (D) [1, 3]:
- — увеличение ОФВ1, >12% (предпочтительнее >15%, -т.е. примерно 180 мл) через 15 мин после ингаляции бета2-агониста;
- — увеличение ОФВ1 >20% (около 250 мл) после 10-14 дней лечения преднизолоном;
- — значимая спонтанная вариабельность ОФВ1.
При оценке ОФВ1, и ПСВ следует ориентироваться на среднестатистические нормы для данной популяции, а в идеале — на индивидуальный лучший показатель данного больного, измеренный в период стабильного состояния (С) [З].
Когда проведение спирометрии или бронхопрово-кационного теста недоступны, можно оценить вариа-бельный характер бронхообструкции (> 20%) при многодневном измерении ПСВ в домашних условиях, что также может указывать на наличие бронхиальной астмы (В) [8].
Для установления диагноза бронхиальной астмы используют бронхопровокационный тест с метахолином (С) [8].
Бронхиальная астма и факторы внешней среды
В целом, тяжесть симптомов астмы коррелирует со степенью чувствительности больного к аллергенам [I], хотя у целого ряда пациентов аллергия не играет ведущей роли в течении заболевания. Следует помнить, что увеличение объема медикаментозной терапии не должно заменять предотвращение контактна больного с аллергенами и ирритантами (С) [I].
Больным астмой также следует избегать контакта с табачным дымом (С) [1] и строго воздерживаться от курения (В) [25].
Больным с астмой следует избегать высокой концентрации ирритантов во вдыхаемом воздухе (С) [8], но до сих пор не имеется достаточных данных об эффективности применения для этих целей увлажнителей и других средств очистки воздуха (С) [8].
Все взрослые больные с первично возникшей астмой должны проходить обследования для исключения профессионального характера заболевания (В) [5, 8].
Мониторинг и обучение больных бронхиальной астмой.
Обучение пациентов является обязательным компонентом лечения астмы (А) [З]. Целью обучения является контроль за течением заболевания и выбор правильного поведения больного в различных ситуациях, связанных с заболеванием. Программа обучения не должна строиться только на ознакомлении больных с соответствующей литературой (А), а обучение больных необходимо проводить при каждом личном контакте медицинских работников с пациентами (В) [8], что требует хорошего контакта между медицинским работником и обучаемым (С) [З].
Признаки контроля за течением астмы [8]
| Параметры | Их частота или характеристика |
| Дневные симптомы | 85% от индивидуального лучшего показателя |
| Дневные вариации ПСВ* | 1000 мкг/сут в пересчете на беклометазон дипропионат, показано проведение денситометрии, в том случае если у них имеются факторы риска остеопороза (С) [8]. Больные, регулярно принимающие ингаляционные ГКС, должны после ингаляций полоскать полость рта водой для предотвращения системной адсорбции препарата (А) [З]. Применение спейсера также снижает риск нежелательного действия ингаляционных ГКС (D) [1, З]. Бета2-агонисты короткого действия Бета2-агонисты короткого действия являются наиболее эффективными бронхолитическими средствами для купирования симптомов бронхиальной астмы (А) и профилактики астмы физического усилия (А) [3, 22]. Хотя применение бета2-агонистов короткого действия приводит к эффективному увеличению величины ПСВ (А) [18], эти препараты не должны рекомендоваться для постоянного применения в качестве базисной терапии (А) [I]. Наличие у больного потребности в ежедневном приеме бета2-агонистов является показанием к назначению противовоспалительной терапии (А) [1, З]. Если у больного бронхоспазм провоцируется физической нагрузкой, то до выполнения физических упражнений рекомендуется применять бета2-агонисты короткого действия (А) [I]. Например, сальбутамол более эффективен для предотвращения бронхоспазма, вызванного физической нагрузкой, чем хромогликат натрия (А) [7]. Пероральные бронхолитики следует рассматривать как препараты второго ряда после ингаляционных бронхолитиков (С) [З]. Бета2-агонисты длительного действия Применение бета2-агонистов длительного действия является альтернативой увеличения доз ингаляционных ГКС при недостаточном контроле за течением астмы [13, 23]. Эти лекарственные средства могут применяться в качестве дополнительной терапии при умеренном и тяжелом течении астмы (А) [3, 8]. Не рекомендуется применять бета2-агонисты длительного действия для купирования острых приступов астмы (за исключением формотерола) и применять эти лекарственные средства при отсутствии противовоспалительной терапии (В). На фоне применения бета2-агонистов длительного действия должен быть продолжен прием препаратов с коротким действием для купирования симптомов (В) [З]. У большинства больных, получавших сальметерол, удается достигнуть удовлетворительного контроля за течением БА при назначении его по 50 мкг дважды в сутки (В) [13]. Сальметерол вызывает значимую бронходилатацию в течение 12 ч; при назначении препарата в суточной дозе 100 мкг побочные эффекты не существенны, но при увеличении дозы их риск увеличивается (В) [13]. Применение сальметерола 2 раза в день более эффективно, чем использование препаратов короткого действия 4 раза в течение дня (А) [7]. Назначение сальметерола у больных с недостаточным контролем за течением БА может быть столь же эффективно, как увеличение дозы ингаляционных ГКС в 2 раза [23]. Антагонисты лейкотриеновых рецепторов Антагонисты лейкотриеновых рецепторов (АЛТ) являются альтернативой увеличения доз ингаляционных ГКС при недостаточном контроле за течением астмы. Эти лекарственные средства могут применяться совместно со средними и высокими дозами ингаляционных ГКС (А) [З]. Недостаточно данных, которые позволили бы отнести АЛТ к числу противовоспалительных препаратов первого выбора у больных бронхиальной астмой, однако у пациентов, которые не могут принимать ГКС, АЛТ являются препаратами выбора (D) [8]. Другим показанием к назначению АЛТ является аспириновый вариант бронхиальной астмы (D) [8]. Препараты хрома. Кромогликат натрия и недокромил могут применяться как альтернатива бета2-агонистам для предотвращения астмы физического усилия (А) [З]. Не существует свидетельств, на основании которых можно предпочесть недокромил хромогликату натрия или наоборот (А) [I]. Хотя недокромил более эффективен, чем плацебо, однако степень его эффективности не позволяет рекомендовать препарат в качестве средства первого ряда лечения БА (А), тем не менее у детей младше 12 лет и взрослых с легким течением астмы он может являться альтернативой низким дозам ингаляционных ГКС, не обладая нежелательными эффектами ГКС (А). Теофиллин. Теофиллин не должен применяться при бронхиальной астме в качестве препарата первого ряда (А) [З]. У пациентов с течением астмы, при котором средние дозы ингаляционных ГКС неэффективны, добавление к теофиллина лечению ГКС может улучшить контроль за течением астмы и сократить потребность в ГКС (В) [I]. Дозу теофиллина следует увеличивать постепенно путем титрации (С) [I]. Антихолинэргические средства. Препараты этой группы не рекомендуются в качестве препаратов первого ряда для лечения бронхиальной астмы, за исключением случаев толерантности к действию бета2-агонистов (С) [8]. Кетотифен не рекомендуется для лечения бронхиальной астмы (В) [8]. При лечении бронхиальной астмы ингаляционный путь доставки бронхолитиков и противовоспалительных препаратов является более предпочтительным, чем назначение этих лекарственных средств перорально или парентерально (А) [З]. В последние годы существенно расширился арсенал средств доставки ингаляционных препаратов. Условно принято выделять аэрозольный дозированный ингалятор (применяются со спейсером или без него), порошковые ингаляторы (турбухайлер, дискхайлер, циклохайлер и т.д.) и небулайзер. Существует алгоритм подбора больному адекватного средства доставки (С) [8]. Согласно этому алгоритму, первоначально больным астмой следует назначать лекарственные препараты в виде дозированных аэрозольных ингаляторов. Если при употреблении дозированных ингаляторов у больного возникают трудности, следует дополнительно применять спейсер большого объема (объем > 0,75 л). Если же и при использовании дозированного ингалятора со спейсером больной не справляется с техникой ингаляций или не может применять их в течение всего дня, то ему показано назначение препарата в виде порошкового ингалятора наиболее дешевой модели или дозированного аэрозольного ингалятора «легкое дыхание». Аэрозольный ингалятор со спейсером показан для всех возрастных групп, у пожилых больных и детей можно применять аэрозольный ингалятор со спейсером, оснащенным лицевой маской (В). При использовании любой системы доставки ингаляционных препаратов необходимо периодически оценивать технику ингаляции и проводить обучение больных (А) [З]. Применение ингаляционных ГКС через спейсер позволяет уменьшить риск кандидоза полости рта (А) [б]. При обострении бронхиальной астмы использование спейсера большого объема является эффективной альтернативой применению небулайзера, при этом удается в несколько (до 7-14) раз уменьшить дозы бронхо-литических средств (А) [7]. Аэрозольные ингаляторы со спейсером большого объема (>0,75 л) можно рекомендовать и при тяжелых обострениях астмы (А) [7]. Дозированные аэрозольные ингаляторы столь же эффективны, как порошковые ингаляторы (А), в том числе аутохаллер (А) [3, 21]. Лечение бронхиальной астмы в условиях стационара Признаком нестабильного течения БА на всех ее стадиях является увеличение потребности в ингаляционных бета2-агонистах (С), более частое, чем обычно, появление симптомов бронхообструкции и уменьшение величины ПСВ (А) [2, 8]. Пациенты, у которых величины ОФВ1 и ПСВ, измеренные до начала лечения, меньше 40% от индивидуального лучшего показателя (ИЛП) или должных величин (ПСВ 70% от должного, имеющие доступ к необходимым медикаментам, обладающие адекватной техникой ингаляции и получившие индивидуальный лечебный план, могут быть выписаны из стационара (D) [8]. Asthma is an illness with many variations in cause and severity. Many treatment options are available to control and reverse asthma symptoms. What’s the best treatment? It is important to provide more effective care for asthma from the point of view of evidence-based medicine. While the situations and outcomes varied-to some degree, the morbidity and resource utilization attributable to asthma can be strikingly reduced if moderate and severe asthmatics receive expert care источник Алла Николаевна Цой Выбор источников достоверной информации имеет решающее значение для эффективной медицинской деятельности на всех ее уровнях. Предложенная в начале 90-х годов концепция доказательной медицины подразумевает добросовестное, точное и осмысленное использование лучших результатов клинических исследований для выбора лечения конкретного больного [2]. Подобный подход позволяет снизить уровень врачебных ошибок, облегчить процесс принятия решения для практических врачей, администрации лечебных учреждений и юристов, а также уменьшить расходы на здравоохранение и использовать сэкономленные средства для претворения в жизнь социально ориентированных медицинских проектов [2]. Прошло почти 10 лет с появления первого международного руководства по диагностике и лечению бронхиальной астмы (БА) – GINA [1]. Имеется опыт создания аналогичных стандартов по лечению БА, ориентированных на условия и особенности отечественной системы здравоохранения [4]. Подобные руководства подновым углом рассматривают вопросы обучения и самообразования практических специалистов, стимулируют отказ от недостаточно эффективных методов диагностики и лечения, повышая уровень медицинской помощи больным БА. Стандарты и протоколы по клинической практике предназначены, главным образом, для врачей широкого профиля (терапевты поликлиник и стационаров, врачи скорой помощи) и посвящены наиболее общим вопросам диагностики и лечения. Поэтому для этих руководств характерны строго ограниченный объем теоретических сведений, отсутствие описаний редких форм заболевания и новых экспериментальных методов лечения. Но благодаря этому они выполняют свою основную функцию – предоставляют врачам необходимую и точную информацию, позволяют оптимизировать лечебный процесс и обеспечить высокое качество медицинской помощи в любом из лечебных учреждений. Первые руководства по клинической практике [1, 3] строились по принципу консенсуса группы специалистов, однако в наши дни этого подхода явно недостаточно. Современный врач нуждается в строго взвешенных рекомендациях, основанных на данных наиболее качественно выполненных клинических исследований. Поэтому применение методов доказательной медицины, на наш взгляд, более перспективно и в дальнейшем обещает стать стандартом при подготовке клинических руководств. Цель настоящего обзора – ознакомить практических врачей с результатами использования концепции доказательной медицины (ДМ) на примере рекомендаций по лечению больных БА. Удобным механизмом, который позволяет специалисту легко оценить качество клинического исследования и достоверность полученных данных, является предложенная в начале 90-х годов рейтинговая система оценки клинических исследований. Для непосредственной оценки исследования используется понятие “уровень доказательности”. Обычно выделяют от 3 до 7 уровней доказательности [19], при этом с возрастанием порядкового номера уровня (обозначается римскими цифрами) качество клинического исследования снижается, а результаты представляются менее достоверными или имеют только ориентировочное значение [11]. К уровню I в ДМ принято относить хорошо разработанные, крупные рандомизированные двойные слепые плацебоконтролируемые исследования. К этому же уровню доказательности принято относить данные, полученные в ходе мета_анализа нескольких рандомизированных контролируемых исследований [2]. Небольшие рандомизированные контролируемые исследования (в том случае, когда получить статистически корректные результаты не удалось изза малого числа больных, включенных в исследование) относят к II уровню доказательности, а исследования “случай–контроль” и когортные исследования – к II или III уровню. Наконец, данные отчетов экспертных групп или консенсусов специалистов принято относить к III или IV уровню [2]. В зависимости от мнения составителей (национальные общества ДМ, общества специалистов) одно и то же исследование в различных рейтингах может относиться к разным уровням, однако общий порядок распределения исследований практически везде одинаков. Так, в каждом из этих рейтингов первое место принадлежит крупным рандомизированным двойным слепым плацебоконтролируемым исследованиям (как наиболее достоверным источникам информации), а завершается каждый рейтинг мнениями отдельных специалистов и данными крупных руководств по клинической практике. В системе ДМ отдельные практические рекомендации по диагностике и лечению различных заболеваний также имеют свой рейтинг – степень убедительности рекомендаций (обозначается латинскими буквами). Рейтинг (уровень) рекомендаций в англоязычной литературе трактуется как сила рекомендаций (Strength of recommendation). Таким образом, рекомендации уровня А представляются вполне убедительными, так как опираются на веские доказательства, у рекомендаций уровня В убедительность относительная, а для рекомендаций уровня С имеющихся доказательств недостаточно, но и эти рекомендации могут использоваться с учетом определенных обстоятельств. Положения, относимые к уровням D и E, представляются недостаточно доказанными [2, 11]. В настоящем обзоре была принята система оценки клинических исследований, предложенная канадскими специалистами [8]. При присвоении отдельным рекомендациям того или иного рейтингового уровня авторы также опирались на мнение экспертов Великобритании и Канады [7, 18, 25]. Рекомендации по диагностике и лечению БА Общие принципы лечения БА в амбулаторных условиях БА характеризуется значительной вариабельностью тяжести своего течения. Поэтому для терапии БА в конце 80-х годов был предложен ступенчатый терапевтический подход, согласно которому каждой степени тяжести течения заболевания соответствует определенная схема лечения (рис. 1) [1]. Первоначально было принято выделять 4 степени тяжести БА [1, 3], но впоследствии показалось рациональным выделить группу больных с очень тяжелым течением БА, у кого адекватный контроль достигается только при применении пероральных глюкокортикостероидов (ГКС) [8]. К этой группе относят также пациентов с “трудной (тяжелой) астмой” (аспириновый вариант БА, ГКС_зависимая и ГКС-резистентная астма, лабильная астма) [10]. Общий алгоритм лечения БА приводится на рис. 2. Он включает диагностический этап, выбор схемы первоначального лечения, подбор долговременной терапии заболевания и последующее наблюдение за больным. Так как БА является хроническим воспалительным заболеванием дыхательных путей [1], эффективность терапии оценивается не как полное излечение, а как адекватный контроль за течением заболевания, предотвращающий обострения (таблица) [8]. Рис. 1. Ступенчатый подход к лечению БА. Признаки контролируемости течения БА [8] Рис. 2. Алгоритм лечения БА. Диагностика и клиническая оценка БА Для подтверждения диагноза БА и оценки тяжести состояния у всех больных с явлениями бронхообструктивного синдрома следует проводить исследование функции внешнего дыхания (С) [25]. Согласно рекомендациям [1, 3] (D), к диагностическим критериям, специфичным для БА, относятся: При оценке ОФВ1 и ПСВ следует ориентироваться на среднестатистические нормы для данной популяции, а в идеале – на индивидуальный лучший показатель данного больного, измеренный в период стабильного состояния (С) [3]. Для установления диагноза БА также можно использовать бронхопровокационный тест с метахолином (С) [8]. Когда проведение спирометрии или бронхопровокационного теста невозможно, следует оценить вариабельность бронхообструкции при многодневном измерении ПСВ в домашних условиях – вариабельность >20% может указывать на наличие БА (В) [8]. БА и факторы внешней среды В целом тяжесть симптомов астмы коррелирует со степенью чувствительности больного к аллергенам [1], хотя у многих пациентов аллергия не играет ведущей роли в течении заболевания. Следует помнить, что увеличение объема медикаментозной терапии не должно заменять меры по предотвращению контакта больного с аллергенами и ирритантами (С) [1]. Больным БА следует строго воздерживаться от курения (В) [25] и избегать контакта с табачным дымом (С) [1]. Больным БА следует избегать высокой концентрации ирритантов во вдыхаемом воздухе (С) [8], но до сих пор не имеется достаточных данных об эффективности применения для этих целей увлажнителей и средств очистки воздуха (С) [8]. Все взрослые больные с впервые выявленной БА должны проходить обследование для исключения профессионального характера заболевания (В) [5, 8]. Мониторинг и обучение больных Обучение пациентов – обязательный компонент лечения астмы (А) [3]. Целью обучения является контроль за течением заболевания и выбор правильного поведения больного в различных ситуациях, связанных с заболеванием. Для улучшения контроля БА для каждого пациента должен составляться письменный индивидуальный план лечения, основанный на самооценке симптомов (В) [3]. В общем случае проведение иммунотерапии не может быть рекомендовано для лечения БА (В) [8]. Она не должна заменять соблюдение гипоаллергенного режима (С). Целесообразность иммунотерапии может рассматриваться в тех случаях, когда предотвращение контакта с аллергеном и фармакотерапия не приводят к адекватному контролю заболевания (А). Хорошо контролируемая астма не является противопоказанием к проведению иммунотерапии по поводу аллергического риноконъюнктивита и гиперчувствительности к яду насекомых (С) [8]. Ингаляционные ГКС (ИГКС) эффективны при лечении БА (А) [5] и способствуют сокращению применения системных ГКС у больных с ГКС_зависимым течением БА (А) [7]. Назначение ИГКС больным БА позволяет увеличить величину ПСВ и уменьшить потребность в бронхолитиках (А) [6]. Лучший уровень контроля за течением БА быстрее достигается при использовании более высоких доз ИГКС (А) [6]. Позднее начало лечения ИГКС в последующем иногда приводит к более низким результатам функциональных тестов (С) [8]. Все ИГКС в эквивалентных дозах обладают одинаковой эффективностью (А) [3]. Доказана высокая эффективность ИГКС при назначении 2 раза в день; при применении ИГКС 4 раза в день в той же суточной дозе эффективность лечения возрастает незначительно (А) [7]. ИГКС следует рекомендовать тем больным, у которых обычная потребность в применении бета2-агонистов короткого действия составляет 2–3 приема в день и больше (А) [7]. Если при лечении ИГКС достигнут положительный результат, дозу ИГКС следует постепенно снижать до минимальной, обеспечивающей контроль за проявлениями астмы (С) [3]. Снижение доз ИГКС следует осуществлять постепенно, уменьшая дозу на 25–50% от исходной после того, как состояние больного оставалось устойчивым в течение 3 мес (С) [7]. При обострениях БА следует увеличить дозу ИГКС в 2–4 раза (D) [8] или назначить преднизолон в дозе 0,5–1,0 мг/кг/сут (А) [3, 17], повышенная доза ГКС должна поддерживаться в течение 10–14 дней (С) [18]. Существенные опасения больных вызывает безопасность применения ГКС. Между тем, ИГКС в низких и средних дозах сравнительно редко вызывают клинически значимые нежелательные эффекты и обладают очень хорошим (т.е. низким) отношением риск/польза (А) [8]. Пациенты с отягощенной по глаукоме наследственностью или с повышением внутриглазного давления через 5 дней регулярного приема ИГКС должны пройти обследование у окулиста, которое в дальнейшем следует регулярно повторять (D) [8]. Взрослым пациентам, получающим более 1000 мкг/сут ГКС в пересчете на беклометазон, показано проведение денситометрии в случае, если у них имеются факторы риска развития остеопороза (С) [8]. Больные, регулярно принимающие ИГКС, должны после ингаляций полоскать полость рта водой для предотвращения системной абсорбции препарата (А) [3]. Применение спейсера также снижает риск нежелательного действия ИГКС (D) [1, 3]. Бета2-агонисты короткого действия Бета2-агонисты короткого действия являются наиболее эффективными бронхолитическими средствами для купирования симптомов БА (А) и профилактики так называемой астмы физического усилия (А) [3, 22]. Хотя применение Бета2-агонистов короткого действия приводит к эффективному увеличению ПСВ (А) [18], эти препараты не должны рекомендоваться для постоянного применения в качестве базисной терапии (А) [1]. Наличие у больного потребности в ежедневном применении Бета2-агонистов является показанием к назначению противовоспалительной терапии (А) [1, 3]. Если у больного бронхоспазм провоцируется физической нагрузкой, то до выполнения физических упражнений рекомендуется применять .2_агонисты короткого действия (А) [1]: например, сальбутамол более эффективен для предотвращения бронхоспазма, вызванного физической нагрузкой, чем кромогликат натрия (А) [7]. Пероральные бронхолитики следует рассматривать как препараты второго ряда после ингаляционных бронхолитиков (С) [3]. Бета2-агонисты длительного действия Применение Бета2-агонистов длительного действия является альтернативой увеличению доз ИГКС при недостаточном контроле за течением БА [13, 23]; они могут применяться в качестве дополнительной терапии при умеренном и тяжелом течении астмы (А) [3, 8]. У большинства больных, получавших сальметерол, удавалось достигнуть удовлетворительного контроля за течением БА при назначении сальметерола по 50 мкг дважды в сутки (В) [13]. Сальметерол вызывает значимую бронходилатацию в течение 12 ч; при назначении препарата в суточной дозе 100 мкг побочные эффекты несущественны, но при увеличении дозы их риск увеличивается (В) [13]. Применение сальметерола 2 раза в день более эффективно, чем использование препаратов короткого действия 4 раза в день (А) [7]. Назначение сальметерола у больных с недостаточным контролем за течением БА может быть столь же эффективно, как увеличение дозы ИГКС в 2 раза [23]. Антагонисты лейкотриеновых рецепторов Антагонисты лейкотриеновых рецепторов (АЛ) являются альтернативой увеличению доз ИГКС при недостаточном контроле за течением астмы; АЛ могут применяться совместно со средними и высокими дозами ИГКС (А) [3]. Недостаточно данных, которые позволили бы отнести АЛ к числу противовоспалительных препаратов первого выбора у больных БА, однако у пациентов, которые не могут принимать ГКС, АЛ являются препаратами выбора (D) [8]. Другое показание к применению АЛ – аспириновый вариант БА (D) [8]. Кромогликат натрия и недокромил можно применять в качестве альтернативы Бета2-агонистам для предотвращения астмы физического усилия (А) [3]. Не существует свидетельств, на основании которых можно предпочесть недокромил кромогликату натрия или наоборот (А) [1]. Хотя недокромил более эффективен, чем плацебо, однако степень его эффективности не позволяет рекомендовать препарат в качестве средства первого ряда при БА (А). Тем не менее, у детей младше 12 лет и у взрослых с легким течением БА он может являться альтернативой низким дозам ИГКС, не обладая нежелательными эффектами ГКС (А). Теофиллин не должен применяться при БА в качестве препарата первого ряда (А) [3]. У пациентов с течением БА, при котором средние дозы ИГКС неэффективны, добавление теофиллина к лечению может улучшить контроль за течением БА и сократить потребность в ГКС (В) [1]. Антихолинергические средства не рекомендуются в качестве препаратов первого ряда для лечения БА, за исключением случаев толерантности к действию .2_агонистов (С) [8]. Кетотифен не рекомендуется для лечения БА (В) [8]. При лечении БА ингаляционный путь доставки бронхолитиков и противовоспалительных препаратов является более предпочтительным, чем назначение этих лекарственных средств перорально или парентерально (А) [3]. В последние годы существенно расширился арсенал средств доставки ингаляционных препаратов. Условно принято выделять дозированные аэрозольные ингаляторы (ДАИ) (применяются со спейсером или без него), порошковые ингаляторы (турбухалер, дискхалер, циклохалер и т.п.) и небулайзеры. Существует алгоритм подбора больному адекватного средства доставки (С) [8]. Согласно этому алгоритму, первоначально больным БА следует назначать лекарства в виде ДАИ. Если при употреблении ДАИ у больного возникают трудности, следует дополнительно применять спейсер большого объема (>0,75 л). Если же и при применении ДАИ со спейсером больной не справляется с техникой ингаляций или не может применять их в течение всего дня, то ему показано назначение препарата в виде порошкового ингалятора или ДАИ, активируемого вдохом (например, ДАИ “легкое дыхание”). ДАИ со спейсером показан для всех возрастных групп, у пожилых больных и детей можно применять ДАИ со спейсером, оснащенным лицевой маской (В). При применении любой системы доставки ингаляционных препаратов необходимо периодически оценивать технику ингаляции и проводить обучение больных (А) [3]. Применение ИГКС через спейсер позволяет уменьшить риск кандидоза полости рта (А) [6]. При обострении БА применение спейсера большого объема является эффективной альтернативой применению небулайзера, при этом удается в несколько (до 7–14) раз уменьшить дозы бронхолитических средств (А) [7]. Применение ДАИ со спейсером большого объема (>0,75 л) можно рекомендовать и при тяжелых обострениях астмы (А) [7]. ДАИ и порошковые ингаляторыодинаково эффективны (А) [3, 21]. Признаком нестабильного течения БА на всех ее стадиях является увеличение потребности в ингаляционных Бета2-агонистах (С), более частое, чем обычно, появление симптомов бронхообструкции и уменьшение величины ПСВ (А) [2, 8]. источник До 30 сентября действует скидка 20% на курс лечения бронхиальной астмы Обострение астмы полностью «выбивает» человека из нормального ритма жизни. Постоянные ночные симптомы нехватки воздуха, удушливый кашель, плохой сон, невозможность работать и заниматься привычным делом. Для оказания быстрой и эффективной помощи мы применяем сочетанное, комплексное воздействие нескольких методик. В клинике применяется интенсивный курс лечения обострения бронхиальной астмы под контролем врачей пульмонологов с 20-летним опытом работы в НИИ пульмонологии. Программа подходит для взрослых и детей.
Весь комплекс терапии проходит под контролем врача. Поэтому в ходе сеансов можно сделать акценты на особенности заболевания и самочувствия, уменьшить или усилить нагрузку, поменять или добавить препараты для ингаляций. Длительность сеанса 45 минут. Курс лечения включает 5 сеансов. Стоимость 1 сеанса – 5000 руб.* * До 30 сентября действует скидка 20% при оплате всего курса.
Врач-пульмонолог, сомнолог, кандидат медицинских наук, Главный врач медицинского центра «ИнтеграМедсервис» Кандидат медицинских наук, врач-пульмонолог высшей категории, врач функциональной диагностики,заведующая отделением пульмонологии ИнтеграМедСервис, экс-сотрудник ФГУ НИИ пульмонологии ФМБА России. Бронхиальная астма противоречивое, неоднозначное и «капризное» хроническое заболевания легких. Эта болезнь рекордсмен по легендам, заблуждениям, мифам, альтернативным подходам к лечению и шарлатанству. В этой статье постараемся понятно рассказать об этом заболевании. Бронхиальная астма подробно описана и известна давно. Но, несмотря на это по сей день остается загадочным заболеванием. До конца не ясна природа этой болезни. Термин астма дословно означает удушье. Удушье считалось главным, обязательным признаком болезни. Лабораторным доказательством болезни считалась эозинофилия крови и мокроты и аллергия. Но с развитием молекулярной биологии и генетики стало очевидным, что это не так. Современное определение бронхиальной астмы — хроническое воспалительное заболевание нижних дыхательных путей, в развитии которого играют роль большое количество клеток и клеточных элементов. Принято считать, что это воспаление приводит к развитию гиперреактивности бронхов, а следствие этой гиперреактивности — удушье, кашель и одышка. Распространенность бронхиальной астмы увеличивается ежегодно. По информации ВОЗ астмой страдает около 300 млн. человек, затрагивая все возрастные и гендерные группы. За два последних десятилетия в мире произошло двух-кратное увеличение больных бронхиальной астмой. В России с 1998 по 2002 распространенность заболевания увеличилась на 28,2 %. Распространенность болезни в нашей стране составляет 6,9% среди взрослых и 10% среди детей. В РФ бронхиальной астмой болеет 7 миллионов человек. Заболел бронхиальной астмой- я скоро умру? Что касается смертности, то бронхиальная астма редко является причиной смерти. В Канаде, Австралия, некоторых Европейских странах отмечен рост смертности от астмы. А в Англии отмечено снижение этого показателя . Бронхиальная астма не прогрессирующая болезнь, в отличие от ХОБЛ. Болезнь ни во что не перерождается. «О самом главном». Бронхиальная астма: почему она обостряется весной? Послушать выступление Кулешова А.В. на радио Россия. Бронхиальная астма это мульти-факториальное заболевание. Установлено, что фактором развития болезни является семейный анамнез аллергии (атопии). Наличие аллергии в семье увеличивает в 5 раз риск развития аллергического ринита и бронхиальной астмы! Аллергены домашнего клеща, эпидермиса животных, пыльцы растений, таракана, грибов Alternaria считаются наиболее распространенными факторами риска.
Инфекция так же играет спорную роль в развитии болезни. Описаны случаи, указывающие на прямую связь между рецидивирующей в детстве респираторной инфекцией и снижением риска развития бронхиальной астмы. Но при этом известно, что вирусная инфекция часто провоцирует обострение БА. Вероятно, и те и другие наблюдения верны. Инфекция играет роль пускового агента, проявляется на разных этапах жизни человека и влияет на стадии заболевания. Ухудшающаяся экологическая обстановка – бронхиальная астма экологозавиимое заболевание. Уровень промышленного загрязнения и распространенность болезни тесно и напрямую взаимосвязаны. К примеру, распространенность БА среди городских жителей (дети, взрослые) в 1,6-1,8 раза выше, чем в сельской местности. Прочие факторы – это малый или избыточный вес при рождении, курение матери во время беременности, наличие животных в доме, ожирение, избыточное потребление соли.
Симптомы бронхиальной астмы различны и индивидуальны. Нет характерного симптома, который однозначно указывал на то, что человек болеет астмой. Для большинства людней заболевший астмой – задыхающийся человек, постоянно кашляющий и свистящий на все лады. Однако это не обязательно так. На приеме некоторые пациенты жалуются на затрудненный выдох, кто то на сложности с вдохом. Некоторые предъявляют жалобы на кашель ночью, утром, при физической нагрузке,а некоторых удушье не беспокоит. Такой диапазон степени выраженности жалоб и размытости симптомов, характерен для бронхиальной астмы. Астма в период между обострениями может никак себя не проявлять. В этот «спокойный» промежуток времени пациенты совершают ошибку — прекращают лечение. В результате у пациента случается обострение астмы. Для бронхиальной астмы не обязательны:
Я не задыхаюсь, а только кашляю. А доктор говорит, что у меня астма! Разве это возможно? При кашлевом варианте бронхиальной астмы (а встречается и такой) у пациента нет удушья. Мало того показатели ФВД фиксируют нормальные или слегка сниженные показатели вентиляции. Кашель у пациентов с кашлевым вариантом астмы беспокоит ночью и утром, возникает при быстрой ходьбе или при занятиях спортом. Такой вопрос часто звучит на приеме в клинике. Даже имея специальную подготовку в тонкостях диагностики бронхиальной астмы, врачи сталкиваются с диагностической дилеммой — астма или нет? При тщательном опросе пациента, анализа детства и родственных связей, характере жалоб диагноз астмы становиться вероятным. Но это не вся диагностика астмы! Главным функциональным тестом для диагностики бронхо — обструктивного синдрома принято считать спирометрию, или функцию внешнего дыхания, или ФВД. Спирометрия показывает, как функционируют легкие, сужены или нет дыхательные пути (бронхиальная обструкция), изменены ли дыхательные объемы. Тест безболезненный и бескровный. Проводиться в 2 этапа. На первом этапе из трех попыток дыхательного маневра (форсированного выдоха), выбирается больший показатель. Затем врач предлагает вдохнуть бронхо — расширяющий препарат (Сальбутамол) и через 15-20 минут, повторяется этап номер один. Продолжительность процедуры 20-25 мину. Полученный результат расшифровывает сам лечащий врач. Задача теста Несмотря на простоту теста, выполнение дыхательного маневра требует четкости. Как показывает опыт из 10 сделанных ФВД в других поликлиниках и медицинских центрах, только два будут соответствовать критериям качества. Чтобы избежать ошибок при диагностике астмы, в нашей в клинике лечения астмы и аллергии, врачи пульмонологи сами исполняют этот тест. Сложнее становится задача, если спирометрия нормальная, а положительной реакции на препарат нет. В этом случае рекомендуем провести бронхопровакационный тест. Это ФВД наоборот. Это экспертное исследование подтверждает или опровергает диагноз астмы. Бронхопровакационный тест незаменим при диагностике кашлевого варианта бронхиальной астмы и астмы физического усилия. Мы предлагаем прием врачей, специализирующихся на лечении астмы, экспертного уровня в Москве Если Вы подозреваете у себя или близких астму, запишитесь на прием: Тек же у Вас есть возможность обойтись без телефона и записаться онлайн через сайт. Позже, наш диспетчер свяжется с Вами для уточнения деталей приема. Учитывая вариабельность симптомов, функциональных показателей, разнообразие причин развития бронхиальной астмы для контроля требуется классификация. Классификация бронхиальная астма ( по рекомендациям GINA 2016) по степени тяжести: Ступень 1: Интермиттирующая бронхиальная астма
Ступень 2: Легкая персистирующая бронхиальная астма
Ступень 3: Бронхиальная астма средней тяжести, персистирующая. Удушье, кашель беспокоят ежедневно. Нарушен сон, обычная физическая активность дается с трудом.
Ступень 4: Тяжелая персистирующая бронхиальная астма. Тяжелое состояние — дыхательные нарушения и симптомы носят выраженный, ежедневный характер. Обострения сменяют друг друга. Ночные симптомы ежедневные. Значительное снижение физической активности ОФВ1 или ПСВ ≤ 60% от должного. Это опасное состояние. Требуются действия со стороны медицинского персонала, для купирования симптомов и принятия решения о госпитализации в стационар. По этой классификации степень тяжести избирается из самого тяжелого проявления симптома или показателя ФВД. Причем достаточно одного симптома или показателя. Но из-за переменчивости проявлений астмы степень тяжести так же становиться величиной непостоянной. Тяжесть БА – не статичная характеристика. Аллергическая БА: «классика» для нее характерно начало в раннем детстве, как правило, присутствует ряд аллергических сопутствующих заболеваний. Характерен наследственный фактор аллергии. В основе патогенеза лежит эозинофильное воспаление. Ответ на терапию ИГКС хороший. Неаллергическая БА: аллергия не причина развития этого варианта астмы. Воспаление реализуется за счет смешанного, нейтрофильного, эозинофильного звеньев. Ответ на терапию ИГКС иногда отсутствует либо неполный. БА с поздним дебютом: такой вариант чаще встречается у женщин, развивается во взрослом состоянии. При этом типе астмы — аллергия так же не характерна. ИГКС применяют в дозах более 1000 мкг . БА с фиксированной обструкцией дыхательных путей: пациенты, страдающие этим типом астмы, болеют астмой давно. И под воздействием длительного воспаления стенка бронхов видоизменяется на столько, что обструкция становиться постоянной.. БА у больных с ожирением: пациенты с ожирением и БА страдают от выраженных респираторных симптомов, не связанных с эозинофильным воспалением. Определение фенотипов болезни позволяет подойти к лечению персонифицировано и индивидуально. ГЭРБ индуцированная – гастроэзофагеальный рефлюкс актуальная проблема затяжного кашля у пациентов и ГЭРБ способен спровоцировать развитие бронхиальной астмы. Причиной тому вдыхание аэрозоля кислотного содержимого из пищевода. Аспирин зависимая астма — причиной воспаления в бронхах в этой ситуации является аспирин или иные НПВС. Обычно аспириновая форма характеризуется т.н. аспириновой триадой – астма, полипы полости носа и реакция на салицилаты. Кашлевой вариант бронхиальной астмы- с введением в диагностику бронхопровакационного теста стало возможным выявить этот тип болезни. Вместо приступов удушья присутствует спастический кашель с акцентом в ночные или утренние часы. Астма физического усилия – приступы затрудненного дыхания возникают исключительно при физических нагрузках. При ней же отмечается вариабельность показателей вентиляции. Иногда слышны свисты и хрипы. Профессиональная астма – исключительно факторы производственной среды провоцируют эту форму астмы. Иные факторы, вне рабочего места, недолжны при этой форме быть, причиной заболевания. Ночная астма – спорный вариант. Но описаны исключительно ночные приступы нехватки воздуха. Очень часто коррелирует с СОАС. Мульти факториальному заболеванию – многоуровневое лечение! Успешный контроль над бронхиальной астмой возможен в комплексе мероприятий:
Задачи терапии бронхиальной астмы:
Для решения задач применяется ступенчатая терапия. Главный принцип ступенчатой терапии – это увеличение объема терапии при отсутствии должного контроля над астмой (при ее обострении) и соответственное уменьшение этого объема при достижении стабилизации состояния, стихания симптомов болезни. Ступени содержат информацию о вариантах лечения, отличающихся по своей эффективности. Ступень и объем терапии выбираются лечащим врачом и зависят от степени выраженности симптомов астмы у пациента. Применение ступенчатой терапии позволяет, при ее правильном применении, оценить эффективность выбранной схемы лечения. Например, если не удается стабилизовать обострение астмы, необходимо проверить технику использования ингаляторов. Проверить выполняет ли пациент назначения и рекомендации. Возможно, внимания не было уделено сопутствующим болезням? И оценив эти факторы, принимается решение об изменении объема лечения. Снижение объема терапии, например кратности или дозировки ингаляторов, так же требует осторожности. Тяжесть заболевания обязательно учитывается при изменении терапии. Пациенты часто ошибаются отменяя прием препаратов на ранних этапах стабилизации астмы. Лекарства для лечения разделены на две группы: Симптоматические 2. Для базисной терапии астмы используют комбинации противовоспалительных лекарств — ИГКС ( ингаляционные глюкокортикостероиды – Будесонид, Мометазон, Беклазон ) и бронхорасширяющих средств длительного действия (Форадил, Формотерол, Сальметерол). Цель этой группы лекарств — предотвратить обострение симптомов астмы и контроль над заболеванием. Противовоспалительный эффект достигается действием кортикостероидных гормонов на медиаторы воспаления — эозинофилы, цитокины и прочие клетки воспаления. Карманные дозированные ингаляторы — средства доставки лекарственных средств в бронхи. Они специально разработаны для вдыхания лекарственного препарата в виде аэрозоля или пудры. Небулайзеры — это ингаляторы, но стационарные — они средство доставки препаратов в виде суспензий или растворов в бронхи. Применяется при обострении бронхиальной астмы, особенно тяжелом течение. Для успешного лечения важно, принимать все лекарства, которые доктор предписывает. Пациенты должны научиться правильному использованию ингаляторов. Вам, возможно, придется принимать лекарства несколько раз день и при этом отсутствие симптомов не повод самостоятельно вводить коррекции в схему терапии. Наши специалисты уделяют особое внимание правильности использования ингаляторов. Ведь модификаций препаратов для ингаляционной терапии очень много, а мы знаем особенности использования всех препаратов. Пациенту может показаться, что рекомендованный препарат не работает, но это не означает, что он не помогает. При возникновении таких сомнений обратитесь к пульмонологу. Важно знать, что неправильное лечение БА, приводит к изменениям в легких. Некорректный прием лекарств может привести Вас на больничную койку. (анти-лейкотриеновые средства- Монтелукаст и Зафирлукаст). Эти препараты менее эффективны, чем ИГКС, для контроля астмы. Препарат эффективен при атопической форме бронхиальной астмы, а так же пациентов с аспириновой формой астмы и астмой физического усилия. Эти препараты подавляют сужение бронхов в ответ на ингаляцию лейкотриенов, уменьшают астматическую реакцию на холод и физические усилия. Кромоны — кромогликат натрия («Интал») и недокромил («Тайлед»). Эффективность и безопасность современных ингаляционных стероидов, производство новых антилейкотриеновых препаратов привели к вытеснению кромогликата и недокромила из арсенала пульмонологов. Терапия гуманизированными антителами к IgE — Омализумаб. Это моноклональное антитело, которое может связать циркулирующий в крови пациента IgE, оказав выраженное опосредованное влияние на аллергены, снижая воспаление в бронхах. Этот препарат наиболее полезен при тяжелых формах астмы, с эозинофильным воспалением, с неэффективным ответом на терапию ИГКС. Эффективность применения около 30%. Метотрексат и препараты золота – оказывают кортикостероид щадящий эффект при лечении астмы. Однако применение ограничено побочными реакциями. Теофиллины – применяются с середины прошлого века для лечения астмы. Их большое преимущество – это их дешевизна. Поэтому препарат охотно применяется в странах с низким экономическим уровнем. Однако у теофиллина выявлены новые свойства, которые изучаются. И мы увидим возрождение этой группы лекарств. Специфическая иммунотерапия (СИТ или АСИТ). Применяется при доказанной связи между астмой и аллергеном (аллергенами). Одномоментно и опасный способ лечения астмы, но и единственный способ терапии астмы способный дать многолетнюю ремиссию в 70% случаев, при полном трехгодичном цикле лечения. Эффект достигается за счет снижение иммунного ответа на постепенно и периодически повышающиеся дозы вводимого аллергена в организм человека. Получается нечто похожее на прививку от аллергии. У метода много противопоказаний и ограничений. Реабилитация пациентов с бронхиальной астмой Складывается из чёткого соблюдения плана медикаментозного лечения пациентом, обучение контролю над своим состоянием, симптомами астмы. В разработанный индивидуальный план вписывается рекомендации по правильному поведению при обострении болезни. Физические упражнения и тренажеры помогаю сохранить дыхательную мускулатуру в тренированном состоянии, обеспечивая толерантность к физическим нагрузкам, улучшают сердечно-легочную функцию. Регулярные занятия физкультурой сократят тяжесть обострений. Профилактика пациентов с бронхиальной астмой У пациентов астматиков существует представление о том, что если избегать факторов провоцирующих приступы, то медикаментозное лечение не нужно или хотя бы сократить объем лекарственной поддержки. Доказательств на сей счет недостаточно. Но, тем не менее, можно с уверенностью предложить в качестве профилактических мер следующее:
Соляные пещеры или галотерапия безопасный метод профилактики заболеваний верхних и нижних дыхательных путей и психоэмоциональной разгрузки организма. Рассматривать эту методику как лечение астмы не стоит. При прохождении курортного лечения , соляные пещеры полезны. Пациент, болеющий астмой должен регулярно кушать! Нет рекомендаций, подтвержденных клиническими исследованиями о необходимости диеты. Международные исследования доказали, что инициировать астму может избыток потребления соли и фактором риска является ожирение. Если употреблять в пищу меньше соли и следить за калориями, проблем не возникнет. Диета при астме применяется при наличии аллергии на продукты питания. Тут рекомендация одна — исключите эти продукты из рациона и аллергической реакции на них не будет. Так же при наличии ГЭРБ и астмы необходимо соблюдать режим питания, прописанный врачом для профилактики ГЭРБ. Прогноз течения бронхиальной астмы благоприятный. По нашим наблюдениям 70% пациентов» боится «астму, но игнорирует обструктивный бронхит. И это заблуждение т.к. прогноз ХОБЛ трагичней и опасней. Если соблюдать рекомендации врачей астма не будет менять ваш привычный ритм жизни. Бронхиальная астма ожирения, бронхиальная астма с фиксированной нагрузкой, атопическая астма или астма курильщика трудные варианты для лечения. Назначенная терапия не приносит облегчения дыхания и самочувствия. В 10% случаев не обойтись без стационарное лечение , вплоть до отделения реанимации. В чем отличие отделения пульмонологии «ИтеграМедсервис» от других клиник и отделений в лечении бронхиальной астмы? Это мульти дисциплинарный подход к проблеме бронхиальной астмы у каждого конкретного пациента. Ведь астма мульти-факториальная болезнь. К болезни нельзя подходить, просто назначив аэрозольный ингалятор. Владеем всеми способами терапии бронхиальной астмы. Астма школа и реабилитация Н.Н Мещеряковой, популярна в Москве. При выборе схемы лечения врачи оценивают возможные нежелательные эффекты применяемых лекарств и честно обговаривают это с пациентами. Ежегодно обновляем информацию о новых препаратах на конгрессе по проблемам органов дыхания и на Европейском конгрессе по респираторным заболеваниям. Позвоните нам и запишитесь на прием: Тек же у Вас есть возможность обойтись без телефона и записаться онлайн через сайт. Позже, наш диспетчер свяжется с Вами для уточнения деталей приема. Нажимая на кнопку «ЗАПИСАТЬСЯ НА ПРИЕМ», Вы даете свое согласие на обработку ваших персональных данных! источник |

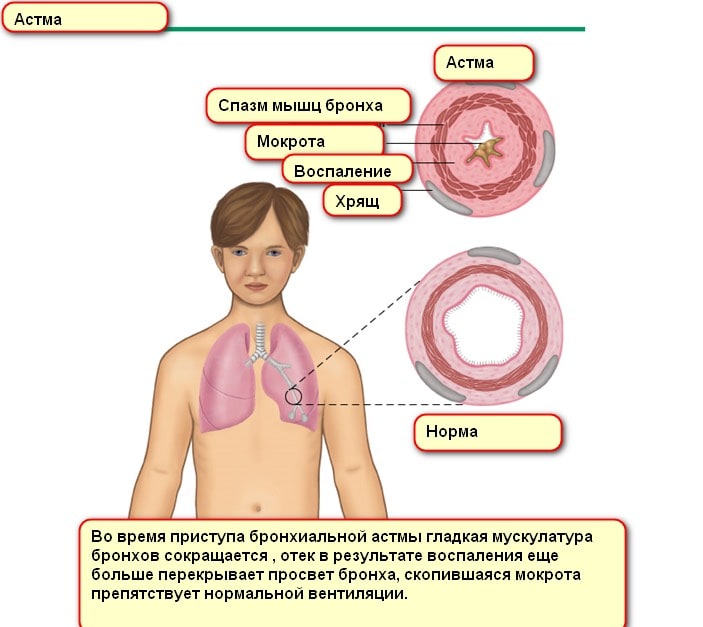 Снижение концентрации домашнего клеща в доме снижает риск развития БА у ребенка до 8 лет. Но при этом контакт ребенка первого года жизни снижает реакцию на большинство аллергенов и развитие БА в будущем. По данным международных исследований, более десятка обстоятельств регулируют вероятность возникновения БА у детей и взрослых.
Снижение концентрации домашнего клеща в доме снижает риск развития БА у ребенка до 8 лет. Но при этом контакт ребенка первого года жизни снижает реакцию на большинство аллергенов и развитие БА в будущем. По данным международных исследований, более десятка обстоятельств регулируют вероятность возникновения БА у детей и взрослых.