В клинике госпитальной терапии Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова проводилось комплексное исследование метаболизма магния и его антагониста кальция у 133 больных БА. У обследованных пациентов было обнаружено достоверное снижение внутриклеточной концентрации Mg и увеличение Са наряду с уменьшением суточной экскреции магния с мочой. По данным нагрузочных тестов с сульфатом магния у больных отмечалась высокая задержка этого катиона (в среднем 54% от вводимой дозы). Полученные результаты свидетельствуют о том, что дефицит магния у пациентов с бронхиальной астмой имеет место не только в форменных элементах крови, но и в клетках, принимающих участие в развитии воспаления.
Соотношение внутриклеточных концентраций кальция и магния достоверно (р
Выполненные исследования послужили основанием для назначения больным бронхиальной астмой ингаляций аэрозоля сульфата магния. Было установлено, что препарат достоверно по сравнению с плацебо снижает неспецифическую гиперреактивность бронхов и секреторную активность тучных клеток, улучшая непосредственные и отдаленные результаты лечения больных бронхиальной астмой атопического генеза и физического усилия.
Таким образом, нарушения минерального обмена, по-видимому, являются одним из механизмов формирования синдрома гиперреактивности бронхов и бронхообструктивного синдрома у пациентов с бронхиальной астмой.
Помимо ионов калия, натрия, кальция и магния, в регуляции бронхиальной проходимости и различных фаз реакций гиперчувствительности принимают, вероятно, микроэлементы (МЭ).
В исследованиях, выполненых in vitro и in vivo, установлено, что наиболее чувствительны к дефициту меди и цинка Т-киллеры и Т-хелперы, макрофаги и нейтрофилы, в меньшей степени — В-лимфоциты. У экспериментальных животных, получавших диету с низким содержанием данных МЭ, и у больных с генетически детерминированными нарушениями обмена меди и цинка наблюдалось развитие Т- и В-иммунодефицитов, проявляющихся инфекционными поражениями внутренних органов, в том числе и легких. Селективный дефицит цинка приводил к гипоплазии тимуса, снижению активности тимолина и развитию Т-клеточного иммунодефицита. Полученные данные, вероятно, можно объяснить тем, что цинк регулирует синтез нуклеиновых кислот, активной формы тимолина и стимулирует Т-лимфоциты.
При изучении показателей обмена микроэлементов у больных затяжной пневмонией найдено снижение концентрации важнейших биоэлементов, в том числе меди и цинка, в сыворотке крови, сочетающееся с Т-и В-клеточным дисбалансом и депрессией ферментов метаболизма ксенобиотиков. Коррекция содержания МЭ с помощью препаратов растительного происхождения увеличивала эффективность действия иммуномодуляторов и способствовала более быстрому восстановлению иммуноэнзиматического статуса. На основании полученных результатов сделан вывод о том, что изменение микроэлементного состава крови является одной из причин формирования вторичных иммунодефицитных состояний при заболеваниях органов дыхания.
В серии исследований продемонстрировано дозозависимое торможение физиологическими концентрациями цинка Ig Е-опосредованного освобождения гистамина и лейкотриена С4 из тучных клеток и базофилов. По мнению авторов, ионы Zn, депонированные в гранулах мастоцитов, выделяются в процессе секреции медиаторов, выполняя роль регулятора по принципу отрицательной обратной связи. Полученные результаты обусловлены мембраностабилизирующим эффектом цинка, способностью этого катиона «маскировать» рецепторы для Ig E на поверхности тучных клеток, инактивировать фосфолипазу А2, а также его конкурентный антагонизм с кальцием. Последним объясняется устранение экспериментального аллергического бронхоспазма добавками солей Zn.
Таким образом, результаты цитируемых выше исследований свидетельствуют о том, что МЭ участвуют в регуляции клеточного и гуморального звеньев иммунитета, процесса сенсибилизации, интенсивности патохимической и патофизиологической стадий аллергических реакций немедленного типа, которым принадлежит существенная роль в формировании воспалительных изменений бронхов и легких.
Заслуживают внимания данные о способности МЭ контролировать активность перекисного окисления липидов (ПОЛ) и антиоксидантной защиты. Известно, что медь, цинк и марганец входят в состав супероксиддисмутазы, селен-глютатионпероксидазы. Эти ферменты являются компонентами внутриклеточной антирадикальной системы. Церулоплазмин, один из основных внеклеточных антиоксидантов, относится к классу медьсодержащих протеинов. Цинк, образующий химические связи с сульфгидрильными группировками белков, фосфатными остатками фосфолипидов и карбоксильными группами сиаловых кислот, обладает мембраностабилизирующим действием. Избыток ионизированного железа оказывает прооксидантное действие. Дефицит меди и цинка приводит к накоплению свободных радикалов в тканях.
Таким образом, нарушение обмена МЭ является одним из факторов, способствующих избыточной активации ПОЛ, участвующей в формировании воспаления бронхов и бронхиальной обструкции у больных бронхиальной астмой и хронической обструктивной болезнью легких.
источник
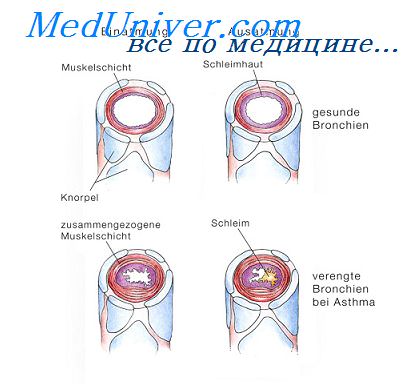
Астма – это состояние, сопровождающееся удушьем вследствие спазма мускулатуры бронхов и сужения просвета бронхиального дерева. Причинами его развития может служить непосредственное воздействие аллергена, что наблюдается наиболее часто, эндогенных провоцирующих факторов или отдельно выделяемая патология левых отделов сердца. В последнем случае состояние называется сердечной астмой. Оно встречается довольно редко и в основном астматический приступ наблюдается при бронхиальной астме.
Одним из наиболее важных факторов, определяющих правильное лечение, является этиология, то есть причина, спровоцировавшая развитие болезни.
При бронхиальной астме имеют значение как внешние, так и внутренние обстоятельства. Именно их взаимодействие часто приводит к обострению заболевания.
Однако бывают ситуации, когда приступ начинается без видимого воздействия аллергенов извне. В тех случаях, когда внешний источник, вызвавший реакцию, не обнаружен, принято говорить об астме эндогенного генеза.

- резкие перепады температур – переохлаждение;
- острый или длительный стресс;
- сильные физические нагрузки;
- инфекционные заболевания.
На последнем факторе следует остановиться подробнее, так как именно его присутствие наблюдается наиболее часто при бронхиальной астме эндогенного характера. Особенно опасны вирусные болезни дыхательных путей как состояние, напрямую влияющее на иммунные реакции в области бронхов и часто на их нервную регуляцию. В случае атопического (аллергического) происхождения болезни реактивность иммунитета также играет основополагающую роль в механизме развития приступа.
Неудивительно, что важным аспектом борьбы с астмой является нормализация работы иммунной системы и повышение сопротивляемости к инфекционным агентам. Известно, что польза витаминов при астме огромна.

- аскорбиновая кислота;
- витамины группы В;
- витамины А и Е;
- группа витамина P;
- витамин D.
В таблице подробно расписано биологическое действие этих веществ для улучшения состояниях больных бронхиальной астмой.
Таблица – Значение витаминов при лечении астмы
| Витамин | Химическое название | Действие на симптомы бронхиальной астмы |
|---|---|---|
| С | Аскорбиновая кислота | Ослабление сезонных проявлений. Снижает риск возникновения анафилактического шока и отека Квинке. Некоторые данные свидетельствуют об уменьшении под действием этого витамина содержания гистамина (основного вещества, вызывающего аллергические реакции) в крови |
| В | Никотиновая кислота (B3) | Снижение интенсивности астматических хрипов и скорости развития аллергической реакции |
| Пиридоксин (В6) | Нормализует обмен гистамина. Может быть снижен у больных, длительно принимающих брохорасширяющие препараты | |
| Цианокобаламин (В12) | Облегчение дыхательных движений во время приступа. Способствует благоприятному преодолению контакта с аллергенами и физических нагрузок. Уменьшает проявление аллергии к яичному желтку | |
| Е | Токоферол | Снижает продукцию медиаторов воспаления. Способствует уменьшению кашля, выраженности свиста, затрудненности дыхания. Улучшает функционирование сердца. Употребляется в комбинации с витамином А (ретинолом) |
| Р | Рутин | Нормализует реактивность иммунной системы |
| D | Кальциферол | Уменьшает восприимчивость дыхательных путей к аллергенам, снижает воспалительные реакции |
Прежде чем начинать употреблять какие-либо витаминные препараты или комплексы при бронхиальной астме, необходимо проконсультироваться с врачом. Аллергические реакции весьма вариабельны, поэтому назначение витаминов рассматривается в каждом отдельном случае индивидуально.
Помимо вышеуказанных полезных соединений существуют определенные микроэлементы и химические вещества, которые также показаны, когда у больного может развиться астматический приступ.
В медицине известны следующие клинические данные о влиянии различных компонентов на течение заболевания:
- Цинк (Zn) снижает восприимчивость бронхов к воздействию раздражающих веществ-аллергенов. Его дефицит обнаруживается у многих людей с нарушениями в работе дыхательной системы.
- При приеме селена (Se) по 100-200 мкг в сутки наблюдаются значимые улучшения в состоянии больных.
-
Магний (Mg) обладает некоторыми спазмолитическими свойствами, расслабляет мышцы. Снижает восприимчивость организма к аллергенам. Его в некоторых случаях при бронхиальной астме даже назначают внутривенно.
- Молибден (Mo) специфически снижает реактивность организма при аллергических реакциях на сульфиты, которые содержаться, к примеру, в яйцах или вине.
- N-ацетилцистеин разжижает мокроту.
- Теобромин (содержится в продуктах из какао) может применяться в качестве бронхорасширяющего вещества.
Отдельно стоит сказать о применении незаменимых жирных кислот ввиду их выраженной противовоспалительной активности. Они препятствуют спазмированию бронхов и их набуханию. К данной группе веществ относятся:
- Линолевая кислота;
- Гамма-линоленовая кислота.

Известно, что олеиновая кислота, та самая, что входит в состав оливкового масла, оказывает тормозное действие на высвобождение гистамина. Данный биогенный амин вырабатывается особыми высокоспециализированными элементами иммунной системы – тучными клетками. Они содержаться в тканях, в крови же их роль играют другие клетки из лейкоцитарного ростка – базофилы.
Любые синтетические микроэлементы, как и витамины при астме, назначаются лишь врачом на основе опроса и осмотра больного, тщательной проработки анамнеза его жизни и анализа лабораторных данных.
Баланс всех компонентов человеческого организма весьма важен для поддержания здоровья и любое вмешательство должно быть обдуманным, главное – обоснованным.
Прием любых лекарственных средств неизбежно сопряжен с риском возникновения различных сопутствующих нежелательных эффектов. В связи с этим к приему аптечных, а иногда и употреблению в натуральном виде некоторых витаминов следует относиться с осторожностью. Организм, который страдает какой-либо из форм аллергии, в большей мере подвержен также развитию пищевой аллергии.
К применению различных витаминов существуют следующие известные противопоказания:
- болезни, связанные с патологией крови, и особенно эритроцитов (гемохроматоз, талассемия, сидеробластная анемия);
- повышенная экскреция с мочой оксалатов;
- наличие камней в почках;
- сахарный диабет.
- повышенное содержание в крови кальция;
- атеросклероз;
- мочекаменная болезнь;
- хроническая сердечная недостаточность;
- беременность и период кормления;
- повышенное содержание фосфора в крови.

- нежелательно употреблять детям до 12 лет;
- инфаркт миокарда, острая форма.
- беременность, первый триместр;
- не следует принимать детям до 3 лет.
Также противопоказанием для приема любых витаминов можно назвать индивидуальную непереносимость какого-либо из них. Здесь перечислены и те противопоказания, при которых можно употреблять препарат, но с осторожностью.
К побочным эффектам приема большинства из витаминов можно отнести:
- тошноту;
- повышение секреции желудочного сока;
- общую слабость или наоборот повышение возбудимости центральной нервной системы;
- головокружение;
- дерматит;
- местную реакцию в виде появления боли в области введения или инфильтрата;
- гипервитаминоз.
У каждого витамина имеются свои специфические побочные эффекты при несоблюдении прописанных дозировок:
- аскорбиновая кислота может вызвать серьезные изменения в показателях крови, обмене веществ и функциях сердца;
-
пиридоксин – онемение в области конечностей, уменьшение лактации у женщин, изредка судороги;
- никотиновая кислота при передозировке ударяет по желудочно-кишечному тракту и печени;
- при повышенном содержании в организме витамина В12 страдает сердце и головной мозг, увеличивается свертываемость крови;
- очень остро проявляется гипервитаминоз кальциферола: начиная от нарушений пищеварения и функции почек, заканчивая болями в костях и воспалительными процессами в поджелудочной железе.
Повышение иммунной сопротивляемости организма является одним из главных факторов успешного преодоления заболевания. Помочь в этом может прием витаминных комплексов, однако обязательно нужно учитывать противопоказания и индивидуальные особенности организма, чтобы получить максимальную пользу и избежать побочных эффектов.
источник
Для цитирования: Баранова И.А. Бронхиальная астма и остеопороз // РМЖ. 2003. №22. С. 1229
П ри ведении больного бронхиальной астмой основное внимание клинициста сосредоточено, как правило, на респираторной функции. Однако при тяжелом течении заболевания, особенно при использовании системных глюкокортикоидов, пациенты имеют высокий риск развития остеопороза, характерные проявления которого – снижение массы костной ткани и нарушение ее микроархитектоники – обусловливают снижение прочности кости и повышенный риск переломов. Это заболевание утяжеляет течение бронхиальной астмы, приводит к длительным госпитализациям, большим финансовым затратам, необходимости в постороннем уходе за больными с переломами и в значительном числе случаев – к смертельным исходам.
В начальных стадиях остеопороз протекает бессимптомно. Клинические проявления (боли в спине, снижение роста, переломы различной локализации), заставляющие пациента обратиться за медицинской помощью, появляются в тяжелой стадии заболевания. Для ранней диагностики остеопороза используется денситометрический метод количественной оценки минеральной плотности костной ткани (МПКТ). Согласно рекомендациям ВОЗ снижение МПКТ на 1–2,5 стандартных отклонений (SD) от пиковой костной массы (так называемый Т–критерий) соответствует остеопении, более чем на 2,5 SD – остеопорозу, а наличие при этом хотя бы одного перелома свидетельствует о тяжелом остеопорозе [1]. Эти критерии первоначально были разработы для постменопаузального остеопороза, но в дальнейшем стали использоваться в диагностике остеопороза другой этиологии, как у женщин, так и у мужчин. Благодаря этому методу стали появляться данные о распространенности остеопороза при различных заболеваниях, углубились знания о факторах риска.
Факторы риска развития остеопороза при бронхиальной астме
Анализ факторов риска, способствующих развитию остеопороза при бронхиальной астме, следует начать с тех, которые обычно выпадают из поля зрения клиницистов. В противовес ранее распространенной точки зрения, согласно которой риск остеопороза определяется только использованием системных глюкокортикоидов (СГК), с появлением методов ранней диагностики остеопороза в литературе стали накапливаться данные о значительной распространенности низких показателей МПКТ у больных, не принимающих эти препараты.
На состояние костной ткани у больных бронхиальной астмой часто влияют факторы, сопутствующие заболеванию. Если заболевание началось в детском возрасте, эти факторы могут привести к нарушению формирования пиковой костной массы, что дополнительно повышает риск развития остеопороза в зрелом и пожилом возрасте [2] (рис. 1).
Рис. 1. Факторы риска развития остеопороза при бронхиальной астме
Недостаточное потребление продуктов, содержащих кальций и витамин D (особенно молока, рыбы, орехов), зачастую связано не только с индивидуальными особенностями питания, но и с развитием пищевой аллергии на эти продукты. Нередко среди больных бытует ложное убеждение о том, что «молоко увеличивает количество мокроты».
При плохо контролируемом течении заболевания снижается толерантность к физическим нагрузкам, а отсюда – и уровень физической активности. Больные с астмой физического усилия избегают активных физических упражнений, необходимых для укрепления костной ткани. У больных бронхиальной астмой среднетяжелого и тяжелого течения физическая активность снижена вследствие выраженных респираторных симптомов и частых госпитализаций.
У 90% тяжелых больных наблюдается гиперрезорбция костной ткани. Причины ее возникновения в 40% случаев связаны с дефицитом витамина D, примерно в 10% – с резорбцией костной ткани вследствие иммобилизации, и в 45% отмечается сочетание этих двух факторов. Иммобилизация даже на такой короткий период, как 6–8 недель, приводит к 10%–ной безвозвратной потере МПКТ, что в 2 раза увеличивает риск переломов [3]. Определенную роль играет гипоксия, воздействующая на костномозговые клетки и трофику тканей.
Известным фактором риска является курение. Оно не только способствует снижению МПКТ, но и вызывает мышечную слабость, увеличивая риск падений, и, следовательно, появления переломов. Эта проблема имеет большое значение у больных ХОБЛ.
В последние годы широко обсуждается влияние воспалительного процесса на костный метаболизм. Известно, что большое количество цитокинов, регулирующих воспалительный процесс, принимают также участие в костной резорбции. В норме они не определяются в крови, но при выраженном воспалении их концентрация значительно возрастает. ФНО- a , ИЛ-1 b и ИЛ–6 хорошо известны пульмонологам как цитокины «раннего ответа». Эти цитокины продуцируются в большом количестве при таких заболеваниях, как астма, ХОБЛ, туберкулез, муковисцидоз и саркоидоз. Они же участвуют в процессе костной резорбции. Наиболее убедительные доказательства получены для ФНО- a , который способствует пополнению количества и созреванию предшественников остеокластов. Мощными медиаторами остеокластогенеза являются также ИЛ–1 и ИЛ–6. Для примера, ИЛ–1 в 4, а иногда и в 10 раз более сильный фактор костной резорбции in vitro, чем паратиреоидный гормон. Таким образом, эти и другие цитокины (включая ИЛ–11 и макрофагальный колониестимулирующий фактор) могут обеспечивать связь между воспалительным процессом в бронхолегочной системе и костным ремоделированием и способствовать потере костной ткани.
В последние годы широко обсуждается роль недавно идентифицированного белка–лиганда остеопротегерина (OPG–L или RANKL), являющегося мощным активатором резорбции костной ткани. Обнаружено, что RANKL высвобождается не только из остеобластов, но и из макрофагов и Т–лимфоцитов. Способность активированных Т–лимфоцитов высвобождать этот белок может объяснять, почему аутоиммунные заболевания, такие как астма, рак, лейкозы и хронические вирусные инфекции (например, гепатит), приводят к системной или локальной потере костной ткани [4].
Процессы, происходящие при хроническом воспалении, пока недостаточно изучены. Гораздо больше известно о последствиях приема глюкокортикоидных препаратов.
Глюкокортикоиды (ГК) – наиболее эффективные препараты для базисного лечения бронхиальной астмы. Врачи аллергологи–иммунологи и пульмонологи лидируют по назначению системных и ингаляционных ГК в сравнении с врачами других специальностей. Ингаляционные ГК регулярно использует 3% популяции Европы [5]. Большое исследование, проведенное в Великобритании в 2000 г., показало, что 40% больных, постоянно принимающих пероральные ГК, – это лица с патологией органов дыхания, в том числе 30,5% – с бронхообструктивными заболеваниями [6].
Вместе с тем ГК имеют много серьезных побочных эффектов, к числу которых относится ГК–индуцированный остеопороз. Потеря костной ткани наступает непосредственно вслед за началом ГК–терапии и является результатом механизмов, включающих подавление костного формирования и увеличение костной резорбции (рис. 2). Формирование костной ткани снижается в результате ингибирования ГК функции остеобластов. Усиленная костная резорбция является следствием вторичного гиперпаратиреоза, развивающегося при подавлении ГК абсорбции кальция в желудочно–кишечном тракте и усиления его экскреции с мочой. Повышение уровня паратиреоидного гормона активирует остеокласты. Значимую роль в процессе резорбции под влиянием ГК–терапии играет снижение уровня половых гормонов. Интересные данные, способные дать объяснение резорбтивному эффекту ГК, были получены при изучении влияния этих препаратов на систему регуляторных белков, играющих важную роль в остеокластогенезе, а именно остеопротегерин–RANK–RANKL. Обнаружено, что ГК уменьшают продукцию остеопротегерина, способствующего формированию кости, и усиливают выработку RANKL, что ведет к стимуляции созревания и повышению резорбтивной активности остеокластов [7].
Рис. 2. Схематическое представление механизмов костной потери у больных с глюкокортикоид-индуцированным остеопорозом. ПТГ — паратиреоидный гормон
Системные глюкокортикоиды. Любой больной, получающий СГК–терапию, подвергается риску развития остепороза независимо от возраста, этнического происхождения, пола, наличия или отсутствия других факторов риска, описанных для остеопороза иной этиологии. Им обусловлено более половины случаев остеопороза в молодом возрасте [8].
Наиболее быстрая потеря костной ткани происходит в первый год с момента начала терапии. В последующие годы лечения потеря костной ткани, как правило, замедляется, но неуклонно прогрессирует, приводя к выраженному снижению МПКТ и развитию переломов. Остеопороз выявляется у значительной части (от 30 до 50%) ГК–зависимых больных [9,10]. Прием ГК в детском возрасте приводит к уменьшению роста. У пожилых пациентов снижение костной плотности при длительной терапии происходит в 2–3 раза быстрее, чем в физиологических условиях [11].
По существующим рекомендациям, все больные, постоянно получающие СГК–терапию (более 1 месяца) в дозе, эквивалентной 5 мг/сут. преднизолона, должны быть обследованы для выявления остеопороза [12]. Отсутствие влияния на гипоталамо–гипофизарно–надпочечниковую систему еще не свидетельствует об отсутствии эффекта на кости. Использование минимальных доз, альтернирующий режим приема, по данным многих авторов, предотвращают эффект на гипоталамо–гипофизарно–надпочечниковую систему, но не потерю костной ткани [13,14,15]. В этом отличие бронхиальной астмы от ревматоидного артрита, при котором небольшие дозы СГК могут иногда оказывать протективный эффект, снимая выраженность воспалительного процесса и увеличивая физическую активность пациентов [16].
Строгих рекомендаций по проведению денситометрии больным, получающим СГК, нет. Обычно ее проводят при длительности лечения более 6 мес. Критические для развития переломов значения МПКТ определены только у женщин в постменопаузе, но не изучены в других группах риска. Между тем, по данным проведенных исследований, костная плотность у СГК–зависимых больных бронхиальной астмой, имевших переломы, значительно выше, чем у пациентов с переломами при инволюционном остеопорозе, что может быть связано не только с количественными, но и качественными изменениями кости под влиянием СГК [17,18]. Изменения МПКТ у больных, принимающих СГК, неоднозначны. В противовес общепринятой точке зрения, согласно которой степень снижения МПКТ прямо зависит от дозы и длительности ГК–терапии, в последнее время появляются работы, ставящие под сомнение такую корреляцию [19].
Возникающие на фоне СГК–терапии переломы обычно происходят в областях скелета, богатых трабекулярной костной тканью, которая имеет более высокую скорость обмена по сравнению с кортикальной. Они локализуются прежде всего в позвонках, головке бедренной кости, ребрах, проксимальном отделе плечевой кости и дистальном отделе лучевой. Частота атравматичных переломов, нередко приводящих к инвалидности, среди больных, принимающих CГК, в 2–3 раза превышает обычный уровень [20]. Подсчитано, что каждый компрессионный позвонок у больного без патологии бронхолегочной системы снижает форсированную жизненную емкость легких на 10% [21]. У больных бронхиальной астмой происходят более выраженные изменения. Уменьшая подвижность грудной клетки и нарушая эвакуацию мокроты при кашле вследствие местной боли, переломы позвоночника и ребер могут осложнить течение заболевания.
Результаты последних исследований показали, что применение СГК ведет также к росту числа переломов костей, богатых кортикальной тканью. В большом популяционном исследовании, проведенном на больных ревматоидным артритом, продемонстрировано увеличение в 2 раза частоты переломов шейки бедра на фоне ГК–терапии по сравнению с контролем того же возраста и пола [22].
Ингаляционные глюкокортикоиды (ИГК) проявляют меньше побочных эффектов по сравнению с системными в силу своего локального действия, а также благодаря быстрому метаболизму в печени. ИГК в дозе, эквивалентной 500 мкг/сут. беклометазона дипропионата контролируют симптомы астмы у большинства пациентов. Кривая доза–ответ для основных показателей (например, симптомов астмы, параметров функции внешнего дыхания, реактивности дыхательных путей) имеет пологую форму, поэтому увеличение дозы ИГК даст меньший прирост в эффективности контроля симптомов астмы, но увеличит риск побочных эффектов. В этой связи добавление к терапии другого класса противоастматических препаратов (b2–агонистов длительного действия, пролонгированных теофиллинов, антагонистов лейкотриеновых рецепторов) более предпочтительно, чем увеличение дозы ИГК [23]. Тем не менее у некоторых больных астмой тяжелого течения назначение высоких доз ИГК позволяет снизить дозу или отказаться от приема CГК.
Однозначного ответа, может ли длительная терапия высокими дозами ИГК вызвать развитие остеопороза, в настоящее время нет. Результаты проведенных исследований МПКТ варьируют от выраженной отрицательной динамики до позитивных изменений. Частично негативные результаты могут быть объяснены использованием в период наблюдения коротких курсов СГК, которые назначались больным для купирования обострения заболевания [24]. Неадекватные результаты могут быть получены при исследовании системного эффекта высоких доз ИГК в группе здоровых добровольцев и больных с легким течением бронхиальной астмы, поскольку у них выше степень накопления препаратов в легких и соответственно более выражен системный эффект, чем у больных со среднетяжелым и тяжелым течением c плохой техникой ингаляции и выраженным бронхоспазмом [25].
В 2001 г. в The Coсhrane Database of Systematic Reviews был опубликован мета–анализ Jones A. с соавт., составленный на основании 7 рандомизированных контролированных клинических исследований [26]. Общее количество больных составило 1989 человек в возрасте до 60 лет (соотношение мужчины/женщины 2:1). Проведенный мета–анализ показал, что прием ИГК в течение 3 лет не вызывает изменений МПКТ и не влияет на частоту переломов.
Развитию системных эффектов, в том числе остеопороза, при использовании ИГК уделено большое внимание в опубликованной в 2002 г. новой редакции Global Initiative for Asthma [23]. Особый акцент на эту проблему поставлен в разделе лечения детей. В этом большом директивном документе указывается, что системные эффекты не развиваются при дозах Ј 500 мкг/сут. (беклометазона дипропионата или эквивалента) у взрослых и Ј400 мкг/сут. (будесонида или эквивалента) у детей; однако это возможно у некоторых восприимчивых к системным эффектам больных. ИГК высоко эффективны для лечения астмы, и выгода от их использования намного превышает риск (возможно, небольшой) развития системных осложнений.
Основой профилактических мероприятий является контроль квалифицированного специалиста за течением бронхиальной астмы, позволяющий избежать появление факторов риска, рассмотренных выше. Большое значение имеют рекомендации по образу жизни. Больным советуют бросить курить и сократить потребление алкоголя. Ежедневные физические упражнения оказывают выраженный положительный эффект на состояние костной ткани, повышают мышечную силу и улучшают координацию движений, что в итоге приводит к снижению риска падений и переломов. Естественно, занятия спортом следует назначать дифференцированно в зависимости от состояния пациента. Но даже тяжелым больным нужно рекомендовать лечебное плавание, спокойные ежедневные прогулки, индивидуально подобранные физические упражнения, не вызывающие болевых ощущений.
Согласно рекомендациям GINA 2002 назначение ИГК не требует проведения медикаментозной профилактики остеопороза [23].
Иного отношения требуют больные, постоянно принимающие СГК. В литературе имеются указания на обратимость изменений в костной ткани после отмены СГК [27], однако едва ли такого эффекта можно достичь у тяжелых больных бронхиальной астмой, годами и даже десятилетиями принимающих эти препараты. Первым и основным шагом является снижение дозы СГК путем оптимизации схем лечения: приема ИГК, а также их сочетания с b2–агонистами длительного действия. Примерами такой комбинации являются сочетания флютиказона пропионата с сальметеролом и будесонида с формотеролом. b2–агонисты длительного действия предпочтительней, однако альтернативой им могут быть пролонгированные теофиллины, антагонисты лейкотриеновых рецепторов или пероральные b2–агонисты длительного действия [23].
Несмотря на кажущуюся очевидность в необходимости проведения профилактических и лечебных мероприятий, частота назначения антиостеопоротических препаратов у больных, постоянно принимающих СГК, крайне низкая, и даже в развитых странах не превышает 16% у женщин после наступления менопаузы и 2–6% у женщин до менопаузы и у мужчин [28,29,30]. Это свидетельствует о плохой осведомленности врачей о развитии остеопороза под влиянием СГК в любом возрасте, неадекватной информации об эффективных программах предупреждения и лечения этого осложнения.
Согласно национальным и международным рекомендациям одновременно с назначением больным постоянной терапии СГК должна проводиться профилактика развития ГК–индуцированного остеопороза [23,31,32].
СГК снижают абсорбцию кальция в желудочно–кишечном тракте и увеличивают потерю кальция с мочой. Из этих соображений больным показан прием препаратов кальция и соблюдение диеты для поддержания общей дневной дозы потребления элементарного кальция. Детям и взрослым, постоянно принимающим CГК, обычно рекомендуется принимать от 1000 до 1500 мг/сут. элементарного кальция. В отличие от постменопаузального и сенильного остеопороза монотерапия кальцием не может замедлить потери костной ткани у больных, постоянно принимающих СГК [33]. Для первичной профилактики используется сочетание препаратов кальция и витамина D.
Назначение витамина D при ГК–индуцированном остеопорозе патогенетически обосновано. Препараты витамина D восстанавливают нарушенную абсорбцию кальция в кишечнике и снижают секрецию паратиреоидного гормона. Кроме того, у некоторых больных пожилого и старческого возраста и/или с тяжелым течением заболевания, а потому не выходящих из дома, часто развивается дефицит витамина D. Дефицит может усиливаться в зимнее время и при недостаточном поступлении витамина с продуктами питания (молочные продукты).
В настоящее время получили распространение активные метаболиты витамина D: 1–альфа–гидроксихолекальциферол (альфакальцидол) и 1,25–дигидроксихолекальциферол (кальцитриол). Они стимулируют образование костной ткани, нормализуют абсорбцию и баланс кальция.
Эффективность различных препаратов витамина D в сочетании с кальцием в первичной профилактике ГК–индуцированного остеопороза доказана в серии рандомизированных испытаний. В настоящее время имеются веские доказательства того, что терапия препаратами витамина D в сочетании с кальцием эффективна для профилактики развития ГК–остеопороза у больных, постоянно принимающих СГК в средней дозе 15 мг/сут. [33]. В связи с низкой стоимостью и малой токсичностью комбинация этих препаратов должна назначаться всем больным, начавшим прием СГК [33]. Рекомендуемая Американской коллегией ревматологов доза витамина D в этой комбинации составляет 800 Ед/сут., могут быть использованы активные метаболиты витамина D: альфакацидол – 1 мкг/сут. или кальцитриол – 0,5 мкг/сут. При использовании активных форм витамина D у больных, начавших прием СГК, рекомендовано тщательное мониторирование уровня кальция крови и мочи. При появлении гиперкальциемии и гиперкальциурии доза препаратов должна быть снижена [32].
С целью уменьшения экскреции кальция с мочой возможно назначение тиазидных диуретиков и ограничение потребления натрия. Рационально использование комбинированной терапии витамином D, кальцием и тиазидами [34]. Однако она требует тщательного контроля уровня кальция в сыворотке крови. Для предотвращения гипокалиемии тиазидные диуретики могут применяться в комбинации с калийсберегающими диуретиками, такими как триамтерен.
Ведение больных, длительно принимающих СГК
Сохраняют значение рекомендации, изложенные выше. Препараты кальция и витамина D входят во все комбинированные схемы лечения. Эффективность лечения и вторичной профилактики оценивается с позиции концепции «качества кости», т.е. по способности антиостеопоротических препаратов достоверно предотвращать развитие новых переломов. К сожалению, основное количество крупных рандомизированных клинических исследований проведено на больных с постменопаузальным остеопорозом. В этой категории больных доказана эффективность применения эстрогенов, ралоксифена, бисфосфонатов (этидроната, алендроната и ризендроната), кальцитонина лосося в предупреждении развития переломов позвоночника и шейки бедра. При ГК–индуцированном остеопорозе такие исследования пока малочисленны и в основном доказывают способность препаратов увеличивать минеральную плотность костной ткани (МПКТ), однако свидетельств снижения частоты переломов в настоящее время недостаточно.
Половые гормоны. Терапия СГК может привести к снижению секреции половых гормонов. Больным необходимо провести обследование, и в случае подтверждения гипогонадизма при отсутствии противопоказаний необходимо проведение гормонозаместительной терапии.
Дефицит тестостерона является хорошо известной причиной развития остеопороза. Низкий уровень тестостерона наблюдается у многих мужчин, постоянно принимающих СГК [35]. Заместительная терапия тестостероном у таких больных дает хорошие результаты. В рандомизированном исследовании [36] небольшой группы мужчин, больных бронхиальной астмой и получающих высокую дозу СГК, назначение тестостерона в течение года приводило к значительному увеличению МПКТ в поясничном отделе позвоночника (около 4%). Отмечалось также уменьшение массы жировой ткани и увеличение мышечной. Согласно рекомендациям Американской ассоциации клинических эндокринологов и Американской коллегии эндокринологов при уровне тестостерона ниже физиологической нормы ( Заключение
В настоящее время имеются эффективные схемы предупреждения и лечения глюкокортикоид–индуцированного остеопороза. Всем больным, принимающим СГК, необходим прием препаратов кальция и витамина D. Эта комбинация должна быть назначена в наиболее ранние сроки от начала постоянной терапии СГК. При снижении минеральной плотности костной ткани ниже возрастной нормы к терапии должны быть добавлены бисфосфонаты или препараты кальцитонина. Большое значение имеет правильное лечение бронхиальной астмы, а также выполнение рекомендаций, касающихся образа жизни, и физические нагрузки.
1. World health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis.// WHO technical report series 843, Geneva, WHO, 1998.
2. Global Initiative for Asthma. Global strategy for asthma management and prevention. //NIH 2002.
3. Aris R.M., Lester G.E., Ontjes D.A. Bone loss physiology in critically ill patients. //Chest.1998;114(4): 954–955.
4. Kong Y.Y. Molecular control of bone remodelling and osteoporosis.// Exp.Gerontol. 2000; 35(8): 947–956.
5. Wong C.A., Walsh L.J., Smith C.J., et al. Inhaled corticosteroid use and bone–mineral density in patients with asthma.// Lancet 2000; 355(9213): 1399–1403.
6. Van Sta T.P., Leafkrens H.G.M., Abenheim L., et al. Use of corticosteroids and risk of vertebral fractures.// J.Bone Miner.Res. 2000; 15: 993–1000.
7. Hofbauer L.C., Gori F., Riggs B.L., et al. Stimulation of osteoprotegerin ligand and inhibition of osteoprotegerin production by glucocorticoids in human osteoblastic lineage cells: Potential paracrine mechanisms of glucocorticoids–induced osteoporosis.// Endocrinology, 1999; 140: 4382–4389.
8. Walsh L.J., Tattersfield A.E.. Bone disease in asthma.// Br.J.Hosp.Med. 1997; 57(8): 390–393.
9. Gulko P.S., Mulloy A.L. Glucocorticoid–induced osteoporosis: pathogenesis, prevention and treatment.// Clin.Exp.Rheumatol. 1996; 14(2): 199–206.
10. Lukert B.P., Raisz L.G. Glucocorticoid–induced osteoporosis: pathogenesis and management.// Ann.Intern.Med. 1990; 112(5): 352–364.
11. Eastell R, Reid D.M., Compston J., et al. A UK Consensus Group on management of glucocorticoid–induced osteoporosis: an update.//J.Intern.Med. 1998; 244: 271–292.
12. American College of Rheumatology and Committee on Glucocorticoid–induced Osteoporosis. Recommendation for prevention and treatment of glucocorticoid–induced osteoporosis.//Arthritis & Rheumatism 2001; 44(7):1496–1503.
13. Allen DB. Growth supression by glucocorticoid therapy. //Endocrinol. Metabol. Clin. North. Am. 1996; 25: 699–717.
14. Backman K.S., Greenberg P.A., Paterson R. Airway obstruction in patients with long–term asthma consistent with irreversible asthma.// Chest 1997; 112: 1234–1240.
15. Dykman T.R., Gluck O.S., Murphy W.A., et al. Evaluation of factors associated with glucocorticoid–induced osteopenia in patients with rheumatic diseases.// Arthritis Rheum. 1985; 28: 361–368.
16. Насонов E.Л., Скрипникова И.А.. Насонова В.А. Проблема остеопороза в ревматологии.– М., Стин, 1997.
17. Luengo M., Picado C., Del Rio L., et al. Vertebral fractures in steroid dependent asthma and involutional osteoporosis: a comparative study.// Thorax 1991; 46(11): 803–806.
18. Saito J.K., Davis J.W., Wasnich R.D., Ross P.D. Users of low dose glucocorticoids have increased bone rates, a longitudinal study.// Calcif. Tissue Int. 1995; 57(2): 115–119.
19. Brandli D.W., Golde G., Greenwald M., Silverman S.L. Glucocorticoid–induced osteoporosis: a cross–sectional study. // Steroids 1991; 56 (10): 518–523.
20. McLeod J.F. Osteoporosis, cytokines, and glucocorticoids // Allergy Proc. 1993; 14(5): 363–364.
21. Iqbal F., Michaelson J., Thaler L., et al. Declining bone mass in men with chronic pulmonary disease.// Chest 1999; 116(6): 1616–1624.
22. Cooper C., Coupland C., Mitchell M. Rheumatoid arthritis, corticosteroid therapy and hip fracture.// Ann.Rheum. Dis. 1995;54:49–52.
23. Global Initiative for Asthma. Global strategy for asthma management and prevention. //NIH 2002.
24. Matsumoto H., Ishihara K., Hasegawa T, et al. Effects of inhaled corticosteroids and short courses of oral corticosteroids in bone mineral density in asthmatic patients: a 4–year longitudinal study.// Chest 2001; 120(5): 1468–1473.
25. Harrison T.W., Wisniewski A., Honour J., Tatterfield A.E. Comparison of the systemic effects of fluticasone propionate and budesonide given by dry powder inhaler in healthy and asthmatic subjects.// Thorax 2001; 56(3): 186–191.
26. Jones A., Fay J.K., Burr M., et al. Inhaled corticosteroid effects on bone metabolism in asthma and mild obstructive pulmonary disease.// Cochrane Library 2002; 3: CD003537.
27. Laan R.F., Buijs W.C., van Erning L.J., et al. Differential effects of glucocorticoids on cortical appendicular and cortical vertebral bone mineral content.// Calcif.Tissue.Int. 1993; 52: 5–9.
28. Peat I.D., Heally S., Reid D.V., Ralston S.H. Steroid induced osteoporosis: an opportunity for prevention? //Ann. Rheum. Dis. 1995;54(1):66–68.
29. Walsh L.J., Wong C.A., Pringle V., Tattersfield A.E. Use of oral corticosteroids in the community and the prevention of secondary osteoporosis: a cross sectional study.// BMJ 1996; 313(7053):344–346.
30. Ettinger B., Chidambaran P., Pressman A. Prevalence and determinants of osteoporosis drug prescription among patients with high exposure to glucocorticoid drug. //Am.J.Manag.Care. 2001; 7(6): 597–605.
31. Eastell R, Reid D.M., Compston J., et al. A UK Consensus Group on management of glucocorticoid–induced osteoporosis: an update. //J.Intern.Med. 1998; 244: 271–292.
32. Recommendations for the prevention and treatment of glucocorticoid–induced osteoporosis. American college of rheumatology ad hoc committee on glucocorticoid–induced osteoporosis. //Arthritis & Rheumatism.2001; 44(7):1496–1503.
33. Homic J., Suarez–Almazor M.E., Shea B., et al. Calcium and vitamin D for corticosteroid–induced osteoporosis.// Cochrane Library 2002;3:CD 000952.
34. Yamada H. Long–term effect of 1 alpha–hydroxyvitamin D, calcium and thiazide administration on glucocorticoid–induced osteoporosis.// Nippon Naibunpi Gakkai Zasshi. 1989; 65(6): 603–614.
35. Reid I.R., Ibbertson H.K., France J.T., et al. Plasma testosterone concentrations in asthmatic men treated with steroids.// Br.Med.J. (Clin.Res.Ed.) 1985; 291: 574.
36. Reid I.R., Wattie D.J., Evans M.C., Stapleton J.P. Testosterone therapy in glucocorticoid–treated men.// Arch Intern. Med. 1996; 156(11): 1173–1177.
37. Petak S.M., Baskin H.J., Bergman D.A.et al. AACE clinical practice guidelines for the evaluation and treatment of hypogonadism in adult male patients. Accessed December 20,2000. URL(http://www.aace.
ГОУ Институт повышения квалификации ФУ «Медбиоэкстрем», Москва НПЦ «МедБиоСпектр», Москва
источник
В настоящее время нарушения кальциевого гомеостаза при бронхиальной астме (БА) вызывают все больший интерес клиницистов и экспериментаторов. Это объясняется прежде всего тем, что дисбалансу внутриклеточного обмена Са2+ отводят одно из важных мест (в ряде случаев и основное) в становлении и реализации патогенетических механизмов, при этом заболевании.
Высвобождение медиаторов аллергических реакций из тучных клеток, гиперсекреция слизи бронхиальными железами и, наконец, само сокращение гладкомышечных клеток бронхов осуществляется при непосредственном участии ионов Са2+.
Роль кальция в функционировании биологических систем достаточно хорошо изучена и в самом общем виде представляет собой повышение концентрации свободного внутриклеточного (цитоплазматического) Са2+ в ответ на различные стимулы, достигающие клеточной мембраны, индуцирующее такие стереотипные реакции, как спазм, секреция, транспорт, проведение нервного импульса и т. д.
Клеточная мембрана является своеобразным фосфолипидным барьером, относительно непроходимым для катионов в том числе и для Са2+, чем поддерживается постоянство трансмембранного градиента этого электролита: внутри клетки концентрация Са2+ составляет 10-7 М, а во внеклеточном пространстве — 10-3 М, т.е. в 10000 раз больше. Относительно низкое содержание Са2+ внутри покоящейся клетки обеспечивается его постоянной «перекачкой» с помощью Са-АТФ-«удаляющего» насоса, Nа+-Са2+-ионобменного механизма, а также путем связывания Са2+ с субклеточными органеллами.
В случае стимуляции клетки происходит мобилизация внутриклеточных запасов Са2+ из саркоплазматического ретикулума, митохондрий, а также активация трансмембранного транспорта ионов внутрь клетки через так называемые кальциевые каналы. Последние подразделяются на два типа: потенциалзависимые (вольтажзависимые) и рецепторуправляемые (рецептороператорные).
Потенциалзависимые кальциевые каналы открываются для внутриклеточного тока Са2+ в процессе электрической деполяризации клеточной мембраны; в свою очередь рецепторуправляемые кальциевые каналы активируются при воздействии различных факторов нейрогуморальной передачи (ацетилхолин, гистамин, лейкотриены), вызывая усиление направленного транспорта Са2+ внутрь клетки при минимальных изменениях мембранной деполяризации.
Повышенный интерес вызывают данные об участии Са2+ в процессе сокращения гладкой мускулатуры трахеобронхиального дерева, тем более что бронхоспазму принадлежит основное место в генезе синдрома бронхиальной обструкции при БА. Сокращение бронхов является результатом, непосредственного повышения концентрации внутриклеточного свободного Са2+ в миоцитах, его последующего связывания со специфическим белком кальмодулином, а образующийся комплекс активирует процессы фосфорилирования миозина, что и приводит к мышечному сокращению.
Иными словами, тонус гладкомышечных клеток бронхов определяется в конечном счете концентрацией цитоплазматического Са2+, трансмембранный транспорт которого индуцируется электрической деполяризацией клеточной мембраны или гуморальными воздействиями и осуществляется по вольтажзависимым и рецепторуправляемым кальциевым каналам.
Полученные в ходе многочисленных исследований данные позволили сформулировать оригинальную кальциевую гипотезу БА, согласно которой нарушения гомеостаза Са2+, характеризующиеся увеличением потока этого иона через плазматическую мембрану, являются своеобразным патофизиологическим фундаментом для ряда форм этого заболевания, что обусловлено формированием гиперреактивности бронхиального дерева. Это весьма напоминает ситуацию при эссенциальной артериальной гипертензии, когда нарушенная реакция сосудистой стенки трактуется как следствие нарушений клеточного метаболизма Са2+.
Однако следует иметь в виду, что коль скоро рецепторуправляемые кальциевые каналы открываются под влиянием целого ряда факторов, многие из которых (гистамин, ацетилхолин, медленно реагирующая субстанция анафилаксии и др.) являются биологически активными веществами, высвобождающимися в период развития аллергической реакции I типа, то нельзя не принимать во внимание и вторичный характер нарушений обмена Са2+ у больных БА в ответ на сенсибилизацию организма.
Учитывая, что основные патологические феномены при бронхиальной астме (гиперреактивность бронхов, высвобождение биологически активных веществ из тучных клеток, гиперсекреция слизи бронхиальными железами, вагусные влияния) являются кальцийзависимыми процессами, естественно предположить, что лекарственные препараты, способные понижать уровень цитоплазматического Са2+, будут обладать определенным терапевтическим потенциалом при этом заболевании.
В данном контексте особое внимание привлекают так называемые антагонисты кальция (АК) или, что более правильно, блокаторы внутриклеточного входа Са2+. АК имеют вполне определенное сродство к вольтаж-зависимым кальциевым каналам, именно их селективная блокада обеспечивает конечный фармакологический эффект препаратов данного класса.
АК, и прежде всего нифедипин (коринфар, адалат), верапамил (изоптин, феноптин), не только хорошо зарекомендовали себя в лечении ряда сердечно-сосудистых заболеваний и их осложнений (ишемическая болезнь сердца, артериальная гипертензия, обструктивная кардиомиопатия, суправентрикулярная эктопическая аритмия, застойная сердечная недостаточность), но и оказались полезными в установлении роли кальциевого дисбаланса в патогенезе БА и в лечении самой БА.
В частности, было показано, что АК in vitro ингибируют высвобождение медиаторов из тучных клеток, базофилов, блокируют выход лейкотриена D (медленно реагирующая субстанция анафилаксии) из пассивно сенсибилизированных фрагментов легкого человека в ходе lgE-опосредованных реакций.
В экспериментальных условиях in vivo удалось продемонстрировать купирующий (обрывающий) или ослабляющий эффект антагонистов кальция при моделировании бронхоспазма у морских свинок и собак, вызываемого гистамином, простагландином F2a, антигеном Ascaris suum. Однако у людей подобное влияние АК выражено в значительно меньшей степени и, по-видимому, лишено самостоятельного значения.
Последнее не является неожиданностью и может быть объяснено тем, что в момент развития бронхоспазма внутри клетки уже создана действенная концентрация свободного Са2+, и применение в подобной ситуации АК не способно в значительной степени сказаться на состоянии бронхиальной проходимости, тем более что в процессе гладкомышечного сокращения «заинтересован» и депонированный внутри клетки пул Са2+, метаболизм которого находится вне поля действия препаратов.
В этой связи особые надежды связываются с возможным бронхопротективным (профилактическим) действием АК, назначаемых перед проведением нагрузочного теста, ингаляционных проб с ацетилхолином, гистамином, препаратами аллергенов у больных БА. Эти надежды в известной степени оправдались.
Интересные данные получены при использовании антагонистов кальция в ходе ингаляционных провокационных проб с рядом биологически активных веществ у больных бронхиальной астмой. Отмечено, что предварительное назначение нифедипина или верапамила, не влияя существенным образом на базальный тонус бронхов, сопровождается отчетливым снижением чувствительности трахеобронхиального дерева к ингаляции гистамина. Вместе с тем даже при подобной премедикации АК у больных БА сохраняется гиперреактивность бронхов к ингалируемому гистамину (в отличие от здоровых).
Среди объяснений подобного феномена наибольшее внимание привлекает следующее: используемый в относительно небольших концентрациях ацетилхолин активирует трансмембранный ток Са2+ внутрь клетки преимущественно через вольтажзависимые кальциевые каналы, и в этой ситуации естественно ожидать определенный бронхопротективный эффект антагонистов кальция.
С другой стороны, при применении больших доз ацетилхолина точкой приложения его действия становятся рецепторуправляемые кальциевые каналы, по которым и осуществляется в основном поступление Са2+ внутрь гладкомышечной клетки. Учитывая, что рецепторуправляемые каналы находятся вне поля действия АК, становится понятным отсутствие сколь нибудь выраженного профилактического действия препаратов при проведении ингаляционных проб с большими концентрациями ацетилхолина.
Прием нифедипина существенным образом уменьшает степень выраженности ответной бронхообструктивной реакции при проведении ингаляционных проб с пыльцой растений, домашней пылью. В частности, при приеме плацебо последующая ингаляция антигена пыльцы растений сопровождается снижением объема форсированного выдоха за 1 с (ОФВ1) по сравнению с исходным уровнем в среднем на 42,8%, тогда как после предварительного приема нифедипина степень выраженности нарушений бронхиальной проходимости становится заметно меньше — OФB1 понижается в среднем на 26,5%.
Если суммировать имеющиеся литературные данные о влиянии АК на состояние бронхиальной проходимости при проведении разного рода функциональных проб, то окажется, что лишь при бронхоспазме физических усилий наблюдается постоянное бронхопротективное действие препаратов, в то время как при ингаляционных тестах с гистамином, ацетилхолином, препаратами аллергенов подобный эффект носит лишь частичный характер (табл. 14).
Таблица 14. Бронхомоторные эффекты АК при БА
Учитывая, что действие широко распространенных противоастматических препаратов — симпатомиметиков и метилксантинов — опосредуется через изменения внутриклеточной концентрации Са2+, можно предположить наличие определенного синергизма во влиянии на бронхиальную проходимость указанных лекарственных средств и антагонистов кальция.
Действительно, симпатомиметики и метилксантины вызывают релаксацию гладкой мускулатуры бронхов, обусловленную повышением внутриклеточной концентрации цАМФ, что ведет к снижению содержания в цитоплазме гладкомышечных клеток бронхов Са2+, связывая его с клеточной мембраной, цитоплазматическим ретикулумом. Исходя из этого, следует предположить, что сочетанное применение АК и симпатомиметиков, метилксантинов способно усилить бронходилатирующий эффект последних. Подобное предположение получило подтверждение в ряде исследований.
Таким образом, синергизм в действии АК и ряда бронхолитиков заключается скорее в большей продолжительности бронходилатирующего эффекта симпатомиметиков, метилксантинов, а не в степени его выраженности. Вероятно величина потенцирующего действия АК в отношении бронходилататоров у каждого конкретного больного будет различной; однако вряд ли сейчас существуют критерии, которые помогли бы из многочисленной группы больных БА выделить тех, у кого подобное сочетание окажется наиболее удачным.
Несмотря на очевидные экспериментальные предпосылки до настоящего времени роль и место антагонистов кальция в терапии бронхиальной астмы еще окончательно не определены.
Экспериментальные и клинические данные наглядно свидетельствуют, что АК уменьшают степень выраженности гипоксемической вазоконстрикции артериолярного русла малого круга кровообращения, являющейся кальцийзависимым процессом, и тем самым приводят к уменьшению легочного сосудистого сопротивления и снижению давления в системе легочной артерии. АК оказывают сбалансированное релаксирующее влияние на сосуды малого круга и бронхиальный тонус, что приводит к уменьшению гемодинамических и вентиляционных расстройств, и тем самым к нормализации вентиляционно-перфузионных отношений у больных с хроническими обструктивными заболеваниями легких, в том числе и БА.
Ввиду высокой антиангинальной активности АК и их самостоятельного антигипертензивного действия, перспективным представляется еще одно направление в использовании данных препаратов — речь идет о достаточно многочисленной группе больных БА с сопутствующими сердечно-сосудистыми заболеваниями (ишемическая болезнь сердца, артериальная гипертензия), у которых антагонисты кальция можно справедливо рассматривать как удачную альтернативу «кардиоселективным» В1-адреноблокаторам.
Интерес к АК при БА не ослабевает; однако этот интерес пока в большей мере продиктован желанием углубить наши знания в области патогенеза этого заболевания, чем ориентирован на конкретные лечебные эффекты, в отношении которых большинство клиницистов проявляет сдержанный оптимизм. Вместе с тем уже сейчас не вызывает сомнения ошибочность мнения о необходимости применения в период обострения бронхиальной астмы в качестве «десенсибилизирующего средства», влияющего на течение аллергической реакции, глюконата кальция или хлористого кальция.
Здесь прежде всего следует учитывать, что чувствительность гладкомышечных клеток бронхов, тучных, клеток к ныне существующим АК значительно ниже, чем гладкомышечных клеток сосудистой стенки. Возможно, что в дальнейшем появление новых представителей класса АК, воздействующих на рецептоуправляемые кальциевые каналы и (или) на процессы мобилизации внутриклеточного Са2+ из субклеточных органелл, окажется более полезным в терапевтическом плане.
Именно с созданием такого рода лекарственных средств, характеризующихся большой тропностью к гладкой мускулатуре трахеобронхиального дерева, тучным клеткам, связывают свои надежды те клиницисты, которые стремятся увидеть в антагонистах кальция завтрашнего дня препараты первой очереди в лечении заболеваний органов дыхания, характеризующихся гиперреактивностью бронхов, и прежде всего БА.
источник
Было замечено, что люди (независимо от состояния здоровья), которые едят недостаточно фруктов и овощей, больше подвержены заболеваниям лёгких. Исследование показало, что у пациентов, у которых в питании при бронхиальной астме было меньше фруктов и овощей, приступы удушья возникали чаще (Gilliland, 2003). Поэтому при бронхиальной астме рекомендацией является сбалансированное питание с их достаточным количеством.
Кроме того, установлено, что здоровая, богатая антиоксидантами диета при бронхиальной астме облегчает течение болезни. Например, три исследования показали, что у детей, которые следуют средиземноморскому типу питания (преимущественно растительные продукты, такие как фрукты, овощи, цельные зерна, бобовые и орехи, морепродукты и ограниченное потребление красного мяса), меньше бронхолёгочных заболеваний, реже устанавливается диагноз бронхиальной астмы и аллергического ринита (Chatzi, 2009; Arvaniti, 2011; Grigoropoulou, 2011). Ещё одно исследование установило, что тяжесть заболевания снижается и у взрослых при переходе на средиземноморский тип питания при бронхиальной астме (Barros, 2008).
Ожирение связано с астмой (Boulet, 2011). У астматиков с избыточным весом его снижение приводит к улучшению дыхательной функции (Maniscalco, 2008). Таким образом, рекомендацией при бронхиальной астме является коррекция избыточного веса.
Несколько популяционных исследований показало, что любители яблок реже болеют астмой. По-видимому, полифенолы, антиоксиданты оказывают защитное действие на бронхолёгочную систему (Boyer, 2004; Hyson, 2011). Добавьте яблоки в свой рацион питания при бронхиальной астме.
Витамин D играет важную роль в регуляции работы иммунной системы и развитии воспалительной реакции. Данные лабораторных исследований на моделях астмы у животных показали, что витамин D снижает чрезмерную реакцию бронхов на аллергены, способствует снижению воспалительной реакции (Taher, 2008; Damera, 2009).
Исследования, проведённые среди больных, показали, что при низких уровнях витамина D в крови заболевание протекает тяжелее, приступы происходят чаще, по сравнению с пациентами, которые применяют при бронхиальной астме этот витамин (Chinellato, 2011; Sutherland, 2010; Searing, 2010).
Наблюдательные исследования показали, что если беременным женщинами назначают при бронхиальной астме витамин D, рождаются дети с более низкими рисками бронхолёгочных заболеваний и астмы по сравнению с женщинами с дефицитом витамина (Devereux, 2007; Erkkola, 2009; Miyake, 2010a).
Исследование детей с астмой различной степени тяжести (от лёгкой до умеренной) показало, что низкий уровень витамина D связан с повышенным риском утяжеления заболевания и повышением частоты обострений астмы в течение ближайших 4 лет (Brehm, 2010).
Ещё одно исследование показало, что у детей, у которых низкие уровни витамина D в возрасте 6 лет, более высокий риск развития астмы в возрасте 14 лет, по сравнению с детьми с высоким уровнем витамина D (Hollams, 2011).
Для того чтобы окончательно установить, есть ли эффект от применения витамина D при бронхиальной астме, в настоящий момент в Национальном институте здоровья (clinicaltrials.gov) проводятся два соответствующих исследования. Одно клиническое испытание у подростков и взрослых с астмой проверяет, снижает ли приём витамина D риск перехода инфекционных заболеваний в астму (NCT00978315). Второе исследование у взрослых изучает, помогает ли приём витамина D предотвратить приступы, если его назначают при бронхиальной астме по сравнению с плацебо (NCT01248065).
Лайф Малти-Фактор — надежный источник витамина D в коллоидной биодоступной (98%), легко уваиваемой форме.
Ряд исследований показал, что, если при бронхиальной астме применяют антиоксиданты, такие как витамины С, Е, флавоноиды и селен, степень бронхоспазма снижается.
Витамин Е обладает антиоксидантными и противовоспалительными свойствами, подавляет выработку активаторов воспаления (цитокинов, ингибирует экспрессию гена IL-4) (Li-Weber, 2002).
Исследования показали, что, если при бронхиальной астме назначают витамин Е, отмечается уменьшение таких симптомов, как свистящее дыхание, кашель и затруднённое дыхание (Litonjua, 2012).
Некоторые исследования показывают, что недостаток витамина Е у мамы опасен повышенным риском заболеваний лёгких у новорождённых и детей (Miyake, 2010b; Litonjua, 2006), повышенным риском развития астмы у детей в возрасте до 5 лет (Devereux, 2006).
Исследование особенностей питания населения, питания при бронхиальной астме и экспериментальные работы говорят о связи между низким уровнем витамина C и риском развития заболевания.
В экспериментах на животных установлено, что применение витамина С при аллергии снижает раздражение и повышенную чувствительность дыхательных путей, уменьшает количество воспалительных клеток в бронхах (Jeong, 2010).
Одно исследование продемонстрировало, что дети с бронхиальной астмой отмечают облегчение состояния при повышенном потреблении омега-3 жирных кислот, витамина С и цинка. Питательные вещества обладают более выраженным эффектом, если их применяют при бронхиальной астме все три одновременно, чем когда используются по отдельности (Biltagi, 2009).
Ещё одно исследование, в котором принимали участие 8 пациентов, показало, что, если при бронхиальной астме назначают 1500 мг витамина С в день в течение двух недель, значительно улучшается течение заболевания по сравнению с больными, получавшими плацебо (Tecklenburg, 2007).
Выделяют две основные группы полиненасыщенных жирных кислот (ПНЖК): омега-3 и омега-6. Источники омега-3 – жир тушки рыбы, масло семян льна. Омега-6 кислоты содержатся в растительных маслах (подсолнечном, кукурузном).
В питании современного человека отмечается недостаток противовоспалительных омега-3 жирных кислот и избыток омега-6 кислот, которые провоцируют и поддерживают воспалительную реакцию, что создаёт благоприятные условия для развития астмы (Black, 1997).
Экспериментальные исследования показывают, что высокое потребление рыбы может уменьшить риск астмы (Laerum, 2007; Miyamoto, 2007), а у любителей растительных масел и маргарина риск заболевания выше (Nagel, 2005).
Ряд исследований свидетельствует, что диета при бронхиальной астме с высоким потреблением омега-3 жирных кислот снижает тяжесть заболевания (Mickleborough, 2006; Schubert, 2009).
Исследования показали, что при астме отмечается дефицит селена (Qujeq, 2003; Allam, 2004; Rubin, 2004).
Проведено несколько исследований эффектов селена, если его назначают при астме.
Одно исследование показало, что приём 200 мкг селена в день позволяет снизить дозировку гормонов-кортикостероидов (если была необходимость их назначения) (Gazdik, 2002).
Другое исследование установило значительное клиническое улучшение, если при бронхиальной астме назначают даже 100 мкг селена в день (Allam, 2004).
В 2007 г. исследование 26 больных продемонстрировало, что, если при бронхиальной астме применяют 200 мкг селена в день в течение 16 недель, улучшаются функции лёгких и качество жизни (Voicekovska, 2007).
Ещё одно исследование показало, что добавление селена в питание при бронхиальной астме улучшает качество жизни, однако изменений в функционировании лёгких отмечено не было (Shaheen, 2007).
Два исследования показали, что более высокое потребление цинка женщинами во время беременности может защитить ребёнка от лёгочных заболеваний и бронхиальной астмы (Litonjua, 2006; Devereux, 2006).
Ещё одно исследование показало, что у людей с эпизодами свистящего дыхания, астмой и тяжёлыми заболеваниями с нарушениями функций лёгких отмечаются низкие уровни цинка в мокроте (Jayaram, 2011).
Исследование лабораторных животных (мышей, предрасположенных к аллергиям) показало, что добавление цинка защищает дыхательные пути от раздражающего действия аллергенов (уменьшает выброс активаторов воспаления цитокинов, иммуноглобулинов Е), уменьшает чрезмерную раздражительность бронхов (Morgan, 2011).
Установлено, что магний снимает спазмы и помогает расслабить мышцы бронхов (Gourgoulianis, 2001).
У пациентов с астмой различной степени тяжести (от лёгкой до умеренной) при потреблении 340 мг магния ежедневно в течение 6,5 месяца значительно снизилась реактивность бронхов, улучшились функции лёгких, течение астмы, качество жизни по сравнению с группой, принимавших плацебо (Kazaks, 2010).
Два других исследования среди детей с астмой от лёгкой степени до умеренной показали такой же положительный эффект добавок магния на течение астмы (Bede, 2003; Gontijo-Amaral, 2007).
Магний назначается не только в виде добавок, но и внутривенно при астме. Недавний обзор 16 клинических испытаний подтвердили пользу и безопасность использования внутривенного введения сульфата магния при тяжёлых обострениях (Song, 2012).
Куркумин, жёлтый пигмент в куркуме (находится в высокой концентрации в соусе карри), оказывает мощное противовоспалительное действие (подавляет определённый фермент (так называемый ядерный фактор каппа-B), участвующий в производстве активаторов воспаления (цитокинов) (Оh, 2011).
В эксперименте на животных изучение этого механизма на модели астмы показало, что куркумин, таким образом, снижает чрезмерную чувствительность дыхательных путей, воспалительные явления, накапливание воспалительных клеток в лёгких (Оh, 2011).
Ликопин – красный пигмент, найденный в помидорах и некоторых фруктах. У больных с астмой добавление в рацион ликопина более чем у половины пациентов предупреждает развитие приступа при физической нагрузке (Neuman, 2000).
В исследованиях у животных установлены многочисленные положительные эффекты ликопина на лёгкие при астме: снижает предрасположенность к аллергии и склонность к реакции бронхов, уменьшает воспаление и отёк (Hazlewood, 2011; Lee, 2008).
Флавоноиды, найденные в фруктах, овощах, красном вине, чае, обладают антиоксидантными и противовоспалительными свойствами. Установлено, что их потребление улучшает работу лёгких (Garcia, 2005). Некоторые из них были изучены при астме.
Установлено, что регионы, где больше потребляют флавоноидов, меньше заболеваемость астмой:
В одном исследовании установлено, что даже однократный приём кверцетина приводит к расслаблению бронхов и их расширению (Joskova, 2011).
В другом исследовании подтверждено, что кверцетин уменьшает выработку слизи и оказывает противовоспалительное действие (снижая выработку активаторов воспаления – цитокинов) (Rogerio, 2010).
Ещё в одном исследовании на животных выявлено, что кверцетин подавляет развитие астматической реакции при введении специального вещества-провокатора (Park, 2009).
Растение содержит флавоноиды, которые облегчают состояние при астме (Mahmoud, 2000; Li, 1997; Tang, 2007).
В одном исследовании экстракт гинкго билобы применялся в течение 2 недель у пациентов с астмой, которым были назначены гормональные препараты. Обнаружено, что в мокроте больных, получавших гинкго билобу, значительно меньше воспалительных клеток по сравнению с приёмом только гормональных препаратов или только пустышки-плацебо, что подтверждает, что растение уменьшает воспаление в дыхательных путях при астме (Tang, 2007).
В исследовании на животных было установлено, что гинкго снижает накопление воспалительных клеток в лёгочной ткани и уменьшает продукцию слизи в дыхательных путях (Chu, 2011).
Коллоидные фитоформулы от компании ЭД Медицин содержат богатый набор полезных и научно обоснованных компонентов, используемых при бронхиальной астме. Кроме того:
— многокомпонентные препараты, то есть один продукт содержит весь комплекс научно обоснованных и полезных нутриентов, витаминов и минералов
Коллоидная фитоформула АнтиОксидант
Содержит богатый набор нутриентов, витаминов и минералов, которые применяют при астме и описаны выше, в виде коллоидного раствора высочайшей биодоступности (до 98%):
Содержит комплекс целебных растений и нутриентов, активно улучшающих функции внешнего дыхания, способствующих уменьшению бронхоспазма и воспалительных явлений и, таким образом, облегчающих течение бронхиальной астмы (подробнее >>>).
источник
 Магний (Mg) обладает некоторыми спазмолитическими свойствами, расслабляет мышцы. Снижает восприимчивость организма к аллергенам. Его в некоторых случаях при бронхиальной астме даже назначают внутривенно.
Магний (Mg) обладает некоторыми спазмолитическими свойствами, расслабляет мышцы. Снижает восприимчивость организма к аллергенам. Его в некоторых случаях при бронхиальной астме даже назначают внутривенно. пиридоксин – онемение в области конечностей, уменьшение лактации у женщин, изредка судороги;
пиридоксин – онемение в области конечностей, уменьшение лактации у женщин, изредка судороги;