Для любого вида рака характерно определённое направление метастазов. Но где бы ни оказался первичный очаг заболевания, метастазы обязательно отправятся в лёгкие, за редким исключением. Лёгочная ткань – излюбленное место метастазов всех типов злокачественных образований.
Ткань лёгких имеет развитую систему кровотока, через неё прокачивается кровь. Метастазы в лёгких – это миграция клеток рака по крови и лимфе, которую инициирует почти любой первичный очаг злокачественной опухоли.
Поток лимфы направляется в крупные сосуды, те впадают в полую верхнюю вену. С помощью сердца смесь крови и лимфы проходит через лёгкие. Поэтому раковый процесс в лёгких – это, как правило, вторичный рак: первичный очаг находится в другом месте. Сто пятьдесят полнокровных, в прямом смысле слова, квадратных метров (такова площадь альвеол лёгких) – полигон идеальных условий для развития раковых клеток.
Ещё недавно наличие метастазов звучало как приговор. Возможности выжить после изнуряющего курса химиотерапии практически не отмечалось. Цитостатики, препараты для торможения клеточного деления, открывали второй фронт, добивая измождённый организм побочными эффектами. Основные: губительное действие на костный мозг, необратимые процессы в печени и, как вариант, летальные изменения состава крови.
Операции не давали ожидаемого результата: после радикального удаления поражённой ткани часто оставался нежизнеспособный орган.
«Доктор, сколько мне ещё осталось?» – на известный печальный вопрос онкологам приходится отвечать чуть ли не ежедневно, иногда многократно. Дать прогноз срока жизни затруднительно. Как долго осталось жить пациенту, зависит от ряда факторов:
- где находится первичное злокачественное новообразование;
- физическое состояние больного человека;
- число прожитых лет пациента;
- наличие метастазов в другие органы, помимо лёгкого, и проч.
Определяющий фактор ещё не назван: в какой момент развития опухоли пациент забил тревогу и обратился к врачу.
Метастазы в лёгких – печальное свидетельство того, что силы сопротивления организма исчерпаны, и клетка рака беспрепятственно понеслась по кровотоку. Медицина сегодня не всегда способна вылечить больного – полностью справиться с метастазами. Прогноз при подобном диагнозе нередко малоприятный из-за отсутствия явной симптоматики в начале процесса.
Положительные прогнозы даёт своевременное лечение первичного новообразования. Люди иногда относительно долго живут и после операций, связанных с метастазами, повторившимися через год.
Хорошие результаты получены при нахождении первичных очагов опухолей в теле матки, молочной железы, в костях, в печени и в области мягких тканей.
Существенно не влияет на выживаемость локализация вторичного рака: центральный либо периферийный. Не зависит время жизни от стороны поражения органа раком, от наличия метастазов в плевру.
Оптимистическими прогнозами радует новообразование, квалифицирующееся как высокодифференцированное. Подобные раковые клетки напоминают здоровые и медленно распространяются. Опухоль в последнем случае поддаётся терапии. Рано выявленная патология продлевает жизнь до 5 лет.
Если не лечить низкодифференцированную опухоль, пациент сможет прожить 100 дней. Клетки указанного вида опухоли крайне агрессивные, но чувствительны к химиотерапии, ионизированному облучению. Семьдесят процентов больных продолжают жить, если терапия проводится своевременно, злокачественный процесс выявлен максимум на второй степени развития.
Помимо того, что определяющим фактором метастазирования опухолей различных органов именно в лёгкое являются множественные кровеносные сосуды лёгочной ткани, в отдельных случаях ситуации способствует и близкое взаиморасположение ряда органов.
По способам метастазирования:
- Лимфогенные метастазы. Раковые клетки с потоком лимфы направляются в близлежащий лимфатический узел.
- Гематогенные метастазы. Перенос клеток рака осуществляется по кровяному руслу.
Разделение носит формальный характер, потому что определить способ проникновения метастазов в ткани лёгкого не представляется возможным и не влияет на ход лечения. Лечить однозначно придётся, при любом пути образования рака.
- Очаговые образования. Очаговый – наименее агрессивный вид метастазов и заносится в лёгкое потоком крови. Рентгеновский снимок покажет образования различных размеров. При малом распространении возможен благоприятный исход.
- Инфильтративные метастазы. Клетки опухоли распределяются по эпителию альвеол. На снимке выглядят как сетка или затемнение. Раковые клетки в описанном случае перемещаются лимфотоком. Течение вторичного рака при таком раскладе агрессивное по типу меланомы или саркомы.
- Метастазы смешанного типа. Часто встречающиеся на практике метастазирования, объединяющие очаговые и инфильтративные типы.
По количественному признаку:
- Солитарные – единичные метастазы (один вторичный очаг).
- Единичные – не более десяти очагов.
- Множественные.
- Односторонние – при поражении одного лёгкого.
- Двусторонние – поражаются оба парных органа.
Происхождение метастазов, адрес первоисточника ориентировочно возможно определить на КТ по цвету. Структура и состав аномальных вкраплений указывает, куда сориентировать внимание – где искать первичный очаг онкологии. Известковые составляющие метастазов подсказывают, что агрессия раковых клеток исходит либо из костной ткани, либо из поражённой почки.
Болезненные проявления на начальных этапах метастатического поражения лёгкого выявлены на практике лишь у небольшого количества пациентов. Площадь поверхности ткани лёгкого настолько велика, что относительно небольшие негативные вкрапления не влияют на состояние больного. Их обнаруживают на КТ случайно при контрольном исследовании.
Инфильтративные проникновения раковых клеток в лёгкое ухудшают самочувствие быстрее.
Начало метастазирования в лёгкие практически незаметно. На фоне общих симптомов онкологического заболевания – слабость, анемия, потеря веса, температура – тяжело определить признаки поражения лёгочной ткани. Опытный врач обратит внимание на неоднократные рецидивы простудных заболеваний и их продолжительность.
Для начальной стадии процесса вторичного рака в лёгких характерен сухой кашель, усиливающийся в ночное время.
Если поражена значительная часть лёгкого и отмечается сжатие в бронхах, одышка и мокрота представляет густую, гнойную жидкость с примесью крови. Когда метастазы из лёгочной ткани проникают в позвоночник, плевру, рёбра, развивается болевой синдром.
При метастазировании в лимфоузлы левой части средостения может возникнуть афония, осиплость голоса, при проникновении рака в лимфосистему правой части отёки образуются в верхней половине тела.
Симптомы последней стадии болезни:
- Из-за поражения шейных лимфатических узлов парализуются голосовые связки, в голосе появляется хриплость.
- Наблюдается полное отсутствие аппетита.
- Отмечается постоянная сонливость.
- Пропадает интерес ко всему, наступает апатия.
- Появляются галлюцинации, речь становится бессвязной.
- Отекают нижние конечности, выглядят отёкшими шея, лицо.
- Отказывают почки.
При метастазах по всему организму появляются мучительные боли. Облегчают состояние исключительно наркотические препараты.
Рентгенография. Лечение первичного злокачественного образования регулярно сопровождается рентгенографией органов грудного отдела. Но это не самый информативный вид обследования – описание выявляет лишь очаги более 1 см.
Компьютерная томография. Если выявлено затемнение в лёгких, правильнее назначить компьютерную томографию с использованием контрастного вещества. Указанный метод диагностики выявляет очаги менее 5 мм. В дальнейшем для контроля над динамикой процесса после лечения нужно будет периодически повторять КТ, чтобы не пропустить рецидив в виде мелких образований. Рентген их не заметит либо определит как доброкачественные.
Цитологическое исследование мокроты. Результат анализа дифференцирует злокачественные образования. Методом микроскопии исследуется порция утренней мокроты. Через шесть – семь дней результат покажет наличие либо отсутствие атипичных клеток.
Пункционная биопсия лёгкого. Прицельная пункция с целью получить биоматериал – клеточный биоптат. Выполняется под рентгеновским или ультразвуковым наблюдением с обезболиванием. Игла вводится через грудную стенку в опухоль и захватывает частицу поражённой ткани.
Схожую симптоматику имеют: пневмония, туберкулёз, киста лёгкого и доброкачественные опухоли лёгкого.
Ход алгоритма лечения определяют вид начального онкообразования, реакция опухоли на терапию. Ход мероприятий зависит от состояния пациента, обнаружены ли метастазы в иные органы.
Лечение онкологии сводится к уничтожению раковых клеток и препятствию их распространения. Основным способом считается химиотерапия – введение антинеопластических веществ через кровь и желудок. Лечатся химиотерапией обособленно и в комплексе с другими методами.
По решаемым задачам классифицируют:
- Адъювантную (исключаются оставшиеся фрагменты новообразований и рецидивы метастазов);
- Неоадъювантную (уменьшается размер опухоли и определяется степень восприятие клеток к лекарствам);
- Лечебную (уменьшение размера вторичной опухоли, общее улучшение самочувствия пациента).
Цель ионизированного облучения – воздействовать высокими дозами на опухоль локально, минимально затрагивая другие ткани. Для этого необходимо выявить точно, где расположено злокачественное образование, чтобы верно определить направление и глубину облучения.
При поражении лёгкого, возникшего из-за диссеминации гормонозависимых новообразований (рак молочной железы, простаты), назначается лечение медикаментозными средствами. Подобная терапия не проводится обособленно, а в комплексе с другими видами лечения.
Метод показан людям, если открытая операция сопровождается риском. Пациент подвергается облучению высокими дозами. Когда опухоль находится в труднодоступных для скальпеля местах либо рядом с жизненно важными органами.
Статистика показывает: оперировать больных с метастазами в лёгких стали намного чаще, с учётом того, что операция назначается крайне редко. Это говорит о распространённости указанного вида заболевания.
Оперативное вмешательство показано, если:
- отсутствует исходный очаг онкологии или рецидив;
- нет метастазов в другие части тела;
- не более трёх очагов метастазов в лёгкое;
- после первоначального лечения новообразования не появляются в течение года;
- временной интервал между первыми и вторыми метастазами – не менее полугода;
- пациент сможет вытерпеть продолжительное воздействие наркоза.
Размер опухоли определяет объём операции. Хирургическое вмешательство может быть направлено на иссечение фрагмента лёгкого – лобэктомия, либо на полное удаление органа – пульмэктомия. Радикальный метод увеличивает уровень выживаемости при онкологии лёгкого.
Это вид контактной радиотерапии предполагает нахождение радиоактивного имплантата непосредственно в бронхах.
Этот вид терапии применяется, когда исчерпаны все возможности радикальными способами вылечить пациента, но можно купировать болевые синдромы и хотя бы уменьшить симптомы болезни, замедлить процесс.
Поражённая опухолью часть лёгкого не участвует в процессе дыхания, вся нагрузка возлагается на оставшуюся здоровую ткань и парный орган. Но постепенно опухоль перестаёт реагировать на лечение и замещает большие объёмы. Пациент начинает испытывать затруднения с дыханием, развивается кислородная недостаточность. Недостаток кислорода испытывают все органы, особенно сосуды и сердце.
Симптомы кислородного голодания проявляются по признакам:
- Вначале наступает одышка при ходьбе и после физических нагрузок.
- Позднее эти симптомы беспокоят даже при незначительных нагрузках.
- В тяжёлом состоянии человек испытывает постоянное удушье, мучительный кашель, учащённое сердцебиение, слабость, отёки.
- Любое движение усугубляет ситуацию.
Недостаток кислорода возмещается кислородотерапией. Продолжительность сеанса по пятнадцать часов ежедневно. Такое лечение проводится в отделениях паллиативной медицины или хосписе.
В тяжёлых случаях недостаточно одной кислородотерапии, нужна искусственная вентиляция органов дыхания. Такая помощь способна облегчить тяжесть состояния пациента:
- облегчить дыхание;
- временно избавить дыхательную мышцу от нагрузки;
- восполнить кислород в крови;
- уменьшить воспаление на время;
- оказать психологическую поддержку.
Задачи паллиативной помощи – делать всё возможное для человека, жизнь которого осложнил злокачественный процесс.
Современные методы лечения позволяют точечно воздействовать на очаги метастазирования без вреда для здоровых органов. Используя терапии в комплексе, возможно в корне изменить жизнь пациента и продлить до десяти лет.
Сегодня обнаружение метастазов – не окончательный приговор. Чтобы снизить вероятность заболевания раком, рекомендуется регулярно обследоваться. Ранняя диагностика – определяющий фактор успешного лечения. Радикальное лечение источника метастазов будет залогом прекращения их возникновения. Использовав все возможности медицины, удастся продлить жизнь либо комфортно, без мучений провести отпущенное время.
источник
Метастатическим или вторичным раком легких называются опухоли, которым дают начало раковые клетки, попавшие в легочную ткань из других органов.
Статистика говорит о том, что у 30-55% онкологических больных обнаруживаются метастазы в легких. Злокачественные опухоли дают отсевы в лёгочную ткань: рак любого органа, саркомы, меланомы, заболевания кроветворной и лимфатической системы. Через лёгкие проходит вся кровь, и условия благоприятны для выживания бактерий, вирусов, грибов и опухолевых клеток.
Собирающий лимфу общий лимфатический проток несёт её в крупные вены, которые впадают в верхнюю полую вену. При посредстве правых отделов сердца венозная кровь, смешанная с лимфой, тоже проходит через лёгкие. Площадь структурных единиц, составляющих то, что мы называем лёгкими — лёгочных альвеол — более 150 квадратных метров. Достаточно места, изумительное полнокровие, прекрасные условия для размножения злокачественных клеток.
Иными словами, присутствуют благоприятные условия для распространения раковых клеток в легкие гематогенным (через кровь) и лимфогенным (через лимфатическую систему) путем.
Метастатические узлы бывают очень разными, считают, что по плотности они полное отражение первичной опухоли. Если определять плотность на ощупь, то все опухоли тяготеют к каменистости или, по крайней мере, к костной плотности. Но плотность для очагов в лёгких понятие относительное, прощупать их можно только во время операции, которую в метастатической стадии делают чрезвычайно редко. Плотность определяют при рентгенологическом исследовании преимущественно для дифференциальной диагностики, то есть поиска признаков характерных отличий одного заболевания от другого.
Формально метастазы делят на лимфогенные и гематогенные, то есть занесенные в лёгочную ткань с лимфой или кровью, но в каждом конкретном случае разобрать, что принесло раковую клетку в альвеолу вряд ли можно, и практикующему онкологу совсем ненужно, ведь это уже ничего не изменит. Какие бы ни были метастазы по пути распространения, их надо лечить.
Метастазы в лёгких бывают разными по форме, ее определяют по рентгеновским снимкам:
- Очаговые метастазы, которые на рентгеновском снимке видны образования разного диаметра. Традиционно этот вариант метастазирования считается проявлением менее агрессивной злокачественной опухоли. При небольшом распространении более благоприятно протекают именно очаговые образования. Они как раз считаются преимущественно гематогенными, то есть занесёнными кровью.
- Инфильтративные метастазы, когда опухолевые клетки расползаются по эпителиальной выстилке альвеол, что на рентгенограмме проявляется в виде сетки или разной формы затемнений. Такой вариант традиционно считают вариантом более агрессивной опухоли — агрессивные по течению меланомы и саркомы дают преимущественно очаговые, а не инфильтративные метастазы в лёгких. Эти вторичные проявления относят к лимфогенным.
- Смешанные метастазы — сочетание очаговых и инфильтративных «теней» в лёгких — частое явление в клинической практике.
По числу метастазы могут быть:
- солитарными – один очаг;
- единичными – не более десяти;
- множественными.
Метастатические узлы бывают мелкими и крупными, а ещё сливающимися друг с другом, односторонними, когда поражено одно лёгкое и двухсторонними.
Вокруг метастазов тоже могут жить бактерии, всё-таки по бронхиальному дереву проходит нестерильный воздух, а опухоль меняет местный иммунитет, и возникает воспаление. Когда внутренняя часть опухоли не получает достаточного питания — она отмирает, и в центре образуется полость распада. Если такая полость соединится с бронхом, то в неё могут попасть бактерии, и полость заполнится гноем.
Плевра — пленка из соединительной ткани. Она состоит из двух листков: один покрывает снаружи легкие, а другой выстилает изнутри стенки грудной полости. Плевра интимно спаяна с лёгким. В ней тоже могут возникнуть метастазы, но намного реже. Опухоли из легких могут прорастать в плевру и наоборот. Зачастую в легких обнаруживаются метастазы, а плевра не поражена.
При подозрении на метастазы в легких прибегают к следующим методам диагностики:
- Рентгенография. Простой и быстрый, но не самый информативный метод диагностики. Обычно на снимках можно увидеть только опухоли размером более 1 см;
- Компьютерная томография. Позволяет обнаружить очаги менее 5 мм. Это недоступно для рентгенографии и МРТ;
- Биопсия легкого. Обычно проводится при помощи иглы. Получают небольшой фрагмент ткани опухоли для исследования;
- Бронхоскопия. Эндоскопическое исследование, во время которого специальный инструмент с источником света и видеокамерой — бронхоскоп — вводят в бронхиальное дерево. Во время процедуры можно провести биопсию.
Как правило, динамическое наблюдение за онкологическим пациентом после лечения первичной опухоли предполагает регулярную рентгенографию органов грудной клетки. При выявлении теней в лёгких, правильно будет сделать компьютерную томографию с введением контрастного вещества. КТ способна выявить очаги меньше 5 мм, что недоступно магнитно-резонансной томографии. В дальнейшем для контроля динамики процесса после лечения также необходимо будет делать КТ.
Бессмысленно перед лечением делать КТ, а после перейти на обычную рентгенографию лёгких, пытаясь сравнивать снимки, чтобы выявить отличие прошлого состояния лёгких с настоящим. КТ обнаружит более мелкие образования, рентген способен в лучшем варианте выявить очаги более 1 см, то есть опухоли меньше сантиметра «выпадают» из-под контроля, когда нет возможности сделать контрольное КТ-обследование. Нельзя оценивать эффект лечения по паре видимых крупных очагов. Некоторые опухоли от химиотерапии уменьшаются, какие-то увеличиваются, а другие месяцами стабильны.
Клинические признаки метастазов в лёгких зависят от обширности поражения и присоединения воспалительных изменений.
- боль в груди;
- упорный кашель;
- примесь крови в мокроте;
- ослабленное дыхание;
- хрипы;
- слабость;
- снижение веса.
При одиночных очагах округлой формы, небольшого размера никаких признаков поражения может и не быть, их часто случайно обнаруживают при контрольном обследовании. Площадь лёгких огромна, и несколько квадратных сантиметров опухолевого поражения альвеол не отразятся на газообмене и состоянии пациента. Множество теней, когда их уже не пересчитать, ухудшат самочувствие, провоцируя сухой кашель, плохо откликающийся на средства от кашля.
Инфильтративные метастазы раньше меняют самочувствие, поскольку к ним часто присоединяется воспаление окружающей опухоль ткани – пневмонит. Появляется кашель, может быть температура, слабость, почти как пневмония, но чуть-чуть полегче. Закупорка бронха опухолью приведёт к ателектазу – полной безвоздушности части лёгкого, присоединение инфекции существенно ухудшит состояние, повысится температура, появится одышка. Приём антибиотиков помогает снять воспаление и самочувствие улучшается, но ненадолго, потому что опухоль растёт, и безвоздушная часть лёгкого тоже увеличивается. И опять воспаляется, так и идёт по замкнутому кругу.
Сегодня оперировать метастазы в лёгких стали чаще, чем раньше, но всё-таки операции делают довольно редко. Радикальное лечение метастазов в лёгкие – оперативное в принципе возможно при определённых условиях:
- не должно быть первичной опухоли или рецидива;
- не должно быть метастазов в других органах;
- метастаз в лёгком очаговый и единственный или не более 3 очагов;
- скорость прогрессирования опухолевого процесса должна быть невысокой, как правило, после радикального лечения первичной опухоли до появления метастаза должно пройти более года;
- со времени появления метастаза в лёгком в течение полугода не должно появиться других метастазов;
- состояние пациента должно позволять довольно сложное оперативное вмешательство, потому что во время операции реальная ситуация может оказаться значительно хуже, чем описывалась при компьютерной томографии, и придётся удалять больше запланированного.
Основное лечение метастазов в лёгких – химиотерапия, схема которой определяется первичной опухолью, при раке молочной железы ещё и гормональная терапия, естественно, при наличии чувствительности к ней.
Лучевая терапия множественных метастазов в лёгких проводилась в экспериментальных группах, результаты неудовлетворительные. При единственном довольно крупном очаге облучение возможно, но эффективность много хуже, чем при раке лёгкого. Наличие метастаза, где бы то ни было, показатель диссеминации — разброса злокачественных клеток, что не предполагает хорошего прогноза в отношении возможности полного излечения.
Метастазы в любом органе говорят о том, что защитные силы организма исчерпаны, опухолевые клетки успели распространиться по разным органам. Ремиссия в большинстве случаев невозможна. Но это не означает, что врач совсем ничего не может сделать. Паллиативное лечение поможет продлить жизнь, избавит от мучительных симптомов.
Часть легкого, занятая опухолью, выключается из процесса дыхания. Поначалу оставшаяся здоровая ткань успешно справляется и работает за целое легкое. Но постепенно опухоль растет, перестает реагировать на химиотерапию и занимает все больше места.Наступает момент, когда оставшаяся здоровая ткань перестает справляться. Легкие больше не могут обеспечить организм нужным количеством кислорода, развивается дыхательная недостаточность. Кислородное голодание затрагивает все органы, в первую очередь — сердечно-сосудистую систему.
Симптомы дыхательной недостаточности нарастают постепенно:
- Поначалу возникает лишь одышка после ходьбы и физических нагрузок;
- Затем одышка начинает беспокоить при минимальных нагрузках, при любой движении;
- В тяжелых случаях человек задыхается постоянно, даже когда лежит в постели. Больного мучит постоянный кашель, слабость, на ногах появляются отеки, сердцебиение учащается. Стоит совершить небольшое движение, и все симптомы усиливаются на порядок.
Страдания больного может облегчить кислородотерапия. Но проводить ее нужно по 15 часов в день. Существуют специальные дыхательные маски, их можно приобрести, и все же проводить такое лечение в домашних условиях очень сложно.
Государственные онкологические клиники не госпитализируют таких пациентов в экстренном порядке. Помощь можно получить в отделении паллиативной медицины, но таких в Росии пока еще очень мало. В обычном стационаре практически ничем не помогут. Кислородотерапию можно получить в хосписе, но там практически нет симптоматической терапии. При тяжелой дыхательной недостаточности одной кислородотерапии недостаточно. Нужна дыхательная поддержка — искусственная вентиляция легких. В данном случае ИВЛ проводят через маску, интубацию трахеи не проводят.
Такое лечение не избавит от рака и не уничтожит метастазы, но оно способно сильно облегчить состояние больного:
- уменьшится одышка;
- отдохнуть дыхательные мышцы, которым в последнее время пришлось интенсивно работать;
- нормализуется состав крови, уменьшится кислородное голодание;
- уменьшатся даже воспалительные изменения в легких;
- в конце концов, человек перестанет задыхаться, улучшится качество жизни.
Помочь человеку с тяжелым нарушением дыхания в домашних условиях невозможно. Родные постоянно слышат, как он тяжело дышит, хрипит, кашляет, но помочь ничем не могут. Страдают все.
Врачи онкологи и реаниматологи Европейской онкологической клиники знают, как помочь пациенту с метастатическим раком легких в рамках паллиативной помощи. Грамотное лечение избавит от тяжелых симптомов, подарит драгоценное время.
источник
Метастазы в легкие – вторичные новообразования, возникшие при миграции злокачественных клеток из другого органа. На начальной стадии проявляются симптомами общей интоксикации и повторяющимися простудными заболеваниями. В последующем появляются одышка, боли в области грудной клетки и кашель с примесью крови. Диагноз выставляется с учетом клинических проявлений, данных рентгенографии, КТ грудной клетки, гистологических и цитологических исследований. Лечение – химиотерапия, радиотерапия, лазерная резекция, радиохирургия и традиционные хирургические вмешательства.
Метастазы в легкие – вторичные злокачественные очаги в легочной ткани. Возможен лимфогенный, гематогенный или имплантационный путь миграции клеток из новообразования, расположенного в другом органе. Являются одними из самых распространенных вторичных опухолей. Среди пациентов преобладают мужчины старше 60 лет. Прогноз при метастазах в легких обычно неблагоприятный. Из-за множественного метастазирования, позднего обнаружения очагов в легочной ткани и сопутствующего поражения других органов радикальное лечение, как правило, невозможно. Исключением являются солитарные метастазы в легких, возникшие спустя долгое время после проведения специфической терапии либо оперативного удаления первичного новообразования. Лечение проводят специалисты в сфере онкологии и пульмонологии.
Причиной частого поражения легочной ткани при злокачественных новообразованиях различной локализации является хорошо развитая сеть кровеносных и лимфатических сосудов в ткани легкого. Клетки первичной опухоли мигрируют по лимфатической или кровеносной системе, оседают в легочной ткани или под плеврой и дают начало метастазам.
Кроме того, возможно имплантационное (аспирационное) метастазирование, при котором злокачественные клетки распространяются по бронхам из распадающегося новообразования верхних дыхательных путей, бронха, легкого или агрессивно растущей опухоли близлежащего органа. Вторичные опухоли в легочной ткани могут сами становиться источником метастазов в других органах.
Метастазы в легких чаще диагностируются при первичном раке молочной железы, желудка, пищевода, мочевого пузыря, колоректальном раке, раке простаты, печени, меланоме и опухолях почек, но могут выявляться и при других онкологических заболеваниях. Обычно представляют собой узлы диаметром от нескольких миллиметров до 5 и более сантиметров. Чаще бывают множественными. Метастазы в легких при меланоме могут быть коричневыми, буровато-черными, белыми или частично пигментированными. Узлы при саркоме и раке – белыми либо розовато-серыми. Реже метастазы в легких представляют собой диффузную сеть, распространяющуюся под плеврой и в толще легочной ткани – такие вторичные новообразования обнаруживаются при раковом лимфангите, обусловленном миграцией злокачественных клеток по лимфатическим сосудам.
Метастатические очаги в легких классифицируют по нескольким признакам:
- По типу новообразований: очаговые и инфильтративные формы.
- По количеству вторичных опухолей: солитарные (одиночные), единичные (не более 3), множественные (более 3).
- По диаметру: крупные и мелкие.
- По локализации: односторонние и двухсторонние.
С учетом особенностей распространения различают две формы метастазов в легких: диссеминированную и медиастинальную. При диссеминированной форме в легочной ткани выявляются множественные вторичные опухоли (как правило – преимущественно в нижних отделах). При медиастинальной форме вначале поражаются лимфатические узлы средостения, а потом опухолевые клетки по лимфатическим сосудам мигрируют в ткань легкого. С учетом особенностей рентгенологической картины выделяют четыре формы метастазов в легкие:
- Узловая. Включает в себя солитарную и множественную формы. На рентгенограммах выявляются узлы с четкими контурами, локализующиеся преимущественно в нижних отделах. Легочная ткань за пределами очагов сохраняет свою нормальную структуру.
- Псевдопневматическая (диффузно-лимфатическая). На снимках обнаруживаются множественные тонкие тяжи уплотненной ткани, расположенные в перибронхиальной зоне. Ближе к очагу тяжи имеют расплывчатые контуры, по мере удаления границы уплотнений становятся более четкими.
- Плевральная. Напоминает картину экссудативного плеврита. В плевральной полости может выявляться выпот. На поверхности легких обнаруживаются бугристые напластования.
- Смешанная. Наблюдается сочетание двух или более вышеописанных форм.
При определении тактики лечения метастазов в легких имеет значение степень чувствительности опухоли к различным видам терапии. С учетом этого показателя можно условно выделить следующие типы метастазов в легких:
- Реагирующие на радиотерапию и химиотерапию (при остеогенной саркоме, раке яичника и раке яичка).
- Устойчивые к химиотерапии (при раке шейки матки и меланоме).
- Реагирующие на гормональную терапию (при гормональноактивных новообразованиях половых органов).
На начальной стадии метастазы в легкие обычно протекают бессимптомно. Могут выявляться общие признаки онкологического заболевания: немотивированная слабость, апатия, анемия, потеря аппетита, снижение массы тела, повышение температуры тела. Первым проявлением метастазов в легкие обычно становятся повторяющиеся простудные заболевания: грипп, бронхит, пневмония. Иногда симптомы возникают только на заключительной стадии, при множественных узлах в легких, вовлечении бронхов и плевры.
При поражении значительной части легкого либо сдавлении бронха развивается одышка. Кашель при метастазах в легких вначале сухой, чаще возникает по ночам. В последующем появляется слизисто-гнойная мокрота без запаха, нередко – с примесью крови. При сужении бронхов мокрота становится более густой, гнойной. Возможны легочные кровотечения. Метастазы в легкие, распространяющиеся на плевру, ребра и позвоночник, провоцируют развитие болевого синдрома. При метастазах в лимфоузлах левой части средостения может наблюдаться осиплость голоса и афония, при поражении лимфоузлов правой части средостения – отек верхней половины тела, обусловленный сдавлением верхней полой вены.
Диагноз выставляется с учетом анамнеза, клинических проявлений, результатов инструментальных и лабораторных исследований. Пациентов с подозрением на метастазы в легких направляют на рентгенографию грудной клетки, позволяющую оценивать состояние легочной ткани, определять тип, характер и количество вторичных новообразований, наличие выпота в плевральной полости. Пациентам также назначают КТ легких – эта современная методика дает возможность выявлять мелкие метастазы диаметром менее 0,5 мм, в том числе расположенные субплеврально.
При необходимости снизить лучевую нагрузку (при метастазах в легких у детей, при многочисленных исследованиях для выявления первичного очага и метастатических поражений других органов, при продолжительном наблюдении) и подозрении на наличие мелких метастазов проводят МРТ легких – эта методика позволяет обнаруживать вторичные очаги диаметром менее 0,3 мм. Метастазы в легкие подтверждают на основании результатов цитологического исследования мокроты и плеврального выпота или гистологического исследования биоптата, полученного в процессе бронхоскопии, чрескожной пункционной биопсии легкого или (реже) открытой биопсии.
Для выявления метастазов других локализаций проводят расширенное обследование, включающее в себя УЗИ органов брюшной полости, сцинтиграфию костей скелета, КТ и МРТ позвоночника, КТ и МРТ головного мозга, УЗИ органов малого таза, УЗИ забрюшинного пространства и другие исследования. Метастазы в легкие дифференцируют с периферическим раком легких, доброкачественным новообразованием легкого, пневмонией, кистой легкого и туберкулемой.
Лечебная тактика определяется видом первичной опухоли, ее реакцией на терапию, количеством и диаметром метастазов в легких, наличием или отсутствием метастатического поражения других органов, общим состоянием пациента и некоторыми другими факторами. Основной лечебной методикой обычно является химиотерапия, которая может применяться изолированно или в сочетании с другими методами. При метастазах в легких, возникших при диссеминации гормонозависимых опухолей, назначают гормональную терапию. Наилучший эффект гормонального лечения отмечается при раке простаты и раке молочной железы.
Радиотерапию назначают при вторичных очагах ретикулосаркомы, саркомы Юинга, остеогенной саркомы и некоторых других опухолей, чувствительных к лучевому воздействию. Показания к хирургическому лечению при метастазах в легких ограничены. Оперативное вмешательство целесообразно при одиночных метастазах, изолированном поражении периферической части легкого, контролируемом первичном новообразовании и отсутствии метастазов в другие органы. Иногда двухэтапную резекцию легкого и резекцию печени выполняют при одиночных метастазах в легком и метастатическом раке печени. В ряде случаев применяют радиохирургию либо осуществляют лазерную резекцию вторичного очага. При сдавлении крупных бронхов производят эндобронхиальную брахитерапию.
Прогностически неблагоприятными факторами считаются появление метастазов в легких ранее, чем через год после радикального лечения первичного новообразования, диаметр узлов более 5 см, быстрый рост вторичных очагов и увеличение внутригрудных лимфоузлов. Длительное выживание в некоторых случаях возможно после хирургических вмешательств по поводу одиночных метастазов в легких, возникших спустя год и более после радикального лечения первичной опухоли.
К числу факторов, не оказывающих существенного влияния на продолжительность жизни при метастазах в легких, относят локализацию вторичного очага (центральный или периферический), сторону поражения, наличие либо отсутствие метастатического поражения плевры. Пятилетняя выживаемость пациентов с одиночными метастазами в легких после проведения комбинированной терапии составляет около 40%. Наилучшие результаты отмечаются при первичных новообразованиях тела матки, костей, почек, молочной железы и мягких тканей.
источник
Вторичные очаги могут встречаться как в левом, так и в правом легком. Легочные метастазы подразделяют по признакам на такие группы, как:
- Односторонние и двухсторонние;
- Крупные и мелкие;
- Солитарный (единичный) и множественные;
- Очаговые и инфильтративные;
- Узловые метастазы;
- В виде тканевых тяжей.
При появлении SUSP-подозрения на вторичную онкологию следует пройти обследование.
На ранних стадиях метастазы в легких никак себя не проявляют, болезнь протекает бессимптомно. Распадаясь, клетки раковой опухоли выделяют токсичные вещества, отравляющие организм. Больной обращается за медицинской помощью чаще на последней, терминальной стадии рака.
Наличие вторичных очагов онкологии в легких сопровождается следующими симптомами:
- Частая одышка, появляющаяся не только во время физической нагрузки, но и в состоянии покоя;
- Регулярный сухой кашель, переходящий во влажный, который можно спутать с другим заболеванием;
- Мокрота с примесью крови;
- Боль в грудной клетке, которая не проходит даже с приемом обезболивающих средств. Уменьшить болевой синдром способны лишь наркотические препараты;
- Отек лица и верхних конечностей при локализации вторичного очага в правом легком, головные боли.
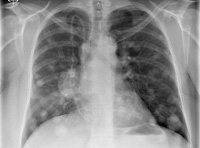
Узловые метастазы проявляются в единичной или множественной форме. Единичные, или солитарные образования, выглядят как округлые узелки, напоминающие первичный очаг онкологии. Чаще всего формируются они в базальной ткани.
Если вторичный генез носит псевдопневманическую форму, то на рентгене он отображается в виде тонких линейных образований.
При метастазировании в плевру на рентгеновских снимках видны крупные бугристые образования, в результате прогрессирования которых ухудшается состояние онкобольного и развивается легочная недостаточность.
Продолжительность жизни при метастазировании легких зависит от того, как быстро выявлен вторичный рак.
При выявлении у себя хотя бы одного из вышеперечисленных симптомов следует незамедлительно обратиться к врачу и пройти обследование. В медицинской практике бывали случаи обнаружения легочных метастазов задолго до момента выявления первичного очага опухоли.
Прогрессирование вторичной опухоли вызывает интоксикацию организма в целом. Чтобы выявить у себя наличие метастазов, следует знать, как проявляются симптомы заболевания. Первыми признаками прогрессирования вторичного рака в легких являются:
- Снижение аппетита и как следствие массы тела;
- Общее недомогание, быстрая утомляемость и снижение работоспособности;
- Повышение температуры тела, приобретающее хронический характер;
- Сухой кашель при метастазах становится постоянным.
* Только при условии получения данных о заболевании пациента, представитель клиники сможет рассчитать точную смету на лечение.
Встречаются такие формы первичного рака легкого, которые прогрессируют не так стремительно, как мелкоклеточный рак. Это плоскоклеточный, крупноклеточный рак и аденокарцинома. Эти формы рака лечатся оперативным путем. При своевременном проведении операции, прогноз на выздоровление будет хороший. Если пошли метастазы в другие органы, то пациента ожидает смертельный исход.
Для выявления наличия вторичного генеза в легком применяются следующие методы диагностирования:
- Рентгенография – исследует структуру тканей легких, выявляет затемнения, месторасположение метастаза и его размеры. Для этого делается два снимка – спереди и сбоку. На снимках множественные метастазы представляются в виде округлых узелков;
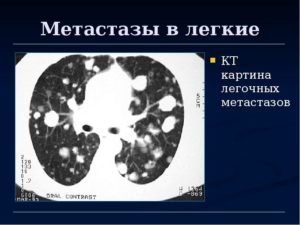
- Компьютерная томография – служит дополнением рентгенографии. На КТ видны области, где локализуются метастатические опухоли, каковы их размеры и форма. С помощью КТ выявляют секундарные изменения в легких;
- Магнитно-резонансная томография – назначается людям, ранее подвергавшимся облучению, а также детям. Такое исследование позволяет выявить вторичные новообразования, размеры которых едва достигают 0,3 мм.
В современной медицине для лечения метастазов в легких применяются следующие методы:
- Хирургическое вмешательство – производится удаление пораженного участка. Такой метод лечения эффективен лишь в случае, если имеется одиночное очаговое поражение, поэтому его применяют достаточно редко;
- Химиотерапия – служит дополнением к другим методам лечения. Продолжительность курса химиотерапии зависит от основного метода лечения и самочувствия больного. В медицинской практике химиотерапию применяют совместно с лучевой терапией. Для поднятия уровня лейкоцитов в крови после процедуры назначается дексаметазон;
- Лучевая терапия – позволяет замедлить активный рост раковых клеток и уменьшает боли. Облучение производится в стационарных условиях дистанционным способом;
- Гормональная терапия – применяется при наличии гормоночувствительного первичного очага в предстательной или молочной железах. Служит дополнением к основной терапии;
- Радиохирургия – процедура позволяет посредством кибер-ножа (пучка лучей) удалять труднодоступные опухоли.
Инвалидность при раке легкого оформляется в случае удаления одной доли.

В заключение можно сказать, что встречаются различные формы поражения легких онкологией. Это и первичный рак, и метастазы, перешедшие из других очагов. Болезнь может протекать бессимптомно, а это означает, что больной может обратиться за помощью тогда, когда лечение уже не даст нужного результата.
Прогноз на выживаемость зависит от стадии заболевания, вида, формы и местоположения опухолей.
источник
Легкие, как известно, являются одним из органов, в которых наиболее часто локализуются отдаленные метастазы, выявляемые в процессе обследования или возникающие в различные сроки после лечения злокачественных новообразований.
При обследовании метастазы в легких обнаруживают у 6-15% больных со злокачественными опухолями любой локализации, а после лечения в случае прогрессирования опухолевого процесса они поражают преимущественно легкие.
По данным вскрытий, легочные метастазы чаще выявляют при раке органов мочеполового тракта, молочной железы, хорионэпителиоме и саркомах.
Метастазирование первичной опухоли в легкие часто «завершает судьбу» онкологического больного.
Метастазы в легких подразделяют на одиночные (солитарные), единичные (2-3) и множественные, причем они бывают односторонними или двусторонними. Большинство метастазов реализуется в ближайшие 2-3 года после лечения первичной опухоли, однако они могут выявляться и через 10-25 лет.
Метастазирование опухолей в легкие осуществляется преимущественно гематогенным путем, реже — лимфогенным, бронхогенным или per continuitatem. Микроэмболы, содержащие опухолевые клетки, оседают в мельчайших сосудах легкого и дают начало развитию метастазов, которые чаще локализуются в плащевой зоне легких. На первых этапах развития метастазы обычно хорошо отграничены от окружающей легочной ткани.
В дальнейшем распространение опухолевых клеток по направлению от субплевральных отделов к корню легкого по лимфатическим сосудам, периваскулярной и перибронхиальной клечатке приводит к развитию метастатического поражения лимфатических узлов бронхопульмональных, корня легкого и средостения, т.е. источником лимфогенных метастазов являются гематогенные. При тотальном поражении легких развивается картина ортоградного ракового лимфангита.
Гематогенные метастатические опухоли легких могут поражать стенку крупного бронха, при этом клиническая и рентгенологическая семиотика напоминает проявления первичной злокачественной опухоли.
Возможно также изолированное поражение висцеральной плевры в виде одиночных узловых образований, просовидных диссеминатов или инфильтратов без четких границ с плевральным выпотом или без него.
Осложнениями при солитарных, единичных и множественных метастазах являются перифокальная пневмония, распад в опухолевом узле, спонтанный пневмоторакс, гиповентиляция сегмента или доли, пневмония с абсцедированием, плеврит и эмпиема плевры.
Проблема диагностики и дифференциальной диагностики метастатических опухолей легких широко освещена в литературе. На начальных этапах развития метастазы в легких протекают бессимптомно, и их выявляют случайно при рентгенологическом исследовании.
В большинстве случаев они локализуются в плашевой зоне легкого и не поражают бронхи. Клинические симптомы наблюдаются у половины больных, чаще при развитии осложнений. Симптомы зависят также от характера метастатического процесса в легких.
Наиболее часто отмечаются кашель, одышка, боли в груди, повышение температуры тела, редко бывают кровохарканье, слабость, похудание. Некоторые опухоли имеют склонность метастазировать в подслизистую оболочку бронхов, при этом симптоматика может быть ранней. Такой путь метастазирования может иметь место при меланоме, несеминоматозных эмбриональных опухолях и раке почки.
Следует отметить, что, поскольку клинические проявления солитарного метастаза в легком скудны и непатогномоничны для данного заболевания, его обычно диагностируют при контрольном рентгенологическом исследованиии после излечения злокачественной опухоли.
В связи с этим рентгенологическое исследование является основным в диагностике метастатических опухолей легких и регулярный контроль (рентгенография и томография органов грудной клетки) обязателен для всех онкологических больных.
При этом необходимо учитывать, что метастатические узлы в легком имеют различную плотность, которая соответствует таковой первичной опухоли: метастазы хорионэпителиомы имеют низкую плотность, метастазы остеогенной саркомы и аденокарциномы легкого способны к образованию патологической костной ткани, а метастазы рака щитовидной и молочной желез, ободочной кишки — к петрификации (Германов А.Б., 1996).
Значительные трудности вызывает дифференциация солитарных метастазов и первично-множественного периферического рака легкого, особенно при расположении метастатического узла у корня легкого и последующем прорастании в близлежащий бронх с рентгенологической семиотикой центрального рака легкого. К этому следует добавить, что иногда метастазы могут развиваться непосредственно в стенке бронха.
Изучение локализации опухоли округлой формы в легком показало, что как первичный рак, так и метастаз могут развиться практически в любой доле, однако для метастаза более характерно поражение нижних долей, а для первичного рака — верхних.
Метастатические опухоли легких, как правило, располагаются в периферических отделах, редко вовлекая в процесс крупные бронхи и висцеральную плевру, поэтому поражение крупных бронхов опухолью обычно является свидетельством ее первичного происхождения.
При сопоставлении частоты выявления ряда рентгенологических симптомов неосложненного периферического рака легкого и метастатической опухоли легкого установлены их достоверные отличительные признаки (табл. 12.1).
Таблица 12.1. Частота выявления рентгенологических симптомов периферичекого рака и солитарного метастаза в легком
В большинстве случаев на основании комплекса рентгенологических симптомов можно с достаточной определенностью предположить характер солитарной тени в легком. В этом велика роль компьютерной томографии.
Совокупность характерных рентгенологических признаков позволяет предположить локализацию первичной опухоли. Так, например, для метастазов рака почки характерны: поражение легочной ткани в сочетании с увеличением лимфатических узлов корня легкого и средостения; относительно небольшое количество различных по размеру (диаметром 1-6 см) узлов в легких; редкое выявление ракового лимфангита и милиарного карциноматоза.
Положительный онкологический анамнез при солитарном узле в легком облегчает установление предположительного диагноза, но при этом нужно помнить об увеличивающейся частоте развития первично-множественных синхронных и метахронных опухолей с поражением легкого и других органов.
Нами изучены результаты хирургического лечения 219 больных с округлыми образованиями в легком, ранее леченных по поводу злокачественных опухолей различных локализаций (табл. 12.2).
Таблица 12.2. Окончательный диагноз при выявлении округлого образования в легком у больных, ранее леченных по поводу злокачественных опухолей
*У 3 пациентов ранее проведено лечение по поводу рака молочной железы, у 8 — рака шейки или тела матки.
**У 7 больных ранее проведено лечение по поводу базально-клеточного рака кожи, у одного — меланомы.
При интраоперационном и плановом морфологическом исследовании операционных препаратов у 139 (63,4%) больных диагностирован метастаз, у 80 (36,6%) — метахронный периферический рак легкого как проявление первично-множественных злокачественных опухолей.
После лечения больных раком органов пищеварительного тракта, почки, молочной железы и матки у 80,3-84,6% из них солитарная тень в легком является метастазом, у остальных 15,4-19,7% — первичным периферическим метахронным раком легкого. У всех больных с саркомами мягких тканей и костей выявленная после лечения одиночная тень в легком оказалась метастазом.
Наоборот, после лечения рака легкого и опухолей органов головы и шеи солитарная тень в легком в 75-84% случаев была отображением метахронного первичного периферического рака. При злокачественных опухолях кожи тень в легком с одинаковой частотой может быть солитарным метастазом или первичным раком.
Компьютерная томография имеет значительно большие разрешающие возможности, чем рутинное рентгенологическое исследование (Седых С.А., 1998; Holmes Е.С., 1996). Она позволяет выявить все метастатические узлы диаметром более 3 мм.
Магнитно-резонансная томография в этом отношении уступает компьютерной томографии, однако при вовлечении в опухолевый процесс легочных вен и предсердия предпочтение следует отдавать магнитно-резонансной томографии и чреспищеводному ультразвуковому исследованию.
Эти методы должны быть применены у всех больных, особенно если по результатам рентгенологического исследования метастаз расценен как солитарный и обсуждаются показания к хирургическому лечению. Вместе с тем на основании результатов комплексного обследования (рентгенография, компьютерная и магнитно-резонансная томография, бронхоскопия) можно предположить локализацию, размеры и количество метастазов, а также резектабельность.
По данным J. Vogt-Moykopf и соавт. (1994), располагающих опытом выполнения 843 торакотомии у 729 больных с метастазами в легких, точно определить количество узлов удалось лишь у 39% больных, у 38% имела место гиподиагностика, т.е. количество узлов, установленное перед операцией, было меньше, чем их количество, выявленное во время операции, а у 23% — гипердиагностика.
Бронхологическое исследование у этого контингента больных малорезультативно, за исключением случаев метастазирования в стенку бронхов или прорастания их. Бронхоскопия под наркозом по показаниям может быть выполнена перед торакотомией.
В последние годы получил развитие результативный метод уточняющей диагностики — видеоторакоскопия (Сигал Е.И., Хамидуллин Р.Г., 1998; Kodama Ket al., 1991; Shyder C.L. et al., 1991; Miller D.L. et al., 1992; Roth J.A., Putnam J.B., 1994).
Методы морфологической верификации легочных метастазов и оценки степени распространения опухолевого процесса в лимфатические узлы и плевру аналогичны таковым пои первичной злокачественной опухоли.
При солитарном метастазе проводят дифференциальную диагностику с периферическим раком, злокачественной неэпителиальной опухолью, карциноидом легкого, доброкачественной опухолью, очаговыми поражениями неопухолевого характера. До лечения она основывается на морфологическом подтверждении диагноза с учетом анамнеза.
В сомнительных случаях выполняют диагностическую торакотомию с тотальной биопсией и при установлении первичности злокачественной опухоли легкого операцию расширяют до необходимого объема. У 15-20% больных окончательный диагноз солитарного метастаза удается установить лишь после планового гистологического исследования удаленной опухоли.
Метастатическое поражение легких, особенно при солитарном узле или единичных узлах, не всегда свидетельствует о диссеминации опухолевого процесса. Эти больные не должны оставаться без активной терапевтической помоши, поскольку открыты возможности их лечения и продления жизни благодаря сотрудничеству химиотерапевтов, радиологов и хирургов.
Несмотря на совершенствование методов химиотерапии и лучевого лечения больных с метастазами в легких, а также повышение их эффективности, показания к хирургическому лечению в последние годы расширяются, особенно при солитарном метастазе.
Еще в 1952 г. Н.И. Неговский привел данные о 190 больных с метастатическими опухолями легких, из которых у 13,7% были солитарные узлы, а по сводным данным Н.И. Рыбаковой (1964), они выявлены у 63 (11,1%) из 566 больных. Л.А. Атанасян и соавт. (1977), обобщив сведения литературы, установили, что солитарные метастазы в легких наблюдаются у 11-15% больных с метастатическим поражением этого органа.
Таким образом, потенциально хирургическое лечение может быть проведено значительному числу больных. К этому следует добавить, что вопрос об операции возникает при единичных метастазах, а также у ряда больных с множественными метастатическими опухолями, если они локализуются в одном легком или одной доле.
Выбор метода лечения больных с метастазами в легких зависит от локализации и гистологической структуры первичной опухоли, характера ранее проведенного лечения и его эффективности, сроков выявления метастазов, их количества и локализации в легком, плевре и внутригрудных лимфатических узлах.
В клинической практике легочные метастазы принято делить на три группы:
• I группа — метастазы, чувствительные к химиотерапии и лучевому лечению (рак яичка, остеосаркома).
• II группа — метастазы, почти полностью резистентные к указанному лечению (гипернефрома, меланома, хондросаркома, высокодифференцированый железистый рак толстой кишки и эндометрия, плоскоклеточный рак шейки матки).
• III группа — метастазы опухолей всех других локализаций, т.е. промежуточная между I и II группой.
При определении показаний к хирургическому лечению учитывают биологические особенности первичной опухоли — гистологическую структуру и степень ее дифференцировки, а также количество метастазов (солитарный, единичные множественные).
При метастазах II группы в первую очередь следует решите вопрос о возможности их хирургического удаления, тем более что метастазы у больных с первичной опухолью перечисленных локализаций наиболее часто (в 40-60%) являются солитарными. При легочных метастазах III группы нередко вначале проводят противоопухолевое лечение с учетом чувствительности первичной опухоли к лучевой и лекарственной терапии.
В тех случаях когда они неэффективны или по разным причинам провести их невозможно, операция становится единственным методом оказания помощи этому многочисленному контингенту больных.
К 1969 г., поданным Б.К. Поддубного (1977), в мировой литературе имелись сообщения о 700 успешных операциях, выполненных по поводу соли гарных метастатических опухолей легких. Значительная продолжительность жизни больных после таких операций свидетельствует о том, что в ряде случаев солитарный метастатический узел в легком действительно является единственным признаком рецидива заболевания.
В самом деле, в 1965 г. N.R. Thomford и соавт. (1965) сообщают о 31% 5-летней выживаемости больных с односторонним одиночным легочным метастазом. Впоследствии другие авторы (Morton D.L. et al., 1973; McCormack P.M., Martini N., 1979; Huth J.F. et al., 1980) расширили показания к хирургическому лечению, включив в число тех, кому его следует проводить, больных с множественными двусторонними метастатическими опухолями в легких.
В последние десятилетия задачи и возможности хирургического метода при метастатических опухолях легких заметно расширились.
Оперативное вмешательство предусматривает:
• «радикальное» удаление солитарного, единичных или «рецидивных» метастазов в надежде продлить жизнь пациентов и улучшить ее качество;
• паллиативную резекцию с целью предупреждения или устранения кровотечения, болей, стеноза бронха, пневмоторакса, поскольку этого невозможно добиться консервативными методами;
• резекцию с целью уменьшения массы опухоли и последующего применения других, нехирургических методов лечения;
• изучение свойств опухоли (после предоперационной химиотерапии, определение гормональных рецепторов, чувствительности и резистентности к химиопрепаратам).
Обязательными условиями отбора больных, у которых можно планировать хирургическое «радикальное» удаление метастазов в легких, являются:
• первичная опухоль должна быть надежно излечена (проведено «радикальное» лечение);
• гистологический тип первичной опухоли установлен;
• метастазы должны быть только в легком без признаков поражения внутригрудных лимфатических узлов и других органов ( применение наиболее результативных и адекватных методов диагностики — компьютерная томография (КТ), магнитно-резонансная томография (МРТ), ультразвуковое иследование (УЗИ), сканирование костей, опухолевые маркеры и др.);
• возможность удаления всех метастазов с помощью одной операции или более;
• риск оперативного вмешательства не должен быть высоким (достаточный функциональный резерв оставляемых отделов легкого).
Хирургическое лечение проводят не более чем у 10-20 % больных с метастазами в легких, причем резекция возможна у 80-98% из них. Принцип оперативных вмешательств при этой патологии — щадящий.
Наиболее распространены экономные операции типа клиновидной или краевой сублобарной резекции, анатомической сегментэктомии. По материалам J. Vogt-Moykopf и соавт. (1994), удельный вес атипичной резекции или сегментэктомии составляет 69% (в 580 из 843 торакотомии), а по данным P. Goldstraw (1994) — 73,7% ( в 179 из 243).
Лоб- и билобэктомию производят в среднем у 22% больных, по данным этих авторов, — в 23 и 20% соответственно. Пневмонэктомию или расширенную резекцию легкого «еn blос» с грудной стенкой или другими структурами (диафрагма, перикард, верхняя полая вена) выполняют у небольшого числа больных — от 3% (Vogt-MoykopfJ. et al., 1994) до 5,8% (Goldstraw P., 1994).
По материалам Ракового центра Андерсена (Хьюстон), за период с 1981 по 1992 г. такие операции — пневмонэктомия (у 19) и резекция легкого и других внелегочных структур — выполнены 38 (3,2%) из более чем 1200 больных (Putnam J.B., Roth J.A., 1990).
В МНИОИ им. П.А. Герцена из общего количества операций, произведенных по поводу метастатических опухолей легких, удельный вес экономных сублобарных резекций равнялся 66,9%, лобэктомии — 30,2% и пневмонэктомии — лишь 2,9% (табл. 12.3).
Таблица 12.3. Частота выполнения операций разного объема при метастатических опухолях легких в зависимости от локализации первичной опухоли
* У 38 больных злокачественная опухоль молочной железы, у 7 — опухоль матки.
** У 19 больных — рак толстой кишки, у одного — рак пищевода, у одного — рак печени.
*** У 3 больных — рак щитовидной железы, у 2 — цилиндрома околоушной железы, у 2 — рак гортани, у 2 — рак нижней губы, у 2 — цилиндрома слизистой оболочки рта.
****У 8 — меланома кожи, у одного — базально-клеточный рак кожи.
***** У 24 больных выполнена классическая сегментэктомия.
При метастазах в легких применяют следующие оперативные доступы: одностороннюю торакотомию, двустороннюю торакотомию, срединную стернотомию. Последний доступ используют при двусторонней локализации метастазов.
В настоящее время срединная стернотомия является рутинным доступом и при одностороннем, и при двустороннем поражении легких. При его применении возможна ревизия обоих легких, средостения и даже брюшной полости путем продления разреза (верхняя лапаротомия).
При этом интубацию обязательно проводят двухпросветной трубкой для поочередного отключения легких. С 1985 г. J. Vogt-Moykopf и соавт. (1994) использовали срединную стернотомию у 64% больных независимо от локализации метастазов в легких. P. Goldstraw (1994) предлагает применять этот доступ лишь при двусторонней локализации метастазов, которая наблюдалась у 28% (у 68 из 243) больных. M.J. Johnston (1983) произвел срединную стернотомию у 18 больных с односторонними метастазами саркомы и у 11 (61,1%) из них обнаружил метастазы в другом легком.
Из 139 оперированных нами больных у 130 использована односторонняя торакотомия, у 6 — двусторонняя и у 3 — стернотомия.
Частота послеоперационных осложнений не превышает 10%. По материалам J. Vogt-Moykopf и соавт. (1994), из осложнений наиболее часто развиваются пневмония, ателектаз и нарушение дренажной функции бронхов. Тяжелые послеоперационные осложнения констатированы лишь у 10 (1,8%) больных.
Реторакотомия потребовалась у 14(2,9%) пациентов. Послеоперационная летальность колеблется от 0 до 2,8% (Kelm C.et al., 1988; Pastorino U.et al., 1990; Goldstraw P., 1994). Сохраняется высокой послеоперационная летальность после пневмонэктомии и комбинированных резекций легкого — 5% (Putnam J et al., 1992).
При субплевральной локализации одиночных метастазов в последние годы выполняют видеоторакоскопическую экономную резекцию легкого (Сигал Е.И., Хамидуллин Р.Г., 1998; Kodama К. et al., 1991; Snyder С. L. et al., 1991; Donnelly R.J. et al., 1992; Lewis R.J. et al., 1992; Miller D.L. et al., 1992).
Между тем R. Landreneau и соавт. (1991), E.C. Holmes (1996) утверждают, что метастазы в паренхиме легкого не следует удалять с использованием этого метода. Маленькие узелки не видны, и их нельзя «пальпировать» с помощью инструментов, поэтому чрезвычайно высок (до 30) процент локального рецидива в области скрепок.
Коллективный опыт хирургов свидетельствует об оправданности активной тактики при солитарных метастазах в легких, при которых отдаленные результаты в ряде случаев превосходят результаты хирургического лечения первичного рака легкого. W. Cahan и соавт. (1974) сравнили результаты хирургического лечения солитарных метастазов в легких у больных, излеченных от рака толстой кишки и легкого: более 5 лет после операции прожили 36 и 26% соответственно.
Показатели 5-летней выживаемости после «радикальных» операций по поводу метастазов в легких колеблются от 21 до 62%. По нашим данным, 5-летняя выживаемость после операций, выполненных но поводу солитарных легочных метастазов у 139 больных, составила 33%. Лучшие результаты достигаются при метастазах опухолей головы и шеи, почки, гормонально-зависимых органов, худшие — при метастазах сарком.
Совокупный опыт отечественных и зарубежных торакальных хирургов позволил выделить общие факторы прогноза после хирургического лечения:
• Радикальность операции — статистически достоверный прогностический фактор (total surgical remission). После «радикальной» резекции с удалением всех метастазов 5-летняя выживаемость равнялась 40%, а после нерадикальной резекции — 18%, более 10 лет прожили 28 и 10% больных соответственно (Vogt-Moykopf J. et al., 1994).
• Количество метастазов в легких. При солитарном метастазе (у 1246 больных) 5-летняя выживаемость равнялась 41%, при 2-8 метастатических узлах — 35%, а при 9 метастазах и более — лишь 21% (Vogt-Moykopf J. et al., 1994). Вопрос о хирургической тактике при лечении больных с множественными метастазами в легких решают индивидуально с учетом характера и гистологической структуры первичной опухоли, распространенности процесса, радикальности проведенного лечения, времени, прошедшего с момента лечения первичного очага (Takita Н. et al., 1981; Golstraw Р., 1994).
• Гистогенез первичной опухоли. Прогноз лучше после удаления метастазов рака, чем саркомы (Vogt-Moykopf J. et al., 1994). По данным этих авторов, после удаления метастазов рака (522 больных) более 5 лет прожили 38% и 10 лет — 28%, а при метастазах саркомы (196 больных) — 24 и 15% соответственно.
Лучшие показатели 5-летней выживаемости достигнуты после удаления метастазов опухолей яичка (62%), колоректального рака (40%), гипернефромы (32%) и рака молочной железы (31%) по сравнению с таковыми при метастазах остеогенной (21%) и мягкотканных (22%) сарком.
Этим данным противоречат материалы P. Goldstraw (1994), согласно которым 5-летняя выживаемость больных после хирургического лечения по поводу метастазов рака составила 35±12,0%, а саркомы — 51±12,0% (различия статистически недостоверны).
• Интервал с момента излечения первичной опухоли до появления легочных метастазов (desease free interval). Чем больше этот интервал, тем лучше прогноз после хирургического лечения (схема 12.1).
Схема 12.1. Сроки выявления метастазов в легких после лечения опухолей разных локализаций
В этом отношении заслуживают внимания исследования по изучению корреляции между сроком выявления метастазов и продолжительностью жизни больных при опухолях различной локализации (Vogt-Moykopf J. et al., 1994).
Как видно из схемы, при опухолях яичка и саркомах метастазы в легких чаще развиваются в первые 3 года после лечения первичного новобразования, причем они чаще не солитарные, и прогноз после хирургического лечения хуже.
Лучший прогноз у больных раком молочной железы и колоректальным раком, если солитарный метастаз в легком возник с интервалом более 3 лет (Mansel J.K. et al., 1986). При метастазах остеосаркомы для определения прогноза важно сочетание таких факторов, как количество метастазов, их локализация (одно- или двусторонняя) и свободный интервал. Плохой прогноз при интервале до 3 лет и количестве метастазов более 7.
• Время удвоения объема метастазов. Этот фактор определяется гистологической структурой первичной опухоли и степенью ее дифференцировки. Прогноз хуже у больных при небольшом времени удвоения объема метастазов и благоприятный при больших сроках (Takita et al., 1981,1992; Casson A.G. et al., 1994).
Многие авторы не учитывают последние три фактора прогноза (МсСоrmack P.N., 1979; Wright J.O. et al., 1982; Mountain C.F. et al., 1984). При опухолях с высокой степенью злокачественности или высоким индексом метастазирования возможности хирургического лечения весьма ограниченны.
Исходя из этого, при опухолях, характеризующихся небольшим временем удвоения объема и высокой потенцией к множественному метастазированию (рак молочной железы, остеогенная саркома, меланома), и обнаружении солитарных метастазов в легких целесообразно выждать несколько месяцев и в течение этого периода проводить противоопухолевое лечение.
• Одинаковые гистологическая структура и степень дифференцировки первичной опухоли и метастазов. При совпадении этих факторов прогноз более благоприятный (Mountain C.F. et al., 1984; Goldstraw P., 1994).
Необходимо отметить, что для разных первичных опухолей определены различные факторы прогноза после хирургического удаления метастазов, но для всех важны количество метастазов и интервал между завершением лечения основного заболевания и появлением метастазов в легких.
Так, например, L.A. Gorenstein и соавт. (1991) при изучении отдаленных результатов хирургического лечения метастазов в легких у 56 больных со злокачественной меланомой установили, что продолжительность их жизни зависит от состояния регионарных лимфатических узлов: в отсутствие регионарных метастазов средняя продолжительность жизни пациентов после удаления легочных метастазов составляет 30 мес, при их наличии — 16 мес (р = 0,04).
В тех случаях, когда первыми появляются метастазы в легких, медиана выживаемости равняется 30 мес, а когда первыми бывают регионарные метастазы — 17 мес (р = 0,038), 5-летняя выживаемость больных составляет 46 и 22% соответственно.
Продолжительность жизни больных не коррелирует с локализацией и гистологическим типом опухоли, степенью ее инвазии по Clark и временем удвоения объема метастаза.
На более репрезентативном клиническом материале D.H. Harpole и соавт. (1992) установили, что после хирургического удаления легочных метастазов меланомы у 945 больных выживаемость их значительно больше при солитарном узле. Авторы рекомендуют удалять только солитарные метастазы, при этом факторами прогноза является «радикальность» резекции и период времени после лечения первичной опухоли.
L.A. Lanza и соавт. (1992) установили, что 5-летняя выживаемость 37 больных раком молочной железы после хирургического удаления метастазов в легких равнялась 50%, средняя продолжительность их жизни — 47 мес.
Важное значение имеет интервал между окончанием лечения первичной опухоли и появлением метастазов: при интервале более 12 мес 5 лет прожили 57% пациентов, средняя продолжительность их жизни составила 82 мес, т.е. почти 7 лет, а при появлении легочных метастазов раньше чем через 12 мес ни одна больная не прожила более 5 лет, средняя продолжительность жизни — 15 мес, т.е. 1 год 3 мес (р = 0,004).
Продолжительность жизни больных статистически достоверно больше при положительных эстрогенрецепторах в опухоли. C.F. Mountain и соавт. (1984), P.M. McCormack (1990) установили, что 5-летняя выживаемость таких больных составляет 25-49%, подтвердив тем самым значимость перечисленных факторов прогноза.
J.B. Putnam и соавт. (1990) изучили отдаленные результаты хирургического удаления солитарного метастаза колоректального рака у 45 больных в Раковом центре M.D. Anderson. Основной вывод — удаление метастаза способствует увеличению продолжительности жизни больных: более 3 лет прожили 51%.
Ни один из ранее перечисленных факторов прогноза, кроме количества метастазов, не коррелировал с отдаленными результатами лечения. Другие авторы (Goya Т. et al., 1989; Phil Е et al., 1992; McAfee M.K. et al., 1992) доказали, кроме того, значимость таких прогностических факторов, как интервал с момента излечения первичного очага (более 12 мес), размеры метастаза (3 см) и показатель содержания раково-эмбрионального антигена, а также целесообразность выполнения повторных операций по показаниям. Пятилетняя выживаемость больных после удаления солитарного метастаза составляет, по данным этих авторов, 38-47%.
Внимания заслуживает исследование по изучению результатов хирургического удаления метастазов мягкотканных сарком в легких (Casson A.G. et al., 1992). Из 58 оперированных больных 15 (25,9%) прожили более 5 лет. Неоперированные больные умерли в течение 2 лет после обнаружения легочных метастазов.
Прогностическими факторами после хирургического лечения являются: время удвоения объема опухоли больше 40 дней, одностороннее поражение легких, наличие двух узлов (при КТ). Лучших результатов достигают при солитарном метастазе, при этом другие факторы прогноза несущественны.
Пятилетняя выживаемость больных, оперированных по поводу метастазов лейомиосаркомы, липосаркомы и хондросаркомы, не чувствительных к химиотерапии, составляет 25-45% (Putnam J.B. et al., 1984; Roth J.A., 1985). Авторы показали значимость перечисленных факторов прогноза, добавив к ним интервал с момента лечения первичной опухоли.
Продолжительность жизни больных не зависит от результатов предоперационной химиотерапии — полная регрессия метастазов, частичная или без эффекта (Lanza L.A. et al., 1992). Аналогичные данные приводят К.А. Skinner и соавт. (1992), изучившие результаты адъювантной химиотерапии у 247 больных.
Наконец, при оценке результатов резекции метастазов рака органов головы И шеи у 44 больных установлена 5-летняя выживаемость 45% (Mazer Т. М. et al., 1988). Оптимальный интервал между лечением первичной опухоли и выявлением метастазов в легких — более 13 мес. Лучших отдаленных результатов удается достичь при метастазах рака слизистой оболочки полости рта.
Таким образом, огромный коллективный опыт хирургического лечения больных с солитарным метастазом в легких подтверждает оправданность применения активной тактики. Продолжительность жизни большинства больных после «радикальной» резекции метастаза(ов) больше, чем без операции.
В тех случаях, когда нет возможности применить другие, консервативные, методы лечения, ни отдельные факторы прогноза, ни их комбинация не могут служить поводом для отказа от выполнения операции у функционально операбельных больных. Между тем для различных гистологических типов злокачественных опухолей определены конкретные критерии отбора больных и показания к операции, уточнены благоприятные и неблагоприятные групповые факторы прогноза.
Если при солитарных метастатических опухолях легких лечебная тактика в достаточной степени ясна, то при единичных и множественных мнения о ней противоречивы. Появление нескольких узлов в легком, особенно в ранние сроки после излечения первичной опухоли, — обычно плохой прогностический признак.
Метастазы в легкие могут рецидивировать, и при этом нередко обсуждается вопрос о повторных операциях, которые производят 15% ранее оперированных больных. Здесь уместно вспомнить экспериментальное исследование, в котором было установлено, что метастазы могут дать другие легочные метастазы (Hoover Н.С., Ketcham A.S., 1975).
По репрезентативным данным P. Goldstraw (1994), из 243 больных с метастазами в легких у 34 (14%) были произведены повторные операции, а у 6 (2,5%) — по три оперативных вмешательства и более. Оправданность выполнения таких операций была убедительно подтверждена еще в 60-70-х годах (Колесов В.И., 1963; Пирогов А.И., Смулевич В.В., 1964; Kilman Р. et al., 1969; Cahan W. et al., 1974).
Показания к выполнению повторного оперативного вмешательства по поводу «рецидивных» метастазов те же, что и при первой операции. В литературе немного публикаций, посвященных этой проблеме (Rizonni W.E. et al., 1986; Casson A.G. et al., 1991; Pogrebniak H.W. et al., 1991; Goldstraw P., 1994). Поданным этих авторов, множественные резекции при «рецидивных» метастазах способствуют увеличению продолжительности жизни больных.
Повторные (2 и более) операции по поводу «рецидивных» метастазов сарком мягких тканей (29) позволили добиться 22% 5-летней выживаемости больных без увеличения частоты развития послеоперационных осложнений (7,5%) и летальных исходов (Rizonni W.E. et al., 1986).
Аналогичные данные приводят A.G. Casson и соавт. (1991): после 34 повторных операций по поводу «рецидивных» метастазов сарком мягких тканей более 5 лет прожили 32% больных, средняя продолжительность их жизни равнялась 28 мес, причем при солитарном узле — 65 мес, при наличии двух узлов и более — 14 мес.
Средняя продолжительность жизни неоперированных больных составила лишь 7 мес.
Роль адъювантной химиотерапии не ясна. Некоторые авторы показали, что сочетание резекции метастазов в легких с послеоперационной полихимиотерапией приводит к увеличению продолжительности жизни больных (Huth J.F. et al., 1980; Mountain C.F et al., 1984).
Следует полагать, что при относительно чувствительных к химиотерапии опухолях применение современных активных противоопухолевых препаратов, безусловно, будет способствовать улучшению отдаленных результатов лечения многочисленного контингента больных с метастатическими опухолями легких.
Эффективность резекции легочных метастазов в сочетании с химиотерапией подтвердили данные, полученные в исследовании, проведенном в Калифорнийском университете, в котором были изучены результаты лечения 247 больных с остеогенной саркомой за период с 1971 по 1991 г. (Skinnner К.А. et al., 1992). До эры современной химиотерапии у 92% больных развились метастазы в легких, их 5-летняя выживаемость составила менее 10%.
Применение адекватной и эффективной химиотерапии способствовало снижению частоты развития легочных метастазов с 92 до 31%: при использовании доксорубицина и высоких доз метотрексата — до 63% (у 33 из 52 больных); доксорубицина, больших доз метотрексата, блеомицина, циклофосфамида, дактиномицина — до 48% (у 35 из 73); доксорубицина, высоких доз метотрексата, цисплатина и ифосфамида — до 31% (34 из 109).
Резекцию метастазов ранее произвели 17% больным, а за последние 5 лет — 82%. Пятилетняя выживаемость больных после удаления легочных метастазов в разные периоды колебалась от 35 до 50%, составив в среднем 41%. Следовательно, после излечения первичного очага резекция легочных метастазов в сочетании с адъювантной адекватной полихимиотерапией позволила продлить жизнь больных с остеогенными саркомами.
Интервал между излечением первичной опухоли и появлением изменений в легких, количество метастазов и время удвоения их объема не коррелируют с продолжительностью жизни больных. По-видимому, послеоперационная полихимиотерапия изменяет «биологию заболевания».
Даже при плевритах и внугриплевральном введении митоксантрона (20 мг/м2) и выраженном эффекте авторы выполняют торакотомию с целью резекции метастазов, включая по необходимости резекцию диафрагмы и грудной стенки, при этом констатируют регрессию диссеминатов.
При метастазах в легких остеосаркомы оправдано выполнение повторных торакотомии по поводу «рецидивных» опухолей, способствующих увеличению продолжительности жизни больных (Pastorino U. et al., 1991).
Несмотря на значительную частоту метастатического поражения легких (солитарный и единичные узлы) и оправданность хирургического лечения, контингент больных, которым проводят хирургическое лечение, пока еще невелик. Вследствие ряда причин большинству больных проводят консервативное противоопухолевое лечение (химио- и гормонотерапия, лучевое лечение) без учета гистологического типа первичной опухоли и других прогностических факторов.
Лекарственная противоопухолевая терапия при метастатических поражениях легких стала, к сожалению, методом выбора. При множественных метастазах химиотерапия, воздействуя на все опухолевые узлы, имеет преимущества перед хирургическим и лучевым методами.
Она, безусловно, оправдана при опухолях, чувствительных к химиопрепаратам (хорионэпителиома, опухоли яичка, рак молочной железы и остеосаркома). Однако при метастазах рака желудка, толстой кишки, гипернефромы и опухолей мягких тканей химиотерапия в большинстве случаев малоэффективна.
Среди различных методов лечения метастатических опухолей легких определенное место занимает лучевое лечение. Обнадеживающие результаты получены при метастазах ангиосарком, остеогенных сарком и опухоли Юинга. В ряде случаев отмечено не только уменьшение опухолевого узла в легком, но и его полная регрессия.
По-видимому, возможности лучевого лечения метастазов опухолей некоторых локализаций влегких, особенно на современных установках с применением нетрадиционных схем фракционирования дозы облучения и радиомодификаторов, еще полностью не выяснены.
В заключение следует подчеркнуть оправданность применения активной многокомпонентной лечебной тактики при метастатических опухолях легких с учетом изученных факторов прогноза. Наиболее важными из них являются локализация и гистологическая структура первичной опухоли, количество метастазов, интервал между окончанием лечения и появлением метастазов, чувствительность опухоли и эффективность химиотерапии, время удвоения объема опухоли.
Чрезвычайно важны полнота обследования больных и применение результативных методов для исключения метастазов в средостении и других органах (медиастиноскопия, торакоскопия, компьютерная томография, сцинтиграфия скелета).
При локализации метастазов только в легких «радикальная» резекция способствует увеличению продолжительности жизни больных (5-летняя выживаемость до 50%), а при чувствительных опухолях (остеосаркомы и др.) целесообразно ее сочетание с химиотерапией. Оптимальным доступом является торакотомия и стернотомия, а при необходимости ревизии и резекции опухолей обоих легких предпочтительна поперечная стернотомия.
Видеоторакоскопическая резекция легочных метастазов нецелесообразна, поскольку только ручная ревизия и пальпация дают возможность уточнить истинное поражение легкого, что позволит выполнить радикальную операцию.
В послеоперационном периоде рутинное рентгенологическое исследование с целью диагностики «рецидивных» метастазов неэффективно. Только компьютерная томография, проводимая с интервалом 4-6 мес, позволяет надеяться на своевременное их выявление с обсуждением вопроса о повторной операции, которая в ряде ситуаций весьма эффективна.
Несмотря на большой мировой опыт хирургического лечения больных с метастатическими опухолями легких и решение многих аспектов этой проблемы, до сих пор окончательно не изучена или не известна прогностическая значимость ряда факторов:
1) интервал с момента излечения первичной опухоли до появления метастазов;
2) статус гормональных рецепторов при раке молочной железы;
3) степень дифференцировки мягкотканных и остеогенных сарком;
4) состояние внутригрудных лимфатических узлов;
5) значение уровня опухолевых маркеров в ранней серологической диагностике метастазов;
6) целесообразность хирургической тактики при солитарных метастазах в легком и другом органе (печень, головной мозг и др.);
7) роль неоадъювантной и адъювантной противоопухолевой терапии (химиотерапия, лучевое или химиолучевое лечение), включая гормоно- и иммунотерапию.
Решение этих вопросов возможно при условии проведения кооперированных рандомизированных научных исследований на репрезентативном клиническом материале.
источник