Реакцией организма на внешние раздражители становится отечность слизистой, покраснения и высыпания на коже. За это отвечает иммуноглобулин Е.
Выработка данных антител в ответ на появление чужеродных клеток (в том числе бактерий, грибков) происходит в подслизистых слоях системы пищеварения, кожного покрова, миндалин, аденоидов, дыхательных путей.
Показатель иммуноглобулина Е при бронхиальной астме имеет важное значение для диагностики. Данное заболевание связано с удушьем, одышкой и кашлем, вызванными воспалением и реакцией бронхов на раздражители.
Иммуноглобулин Е – это особая разновидность белков, производимых лимфоцитами В группы, которая отвечает за реакцию иммунной системы на проникновение в организм паразитов (токсоплазмы, трихинелл, аскарид) и обладает антигельминтным эффектом.
Также IgE участвуют в процессе развития воспаления при попадании в организм аллергенов.
Часто повышаются иммуноглобулины при атопическом дерматите, бронхиальной астме и крапивнице. У многих людей имеется генетическая расположенность к появлению аллергических антител, к которым и относятся иммуноглобулины IgE.
Различают раннюю и отсроченную фазу аллергии. В первой под воздействием активных веществ увеличивается проницаемость сосудистых стенок, развивается отек тканей , активизируется секреция желез, происходит раздражение нервных окончаний, сокращение мускулатуры в органах.
Под действием биологически активных веществ в область воспаления привлекаются кровяные клетки, выделяющие антивоспалительные медиаторы.
Уровень иммуноглобулина Е определяется в следующих ситуациях:
- при инфекциях, воспалениях или аллергических проявлениях;
- при первичных иммунодефицитах;
- при злокачественных опухолях;
- при симптомах бронхолегочного аспергиллеза;
- при назначении иммуно-специфической терапии. Ее можно проводить при показателях IgE 30-700 IU/ml.
При бронхиальной астме программа исследований начинается со сдачи анализов, после проведения которых определяется причина патологии и назначается правильная терапия.
Кроме общего анализа (на гемоглобин, СОЭ, содержание лейкоцитов и эритроцитов), проводятся иммунологическое и биохимическое исследования крови, анализ мокроты. При необходимости специалист назначает дополнительные обследования.
Перед сдачей анализа нельзя принимать пищу 8 часов, рекомендуется за сутки исключить из рациона жареное, жирное, алкогольные напитки.
Иммунологические исследования направлены на выявление повышения уровня IgE, что важно для дифференциации инфекционно-зависимой и аллергической формы астмы.
При этом также определяют в сыворотке крови объем иммуноглобулина и специфических антител.
Общий уровень иммуноглобулина не является основанием для постановки диагноза , потому что этот показатель может быть одинаковым у здорового и больного пациента.
Определение уровня специфического IgE осуществляется посредством кожных проб, а при высокой опасности анафилактических реакций – при помощи радиоаллергенного теста.
После определения в сыворотке крови специфических иммуноглобулинов выявляются возможные аллергены. Как правило, при этом уровень IgE превышает нормативные показатели, а Т-супрессорные лейкоциты снижены.
В нормальном состоянии уровень общего иммуноглобулина Е в кровяной плазме будет низким, так как нет необходимости в выработке защитного белка при отсутствии атопических антигенов.
У детей показатель общего IgE меняется с возрастом и отличается от норм для взрослых людей. К периоду полового созревания эти цифры устанавливаются и потом не меняются. В пожилом возрасте количество защитных антител снижается – это нормальное явление.
Если содержание IgE у взрослого человека — 3-423 МЕ/мл, то его уровень в норме. При бронхиальной астме эти показатели составляют 120–1200 МЕ/мл.
Но высокие показатели иммуноглобулина не являются основой для диагностических заключений, так как причин для его повышения много, например, поллиноз и аллергический ринит.
Необходимо провести углубленные исследования, чтобы точно определить, почему повышен аллерген-специфический IgE.
Атопическая бронхиальная астма, как и другие болезни аллергической природы, развивается при попадании в организм аллергенов (пищевых добавок, пыли, пыльцы, чужеродного белка, лекарств, химикатов и пр.).
При развитии аллергической реакции выделяются специфические иммуноглобулины. Они дают сигнал о начале воспаления.
С увеличением содержания иммуноглобулинов Е в крови повышается количество рецепторов к данным антителам на поверхности клетках, активирующих аллергические реакции.
В результате выбрасываются медиаторы воспаления, что приводит к развитию тяжелой симптоматики. У людей с тяжелой патологией бронхов намного больше рецепторов к иммуноглобулинам, чем при легкой форме или у здоровых.
Если особое внимание при лечении уделить уменьшению воздействия IgE, то можно исключить или снизить интенсивность воспаления, так как будет меньше выделяться веществ, его провоцирующих.
Также можно связать Е-молекулы в крови до их оседания на клеточных рецепторах с помощью антител, выделенных из организма животных.
Однако чужеродные белки сами могут приводить к развитию аллергических проявлений, особенно у астматиков, поэтому не всем и не всегда разрешена такая терапия.
При астме для выявления реакции, которую вызывает иммуноглобулин, применяют клинические тестирования. При этом на поврежденную кожу наносят аллергены или вводят их подкожно. Начинает выделяться иммуноглобулин, вызывающий воспаление в области контакта.
Получить направление на диагностику можно у аллерголога, который назначит правильное лечение. Раньше терапия бронхиальной астмы проводилась путем снятия сужения бронхов с помощью бронхорасширяющих лекарств. Но у астматиков только облегчались проявления приступа, но предотвратить обострения не удавалось.
В настоящее время врачи достигли прогресса в лечении благодаря изучению природы астмы. У пациентов стало возможным предотвращать обострения и приступы.
Бронхиальную астму часто лечат высокими дозами ингаляционных глюкокортикостероидов в сочетании с бета-2-агонистами или назначают гормональные препараты в форме таблеток.
Но даже при такой усиленной терапии не всегда удается контролировать симптомы. Поэтому ученые занимаются поиском лекарств, оказывающих воздействие на причину заболевания.
При астме тяжелой степени рекомендуется анти-IgE-терапия. Пациентам вводится особое вещество — омализумаб, блокирующее активность иммуноглобулина Е. В результате у астматиков снижается количество обострений, уменьшается необходимость в системных гормонах, улучшается качество жизни.
Препарат имеет высокую эффективность, при его приеме редко появляются признаки аллергии и не выявлены опасные последствия. Назначается омализумаб детям старше 6 лет и взрослым при подтвержденной атопической природе болезни после проведения аллергопроб, выявления повышенного содержания в сыворотке крови общего иммуноглобулина.
Препарат вводят под кожу раз в 2-4 недели, дозировка выбирается, исходя из уровня IgE.
Кроме того, в зависимости от причин заболевания, назначаются следующие препараты:
- Антигистаминные лекарства. Блокируют рецепторы, реагирующие на гистамин, участвующий в развитии аллергической реакции.
- Препараты местного действия (для уменьшения внешних проявлений патологии, предотвращения осложнений) – мази и капли с противовоспалительным действием.
- Противогельминтные средства для борьбы с паразитарной инвазией.
- Стимуляторы иммунной системы, уменьшающие аллергические проявления.
Медикаменты назначаются врачом с учетом особенностей течения бронхиальной астмы, степени тяжести и причин обострений.
Из народных средств часто применяют отвар из листьев зверобоя, травы золототысячника, хвоща полевого, кукурузных рылец, соцветий ромашки, корня одуванчика и ягод шиповника.
Также можно использовать смесь порошка из яичной скорлупы с лимонным соком или сделать отвар из корней лопуха и одуванчика.
До меня недавно докатился слух о том, что будто наши ученые разработали очередную «кремлевскую таблетку» и уже используют ее для лечения людей, болеющих бронхиальной астмой. Будто бы она позволяет справиться с самыми тяжелыми случаями бронхиальной астмы и буквально преображает жизнь людей с любой аллергией. В результате долгих поисков и разговоров с информированными людьми выяснилось, что это не очередная утка.
Новое лекарство действительно есть, и оно действительно помогает при бронхиальной астме, причем самой тяжелой. Правдой оказалось и то, что это лекарство эффективно и при некоторых других видах аллергии.
К сожалению, назвать это лекарство «кремлевской таблеткой» не получится по целым трем причинам. Во-первых, разработали его не отечественные специалисты, а швейцарские, во-вторых, оно вышло за рамки «придворных» медицинских учреждений, и, наконец, это не таблетка. Пожалуй, только последний факт несколько меня опечалил (хотя, конечно, жаль, что не нашим ученым принадлежит приоритет его изобретения), потому что вводят лекарство подкожно — в инъекциях. Впрочем, это не самое главное — лишь бы помогало.
Кстати, может, и к лучшему обойтись без вычурных названий типа «кремлевских таблеток» и громких эпитетов, от которых веет шарлатанством. Современное лечение бронхиальной астмы обрело название «анти-IgE терапия» и не содержит в себе ничего необъяснимого или паранормального, а опирается исключительно на достижения иммунологии и молекулярной технологии. Суть его в том, что ошибку иммунитета исправляют тоже с помощью иммунных механизмов. Но сначала вспомним, что такое иммуноглобулины класса Е (IgE) и зачем с ними надо бороться.
У большинства людей с бронхиальной астмой есть генетическая предрасположенность к выработке аллергических антител, которыми и являются IgE (в отличие от антител классов A, M и G, защищающих организм от различных микробов). Эти антитела вырабатываются лимфоцитами в ответ на определенный аллерген, поступают в кровь и доносятся до тучных клеток, где фиксируются на специальных рецепторах.
Тучные клетки расположены на «пограничных заставах» организма — в коже, конъюнктиве, слизистых оболочках бронхов, носа, желудочно-кишечного тракта, то есть там, откуда могут проникнуть аллергены. Если аллерген, к которому у человека выработались IgE, попадает в организм, эти фиксированные на тучной клетке антитела узнают его и дают клетке сигнал к запуску каскада аллергического воспаления. А в результате человек ощущает симптомы со стороны того органа, где «сидят» IgE, — бронхов (при бронхиальной астме), кожи (при атопическом дерматите или крапивнице), носа (при аллергическом рините) и т.д.
Чтобы не допустить запуска этого аллергического каскада, и были синтезированы специальные антитела для анти-IgE терапии, которые после подкожного введения связывают IgE в крови, не позволяя им «прилепиться» к тучным клеткам.
Кому же проводится анти-IgE терапия? Конечно, решение принимает врач-аллерголог, но и нам надо представлять, есть ли смысл задумываться о таком лечении (ведь средство сильнодействующее, а из пушки по воробьям не стреляют).
Анти-IgE терапия показана людям страдающим тяжелой и среднетяжелой бронхиальной астмой, у которых не удается добиться должного эффекта с помощью высоких доз ингаляционных гормонов и бронхолитиков длительного действия. Обязательно должна быть доказана аллергическая природа заболевания — повышенное содержание IgE в крови, а пациент должен быть старше 12 лет.
Если врач назначил анти-IgE терапию, то один раз в 2 или 4 недели человеку делают подкожную инъекцию (доза и частота введения препарата определяются в зависимости от массы тела пациента и исходного уровня иммуноглобулина Е в крови). Заметим, что бросать то лечение, которое проводилось раньше, нельзя, а можно лишь постепенно уменьшать его объем по рекомендации лечащего врача.
Эффективность анти-IgE терапии была изучена у пациентов с тяжелой и среднетяжелой бронхиальной астмой, у которых не удавалось контролировать заболевание с помощью наиболее действенных препаратов (ингаляционных гормонов и бронхолитиков длительного действия).
Как показали исследования, добавление к лечению анти-IgE уменьшает тяжесть симптомов и частоту обострений и даже позволяет снизить поддерживающую дозу гормонов у пациентов с гормонозависимой формой заболевания. Наряду с облегчением течения бронхиальной астмы анти-IgE терапия помогает справиться и с симптомами сопутствующих аллергических болезней (аллергического ринита, пищевой аллергии). Впрочем, этот «побочный эффект» был вполне предсказуемым — ведь IgE перестают поступать не только в бронхи, но и в другие органы, где возможны аллергические реакции. Побольше бы таких «побочных эффектов».
Вот видите, напрасно говорят: «Не верьте слухам!» Иногда бывает полезно и поверить. Но только — из достоверных источников.
источник
Моноклональные антитела против IgE (Ксолар) – новый препарат для достижения контроля бронхиальной астмы. Отбор пациентов и особенности лечения
- КЛЮЧЕВЫЕ СЛОВА: Ксолар, бронхиальная астма, омализумаб, bronchial asthma, monoclonal IgG1 antibodies, omalizumab, Xolair
Омализумаб (препарат Ксолар) относится к принципиально новому классу препаратов, используемых в лечении пациентов с неконтролируемой бронхиальной астмой (БА) аллергической природы. Препарат представляет собой рекомбинантные гуманизированные моноклональные антитела, относящиеся к группе иммуноглобулинов (Ig) G1, которые избирательно связываются с циркулирующим IgЕ – важнейшим медиатором аллергических реакций у пациентов с атопической (аллергической) формой БА. IgG1-каппа-антитело содержит человеческую структурную основу с определяющим комплементарность участком мышиного исходного антитела, который связывается с IgE. Омализумаб связывается с IgE и предупреждает его связывание с Fc-эпсилон-R1-рецептором, имеющим высокое сродство к IgE, снижая таким образом количество свободного IgE, способного запустить аллергический каскад.
В июне 2003 г. омализумаб был одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (US Food and Drug Administration, FDA) для лечения пациентов с аллергической астмой (IgE-опосредованной) среднетяжелого и тяжелого течения при невозможности достижения контроля ингаляционными глюкокортикостероидами (ИГКС) и комбинированными препаратами, содержащими ИГКС и ингаляционные длительно действующие бета-2-агонисты (ДДБА). Омализумаб является первым, наиболее изученным и до настоящего времени единственным препаратом этого класса в лечении пациентов с БА. Его применение разрешено у взрослых и детей с 6 лет во многих странах мира, в том числе и в России. В 2011 г. в России был расширен способ дозирования препарата: верхняя граница исходного уровня IgE у пациента была изменена со значения 700 МЕ/мл до 1300–1500 МЕ/мл. Теперь диапазон использования препарата (уровень IgE) варьирует от > 30 МЕ/мл до 1300–1500 МЕ/мл [1].
Внедрение Ксолара (омализумаба) в практику российского здравоохранения позволило назначать препарат в условиях реальной клинической практики. Применение инновационного препарата довольно остро ставит вопрос о показаниях к его назначению, прежде всего, при неконтролируемой БА. В последние два десятилетия в лечении БА наблюдается значительный прогресс, тем не менее достижение контроля заболевания остается актуальной проблемой. Внедрение современной высокоэффективной базисной терапии привело к существенному улучшению качества медицинской помощи. Однако, по данным целого ряда наблюдательных исследований, у подавляющего большинства пациентов симптомы тяжелой БА не контролируются. Так, в исследовании INSPIRE (International Asthma Patient Insight Research – Международное исследование отношения пациентов к бронхиальной астме), включившем 3415 пациентов с БА в 11 странах мира, как минимум треть пациентов с тяжелым течением БА не достигали контроля заболевания при использовании наиболее эффективного стандартного лечения комбинированными препаратами [2]. Несмотря на проводимое лечение, 74% пациентов вынуждены ежедневно использовать препараты скорой помощи (бета-2-агонисты короткого действия). Важно понимать, что неконтролируемое течение БА сопряжено с высоким риском обострения БА и даже летального исхода.
Возможность достижения контроля тяжелой атопической БА очень часто осложняется не только течением самой БА, но и наличием ассоциированных с атопией сопутствующих заболеваний: аллергического ринита, синуситов, дерматита, каждое из которых приносит большие страдания пациентам.
Основными триггерами, не позволяющими достигать контроля заболевания, являются аллергены. Установлена прямая корреляционная связь между уровнем IgE и риском развития БА. В опубликованных данных клинических исследований ENFUMOSA (European Network For Understanding Mechanisms Of Severe Asthma – Европейская сеть по изучению механизмов тяжелой астмы) [3] и TENOR (Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens – Эпидемиология и течение бронхиальной астмы: исходы и схемы терапии) [4, 5] аллергия к различным аэроаллергенам была выявлена более чем у 50% и 90% пациентов с БА соответственно.
Было показано, что у пациентов, умерших от тяжелого астматического приступа, плотность рецепторов к IgE в подслизистом слое бронхов достоверно выше по сравнению с пациентами, умершими от других причин [6–9].
Омализумаб связывается с IgE и предотвращает его взаимодействие с высокоаффинным Fc-эпсилон-R1-рецептором, при этом происходит снижение количества свободного IgE, который является пусковым фактором для каскада аллергических реакций. Ксолар подавляет как раннюю, так и поздние фазы астматического ответа у пациентов. Общий уровень IgE (связанного и несвязанного) в сыворотке крови повышался после первой дозы препарата вследствие образования комплекса «омализумаб – IgE», характеризующегося более медленной скоростью выведения по сравнению со свободным IgE. На 16-й неделе после введения первой дозы омализумаба средний уровень общего IgE в сыворотке был в 5 раз выше по сравнению с таковым до лечения. После отмены Ксолара обусловленное его действием увеличение общего IgE и уменьшение свободного IgE были обратимыми. После полного выведения препарата из организма не наблюдалось увеличения концентрации IgE в сыворотке крови. При применении в рекомендуемых дозах среднее уменьшение свободного IgE в сыворотке составляло более 96%.
Кроме того, было обнаружено, что у пациентов с атопической астмой при лечении омализумабом снижается уровень циркулирующих эозинофилов и их количество в мокроте, полученной в результате стимуляции бронхов. Было также показано, что терапия Ксоларом снижает количество эозинофилов в мокроте и количество Fc-эпсилон-R1+-клеток в верхних дыхательных путях больных с аллергической астмой [10] и достоверно снижает число эозинофилов в подслизистом слое бронхов [11]. В исследовании O. Noga и соавт. наблюдалось более значительное увеличение апоптоза эозинофилов (относительно исходного показателя) к 12-й неделе терапии в группе, принимавшей омализумаб, по сравнению с группой плацебо [12]. В исследовании E.L. van Rensen и соавт. отмечено значительно более выраженное снижение количества эозинофилов (относительно исходного уровня) к 12-й неделе в группе, принимавшей омализумаб, по сравнению с группой плацебо [13].
Таким образом, Ксолар можно рассматривать как препарат, обладающим антиаллергическим и противовоспалительным действием.
- Исследование INNOVATE продемонстрировало, что у пациентов с неконтролируемой тяжелой персистирующей атопической БА добавление Ксолара к лечению (IV ступень терапии согласно рекомендациям GINA) приводит к следующим результатам:
- сокращению числа клинически значимых обострений БА на 26%;
- сокращению числа тяжелых обострений на 50%;
- значительному (на 44%) снижению числа экстренных обращений за медицинской помощью (число госпитализаций, включая госпитализацию в реанимационные отделения, незапланированных визитов к врачу) по сравнению с плацебо.
В подгруппе пациентов, ответивших на лечение омализумабом, частота клинически значимых обострений БА за 28-недельный период лечения снизилась на 60,5% по сравнению с группой плацебо (0,34 против 0,85, p 1/100 ÷ > 1/10) были боль, отек, эритема и зуд в месте введения препарата, а также головные боли. Они развивались чаще всего в течение первого часа от момента введения и сохранялись до нескольких дней, однако их выраженность значительно снижалась с каждым последующим введением.
источник
Бронхиальная астма – диагноз клинический, то есть врач ставит его на основании прежде всего жалоб, истории заболевания и данных осмотра и внешнего исследования (пальпации, перкуссии, аускультации). Однако дополнительные методы исследования дают ценную, а в некоторых случаях определяющую диагностическую информацию, поэтому они широко применяются на практике.
Диагностика бронхиальной астмы с помощью дополнительных методов включает проведение лабораторных анализов и инструментальных исследований.
Пациенту с астмой могут быть назначены следующие анализы:
- общий анализ крови;
- биохимический анализ крови;
- общий анализ мокроты;
- анализ крови для выявления общего IgE;
- кожные пробы;
- определение в крови аллергенспецифических IgE;
- пульсоксиметрия;
- анализ крови на газы и кислотность;
- определение оксида азота в выдыхаемом воздухе.
Разумеется, не все эти тесты выполняются у каждого больного. Некоторые из них рекомендуются лишь при тяжелом состоянии, другие – при выявлении значимого аллергена и так далее.
Общий анализ крови выполняется у всех пациентов. При бронхиальной астме, как и при любом другом аллергическом заболевании, в крови отмечается увеличение количества эозинофилов (EOS) более 5% от общего количества лейкоцитов. Эозинофилия в периферической крови может возникать не только при астме. Однако определение этого показателя в динамике (повторно) помогает оценить интенсивность аллергической реакции, определить начало обострения, эффективность лечения. В крови может определяться незначительный лейкоцитоз и увеличение скорости оседания эритроцитов, однако это необязательные признаки.
Биохимический анализ крови у больного с астмой часто никаких отклонений не выявляет. У некоторых пациентов отмечается увеличение уровня α2- и γ-глобулинов, серомукоида, сиаловых кислот, то есть неспецифических признаков воспаления.
Обязательно проводится анализ мокроты. В ней находят большое количество эозинофилов – клеток, участвующих в аллергической реакции. В норме их меньше 2% от всех обнаруженных клеток. Чувствительность этого признака высокая, то есть он обнаруживается у большинства больных с астмой, а специфичность средняя, то есть, помимо астмы, эозинофилы в мокроте встречаются и при других заболеваниях.
В мокроте нередко определяются спирали Куршмана – извитые трубочки, образующиеся из бронхиальной слизи при спазме бронхов. В них вкраплены кристаллы Шарко-Лейдена – образования, которые состоят из белка, образующегося при распаде эозинофилов. Таким образом, два этих признака говорят о снижении бронхиальной проходимости, вызванном аллергической реакцией, что часто и наблюдается при астме.
Кроме того, в мокроте оценивается наличие атипичных клеток, характерных для рака, и микобактерий туберкулеза.
Анализ крови на общий IgE показывает уровень в крови этого иммуноглобулина, который вырабатывается в ходе аллергической реакции. Он может быть повышен при многих аллергических заболеваниях, но и нормальное его количество не исключает бронхиальную астму и другие атопические процессы. Поэтому гораздо более информативным является определение в крови специфических IgE – антител к конкретным аллергенам.
Для анализа на специфические IgE используются так называемые панели – наборы аллергенов, с которыми реагирует кровь больного. Тот образец, в котором содержание иммуноглобулина будет выше нормы (у взрослых это 100 ед/мл), и покажет причинно-значимый аллерген. Используются панели шерсти и эпителия разных животных, бытовые, грибковые, пыльцевые аллергены, в некоторых случаях – аллергены лекарств и пищевые.
Для выявления аллергенов применяются и кожные пробы. Их можно проводить у детей любого возраста и у взрослых, они не менее информативны, чем определение IgE в крови. Кожные пробы хорошо себя зарекомендовали в диагностике профессиональной астмы. Однако при этом существует риск внезапной тяжелой аллергической реакции (анафилаксии). Результаты проб могут меняться под действием антигистаминных препаратов. Их нельзя проводить при кожной аллергии (атопическом дерматите, экземе).
Пульсоксиметрия – исследование, проводимое с помощью небольшого прибора – пульсоксиметра, который обычно надевается на палец пациента. Он определяет насыщение артериальной крови кислородом (SpO2). При снижении этого показателя менее 92% следует выполнить исследование газового состава и кислотности (рН) крови. Снижение уровня насыщения крови кислородом свидетельствует о тяжелой дыхательной недостаточности и угрозе для жизни больного. Определяемое при исследовании газового состава снижение парциального давления кислорода и увеличение парциального давления углекислого газа свидетельствует о необходимости искусственной вентиляции легких.
Наконец, определение оксида азота в выдыхаемом воздухе (FENO) у многих больных с астмой выявляет увеличение этого показателя выше нормы (25 ppb). Чем сильнее воспаление в дыхательных путях и больше доза аллергена, тем показатель выше. Однако такая же ситуация бывает и при других болезнях легких.
Таким образом, специальные лабораторные методы диагностики астмы – кожные пробы с аллергенами и определение в крови уровня специфических IgE.
Методы функциональной диагностики бронхиальной астмы включают:
- исследование вентиляционной функции легких, то есть способности этого органа доставлять необходимое количество воздуха для газообмена;
- определение обратимости бронхиальной обструкции, то есть снижения проходимости бронхов;
- выявление гиперреактивности бронхов, то есть их склонности к спазму под действием вдыхаемых раздражителей.
Основной метод исследования при бронхиальной астме – спирометрия, или измерение дыхательных объемов и скоростей воздушных потоков. С него обычно начинается диагностический поиск еще до начала лечения больного.
Главный анализируемый показатель – ОФВ1, то есть объем форсированного выдоха за секунду. Проще говоря, это количество воздуха, которое человек способен быстро выдохнуть в течение 1 секунды. При спазме бронхов воздух выходит из дыхательных путей медленнее, чем у здорового человека, показатель ОФВ1 снижается.
Если при первичной диагностике уровень ОФВ1 составляет 80% и больше от нормальных показателей, это говорит о легком течении астмы. Показатель, равный 60 – 80% от нормы, появляется при астме средней тяжести, менее 60% – при тяжелом течении. Все эти данные применимы только к ситуации первичной диагностики до начала терапии. В дальнейшем они отражают не тяжесть астмы, а уровень ее контроля. У людей с контролируемой астмой показатели спирометрии в пределах нормы.
Таким образом, нормальные показатели функции внешнего дыхания не исключают диагноз «бронхиальная астма». С другой стороны, снижение бронхиальной проходимости обнаруживается, например, при хронической обструктивной болезни легких (ХОБЛ).
Если обнаружено снижение бронхиальной проходимости, то важно выяснить, насколько оно обратимо. Временный характер бронхоспазма – важное отличие астмы от того же хронического бронхита и ХОБЛ.
Итак, при снижении ОФВ1 для выявления обратимости бронхиальной обструкции проводятся фармакологические тесты. Пациенту дают препарат посредством дозированного аэрозольного ингалятора, чаще всего 400 мкг сальбутамола, и через определенное время снова проводят спирометрию. Если показатель ОФВ1 увеличился после использования бронхолитика на 12% и больше (в абсолютных цифрах на 200 мл и больше), говорят о положительной пробе с бронходилататором. Это означает, что сальбутамол эффективно снимает спазм бронхов у данного пациента, то есть бронхиальная обструкция у него непостоянна. Если показатель ОФВ1 увеличивается менее чем на 12%, это признак необратимого сужения бронхиального просвета, а если он уменьшается, это говорит о парадоксальном спазме бронхов в ответ на использование ингалятора.
Прирост ОФВ1 после ингаляции сальбутамола на 400 мл и больше дает практически полную уверенность в диагнозе «бронхиальная астма». В сомнительных случаях может быть назначена пробная терапия ингаляционными глюкокортикоидами (беклометазон по 200 мкг 2 раза в день) в течение 2 месяцев или даже таблетками преднизолона (30 мг/сут) в течение 2 недель. Если показатели бронхиальной проходимости после этого улучшаются – это говорит в пользу диагноза «бронхиальная астма».
В некоторых случаях даже при нормальных показателях ОФВ1 применение сальбутамола сопровождается приростом его величины на 12% и больше. Это говорит о скрытой бронхиальной обструкции.
В других случаях нормальной величины ОФВ1 для подтверждения гиперреактивности бронхов применяют ингаляционную пробу с метахолином. Если она будет отрицательной, это может служить причиной для исключения диагноза астмы. Во время исследования пациент вдыхает возрастающие дозы вещества, и определяется минимальная концентрация, которая вызывает снижение ОФВ1 на 20%.
Применяются и другие пробы для выявления гиперреактивности бронхов, например, с маннитолом или физической нагрузкой. Падение ОФВ1 в результате использования этих проб на 15% и более с высокой степенью достоверности указывает на бронхиальную астму. Проба с физической нагрузкой (бег в течение 5 – 7 минут) широко применяется для диагностики астмы у детей. Применение ингаляционных провокационных проб у них ограничено.
Еще один важнейший метод инструментальной диагностики астмы и контроля за ее лечением – пикфлоуметрия. Пикфлоуметр должен быть у каждого пациента с этим заболеванием, ведь самоконтроль – основа эффективной терапии. С помощью этого небольшого аппарата определяют пиковую скорость выдоха (ПСВ) – максимальную скорость, с которой пациент может выдохнуть воздух. Этот показатель, так же как и ОФВ1, прямо отражает бронхиальную проходимость.
ПСВ можно определять у больных начиная с 5-летнего возраста. При определении ПСВ делается три попытки, записывается лучший показатель. Измеряют величину показателя утром и вечером каждого дня, а также оценивают его вариабельность – разницу между минимальным и максимальным значениями, полученными в течение дня, выраженную в процентах от максимальной величины за день и усредненную за 2 недели регулярных наблюдений. Для людей с бронхиальной астмой характерна повышенная вариабельность показателей ПСВ – более 20% при четырех измерениях в течение дня.
Показатель ПСВ используется преимущественно у людей с уже установленным диагнозом. Он помогает держать астму под контролем. В течение наблюдений определяют максимальный лучший показатель для данного больного. Если отмечается снижение до 50 – 75% от наилучшего результата – это говорит о развивающемся обострении и необходимости усилить интенсивность лечения. При снижении ПСВ до 33 – 50% от лучшего для пациента результата диагностируют тяжелое обострение, а при более значительном уменьшении показателя возникает угроза жизни больного.
Определяемый дважды в день показатель ПСВ нужно записывать в дневник, который приносят на каждый прием к врачу.
В некоторых случаях проводятся дополнительные инструментальные обследования. Рентгенография легких выполняется в таких ситуациях:
- наличие эмфиземы легких или пневмоторакса;
- вероятность воспаления легких;
- обострение, несущее угрозу жизни больного;
- неэффективность лечения;
- необходимость искусственной вентиляции легких;
- неясный диагноз.
У детей младше 5 лет используется компьютерная бронхофонография – метод исследования, основанный на оценке дыхательных шумов, и позволяющий выявить снижение бронхиальной проходимости.
При необходимости дифференциальной диагностики с другими заболеваниями выполняют бронхоскопию (осмотр бронхиального дерева с помощью эндоскопа при подозрении на рак бронхов, инородное тело дыхательных путей) и компьютерную томографию органов грудной клетки.
О том, как проводится исследование функции внешнего дыхания:
источник
Анализ крови на иммуноглобулин – это обследование иммунной системы с целью выявления заболеваний у человека. Он помогает оценить состояние организма и степень тяжести аллергического заболевания, то есть играет главную роль в назначении правильного лечения.
Иммуноглобулины (антитела, гамма-глобулины) – соединения, которые вырабатываются клетками иммунной системы организма. Они защищают человека от различных бактерий и вирусов, а также от антигенов. Иммуноглобулин не только защищает организм человека, но и часто применяется в медицине. При выявлении разнообразных патологий применяют качественные и количественные определения антител различных классов. Иммуноглобулин входит в состав медикаментов, которые применяются с целью профилактики и лечения инфекционных заболеваний.
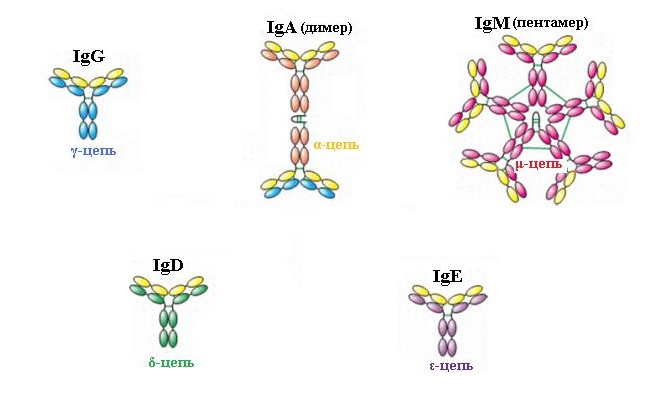
Существует 5 классов иммуноглобулинов: G, M, E, A и D, которые различаются по строению и выполняемым функциям.
- Иммуноглобулин G (IgG) относится к основному классу иммуноглобулинов, которые содержатся в сыворотке крови. Он имеет 4 подкласса (IgG1, IgG2, IgG3, IgG4), которые выполняют свои уникальные функции независимо друг от друга. Иммуноглобулин G начинает вырабатываться через несколько дней после иммуноглобулина М и длительное время сохраняется в организме, не давая повторно заболеть перенесенным заболеванием, а также нейтрализует вредные токсические вещества. Небольшие размеры позволяют ему без препятствий проникать к плоду беременной женщины и защищать его от инфекций. В норме его количество – 70–75% от общего числа антител.
- Иммуноглобулин М (IgM) является первым защитником от антигенов, так как вырабатывается при попадании чужеродного агента в организм человека. Антитела класса М намного крупнее, поэтому у беременных через плаценту он не проникает к ребенку, а содержится только в крови женщины. Количество иммуноглобулина М составляет всего около 10%.
- Иммуноглобулин Е (IgE) в крови практически не наблюдается. Он принимает участие при возникновении аллергической реакции, защищает от инфекций. Его повышение говорит о склонности к аллергическим патологиям и атопиям.
- Иммуноглобулин А (IgA) защищает слизистые оболочки от микроорганизмов и чужеродных веществ, поэтому его еще называют секреторным. Он располагается в секретах слезных и слюнных желез, на слизистой оболочке дыхательной и мочеполовой системы и в молоке. Его концентрация составляет примерно 20%.
- Иммуноглобулин D (IgD) относится к антителам, функции которого ясны не до конца и его количество в крови крайне мало (до 1%). В основном они используются в медицинских препаратах, которые можно приобрести в любой аптеке.
Анализ крови на иммуноглобулин Е сдают при бронхиальной астме, экземе, атопическом дерматите, поллинозе и гельминтозе. Проведение исследования целесообразно с целью определения наличия лекарственной и пищевой аллергии, а также детям для определения возможных наследственных заболеваний, если их родственники страдают аллергическими реакциями.
Для анализа крови на иммуноглобулинпроизводят специальное лабораторное исследование сыворотки крови. Чтобы результаты были наиболее достоверны, необходимо правильно подготовиться к сдаче крови на анализ. Забор крови производится утром, обязательно натощак. Для анализа подходит венозная кровь, которая обычно берется в районе локтя. Желательно за несколько дней до процедуры исключить из рациона алкоголь, жирную и острую пищу, ограничить физические нагрузки и по возможности исключить курение. При приеме каких-либо медицинских препаратов следует сообщить об этом специалисту.
Норма содержания иммуноглобулина в кровяной сыворотке очень мала и колеблется от 30 до 240 мкг/л. Самый высокий уровень антител – в мае, самый низкий – в декабре. Это легко объяснимо. Весной наблюдается активное цветение большинства растений, что приводит к насыщению воздуха пыльцой (одним из самых сильных аллергенов).
В норме показатели имеют следующие значения:
- для детей до 3 мес – 0…2 кЕ/л;
- от 3 до 6 мес – 3…10 кЕ/л;
- дети до года – 8…20 кЕ/л;
- дети от 1 года до 5 лет – 10…50 кЕ/л;
- дети от 5 лет до 15 лет – 16…60 кЕ/л;
- взрослые – 20…100 кЕ/л.
Высокий уровень антител в анализе крови на иммуноглобулин Е у детей говорит о возможном наличии таких заболеваний, как сенная лихорадка, крапивница, атопический дерматит, аллергический ринит, пищевая непереносимость, лекарственная аллергия, заражение паразитами, бронхиальная астма, миелома и другие аллергические заболевания.
Если у детей анализ крови на иммуноглобулин Е понижен, то причинами могут быть наследственная гипогаммаглобулинемия, некоторые виды опухолей или синдром Луи-Бар (атаксия-телеангиэктазия).

Основное содержание антител выявляется на слизистых оболочках дыхательных путей и желудочно-кишечного тракта, а также на коже.
Иммуноглобулин Е появляется в организме человека после 10 недель внутриутробного развития. Его количество постепенно увеличивается от рождения и до подросткового возраста. У пожилых людей его содержание постепенно снижается.
Резкое повышение или понижение иммуноглобулина Е свидетельствует о наличии определенных заболеваний.
источник
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Иммуноглобулин Е (IgE) — класс иммуноглобулинов, обнаруживаемый в норме в незначительных количествах в сыворотке крови и секретах. Впервые IgE был изолирован в 1960-х годах из сывороток больных атопией и множественной миеломой. В 1968 г. ВОЗ выделила IgE как самостоятельный класс иммуноглобулинов. Согласно ВОЗ 1 МЕ/мл (МЕ — международная единица) соответствует 2,4 нг. Обычно концентрация IgE выражается в МЕ/мл или кЕ/л (кЕ — килоединица).
В норме IgE составляет менее 0,001% от всех иммуноглобулинов сыворотки крови (см. табл.1).
Таблица 1: Содержание IgE в сыворотке крови здоровых людей
| Возрастные группы | IgE (кЕ/л) |
|---|---|
| До 1 года | 0 — 15 |
| 1 год-6 лет | 0 — 60 |
| 6 -10 лет | 0 — 90 |
| 10 -16 лет | 0 — 200 |
| Взрослые | 0 — 100 |
Структура IgE подобна структуре других иммуноглобулинов и состоит из двух тяжёлых и двух лёгких полипептидных цепей. Они сгруппированы в комплексы, называемые доменами. Каждый домен содержит приблизительно 110 аминокислот. IgE имеет пять таких доменов в отличие от IgG, который имеет только четыре домена. По физико-химическим свойствам IgE — гликопротеин с молекулярной массой примерно 190000 дальтон, состоящий на 12% из углеводов. IgE имеет самую короткую продолжительность существования (время полувыведения из сыворотки крови 2 — 3 суток), самую высокую скорость катаболизма и наименьшую скорость синтеза из всех иммуноглобулинов (2,3 мкг/кг в сутки). IgE синтезируется главным образом плазматическими клетками, локализующимися в слизистых оболочках. Основная биологическая роль IgE — уникальная способность связываться с поверхностью тучных клеток и базофилов человека. На поверхности одного базофила присутствует примерно 40000 — 100000 рецепторов, которые связывают от 5000 до 40000 молекул IgE.
Дегрануляция тучных клеток и базофилов происходит, когда две связанные с мембраной клеток молекулы IgE соединяются с антигеном, что, в свою очередь, «включает» последовательные события, ведущие к выбросу медиаторов воспаления.
IgE можно обнаружить в организме человека уже на 11-й неделе внутриутробного развития. Содержание IgE в сыворотке крови возрастает постепенно с момента рождения человека до подросткового возраста. В пожилом возрасте уровень IgE может снижаться.
В практике клинико-диагностических лабораторий определение общего и специфического IgE проводится с целью их использования в качестве самостоятельных диагностических показателей. В табл. 2 перечислены основные болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови.
Таблица 2: Болезни и состояния, сопровождающиеся изменением содержания общего IgE сыворотки крови
| Болезни и состояния | Возможные причины |
| I. Повышенное содержание IgE | |
|---|---|
| Аллергические болезни, обусловленные IgE антителами: а) Атопические болезни · Аллергический ринит · Атопическая бронхиальная астма · Атопический дерматит · Аллергическая гастроэнтеропатия б) Анафилактические болезни · Системная анафилаксия · Крапивница — ангионевротический отек | Множественные аллергены: · пыльцевые · пылевые · эпидермальные · пищевые · лекарственные препараты · химические вещества · металлы · чужеродный белок |
| Аллергический бронхопульмональный аспергиллез | Неизвестны |
| Гельминтозы | IgE антитела, связанные с защитным иммунитетом |
| Гипер-IgE синдром (синдром Джоба) | Дефект Т-супрессоров |
| Селективный IgA дефицит | Дефект Т-супрессоров |
| Синдром Вискотт-Олдриджа | Неизвестны |
| Тимусная аплазия (синдром Ди-Джорджи) | Неизвестны |
| IgE — миелома | Неоплазия IgE-продуцирующих плазматических клеток |
| Реакция «трансплантат против хозяина» | Дефект Т-супрессоров |
| II. Сниженное содержание общего IgE | |
| Атаксия — телеангиэктазия | Дефекты Т-клеток |
Ниже приведены в качестве примеров диапазоны содержания общего IgE сыворотки крови (у взрослых) при некоторых патологических состояниях (табл. 3). Однако, несмотря на первоначально кажущуюся простоту использования определения общего и специфического IgE для диагностики, существуют некоторые сложности в интерпретации результатов. Их перечень приведён ниже.
Таблица 3: Значения общего IgE при некоторых патологических состояниях
| Патологические состояния | Содержание IgE (кЕ/л) |
|---|---|
| Аллергический ринит | 120 — 1000 кЕ/л |
| Атопическая бронхиальная астма | 120 — 1200 кЕ/л |
| Атопический дерматит | 80 — 14000 кЕ/л |
| Аллергический бронхолегочный аспергиллез: — ремиссия — обострение | 80 — 1000 кЕ/л 1000 — 8000 кЕ/л |
| Гипер — IgE синдром | 1000 — 14000 кЕ/л |
| IgE — миелома | 15000 кЕ/л и выше |
Особенности интерпретации и диагностические ограничения общего IgE
- Примерно 30% больных атопическими заболеваниями имеют уровень общего IgE в пределах значений нормы.
- Некоторые больные бронхиальной астмой могут иметь повышенную чувствительность только к одному аллергену (антигену), в результате чего общий IgE может быть в пределах нормы, в то время как кожная проба и специфический IgE будут положительными.
- Концентрация общего IgE в сыворотке крови также повышается при неатопических состояниях (особенно при глистной инвазии, некоторых формах иммунодефицитов и бронхопульмональном аспергиллезе) с последующей нормализацией после соответствующего лечения.
- Хроническая рецидивирующая крапивница и ангионевротический отёк не являются обязательными показаниями для определения общего IgE, так как обычно имеют неиммунную природу.
- Границы нормы, определённые для европейцев, не могут быть применены для представителей зон, эндемичных по гельминтозам.
Особенности интерпретации и диагностические ограничения специфического IgE
- Доступность определения специфического IgE не должна преувеличивать его диагностическую роль в обследовании больных с аллергией.
- Обнаружение аллергенспецифического IgE (к какому-либо аллергену или антигену) не доказывает, что именно этот аллерген ответственен за клиническую симптоматику; окончательное заключение и интерпретация лабораторных данных должны быть сделаны только после сопоставления с клинической картиной и данными развёрнутого аллергологического анамнеза.
- Отсутствие специфического IgE в сыворотке периферической крови не исключает возможности участия IgE-зависимого механизма, так как местный синтез IgE и сенсибилизация тучных клеток может происходить и в отсутствие специфического IgE в кровотоке (например, аллергический ринит).
- Антитела других классов, специфичные для данного аллергена, особенно класса IgG (IgG4), могут быть причиной ложноотрицательных результатов.
- Исключительно высокие концентрации общего IgE, например, у отдельных больных атопическим дерматитом, могут за счёт неспецифического связывания с аллергеном давать ложноположительные результаты.
- Идентичные результаты для разных аллергенов не означают их одинакового клинического значения, так как способность к связыванию с IgE у разных аллергенов может быть различной.
В заключении, учитывая всё выше изложенное, а также существующие сложности в постановке и интерпретации кожных проб, перечислим основные показания и противопоказания к назначению специфического аллергологического обследования in vitro — определения специфического IgE (табл. 4).
Таблица 4: Показания и противопоказания к определению специфического IgE
| Показания | |
|---|---|
| 1 | Дифференциальная диагностика между IgE-зависимым и не-IgE-зависимым механизмами аллергических реакций |
| 2 | Больные, у которых невозможно выявить аллерген анамнестически, при помощи дневника и т. д. |
| 3 | Больные с недостаточным эффектом специфической гипосенсибилизации, назначенной по результатам кожных проб |
| 4 | Дермографизм и распространённый дерматит |
| 5 | Больные детского и пожилого возраста с гипореактивностью кожи |
| 6 | Гиперреактивность кожи |
| 7 | Больные, которым невозможно отменить симптоматическую терапию препаратами, влияющими на результаты кожных проб |
| 8 | Отрицательное отношение больного к кожным пробам |
| 9 | В анамнезе системные аллергические реакции на кожные пробы |
| 10 | Несоответствие результатов кожных проб данным анамнеза и клинической картине |
| 11 | IgE-зависимая пищевая аллергия |
| 12 | Необходимость количественной оценки чувствительности и специфичности аллергена |
| 13 | Общий IgE сыворотки крови более 100 кЕ/л |
| Обследование нецелесообразно: | |
| 1 | При атопических заболеваниях в случаях удовлетворительных результатов специфической терапии по данным кожных проб |
| 2 | У больных с не-IgE-зависимым механизмом аллергических реакции |
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
источник
Применение анти – IgE (омализумаб — ксолар) ограничивается пациентами с тяжелым неконтролируемым течением экзогенной БА с повышенным уровнем IgE в сыворотке. Ксолар связывает циркулирующие IgE независимо от их специфичности в биологически инертные комплексы. Российский опыт лечения ксоларом в течение 8 лет свидетельствует о его высоком терапевтическом эффекте и безопасности. Во флаконе 150 мг сухого вещества. Вводится подкожно в 2-4 недели, доза рассчитывается в зависимости от исходного уровня общего IgE и массы тела. Использование этого препарата в широкой практике ограничивается из — за его высокой стоимости
Принцип долгосрочного лечения заключается в назначении терапевтических доз базисного препарата для достижения желаемого эффекта. После стабилизации процесса (не менее 3-х месяцев) дозу постепенно снижают до минимальной поддерживающей, обеспечивающей у больного дыхательный комфорт. При развитии стрессовых ситуаций (ОРВИ, операции, длительное эмоциональное или физическое перенапряжение и т.д.) доза базисного препарата увеличивается. Наиболее предпочтительна форма применения препаратов — ингаляционная.
При интермиттирующей БА базисная терапия не показана, применяются b2-агонисты быстрого действия ситуационно.
К препаратам второй группы относятся быстро действующие адреномиметики (сальбутамол, фенотерол, тербуталин, формотерол), ингаляционные антихолинергические препараты (ипратропия бромид), комбинированные препараты ингаляционных β2-адреномиметиков и ипратропия бромида, теофиллин короткого действия.
При атопической астме легкого течения реже средней степени тяжести в случае верифицированного аллергена при IgE обусловленном варианте проводится аллергенспецифическая иммунотерапия (АСИТ) в условиях аллергологического отделения или кабинета.
При эффективности АСИТ охватываются все патогенетические звенья аллергического процесса. Этот метод обладает длительным профилак-тическим эффектом после завершения лечебных курсов. При этом: снижается тканевая чувствительность к аллергенной экспозиции, уменьшается тканевая гиперреактивность, происходит угнетение признаков аллергического воспаления.
Показания к АСИТ: наличие четко доказанной связи между клиникой заболевания и индуктором — аллергеном при невозможности его элиминации.
Противопоказания к АСИТ: хронические заболевания в стадии декомпенсации, эндокринные заболевания, злокачественные и доброкачественные новообразования, заболевания крови, психические заболевания, хронический вирусный гепатит, туберкулез, диффузные заболевания соединительной ткани.
Относительные противопоказания: острый период любых заболеваний, беременность и период лактации, возраст более 50 лет, наличие паразитоза, астматическая триада с клиническими проявлениями бытовой сенсибилизации.
По материалам взрослого аллергологического отделения ККБ были получены отличные и хорошие результаты после проведения АСИТ у больных с АБА более чем в 80% случаев. Подобные результаты получены аллергологами и других регионов страны.
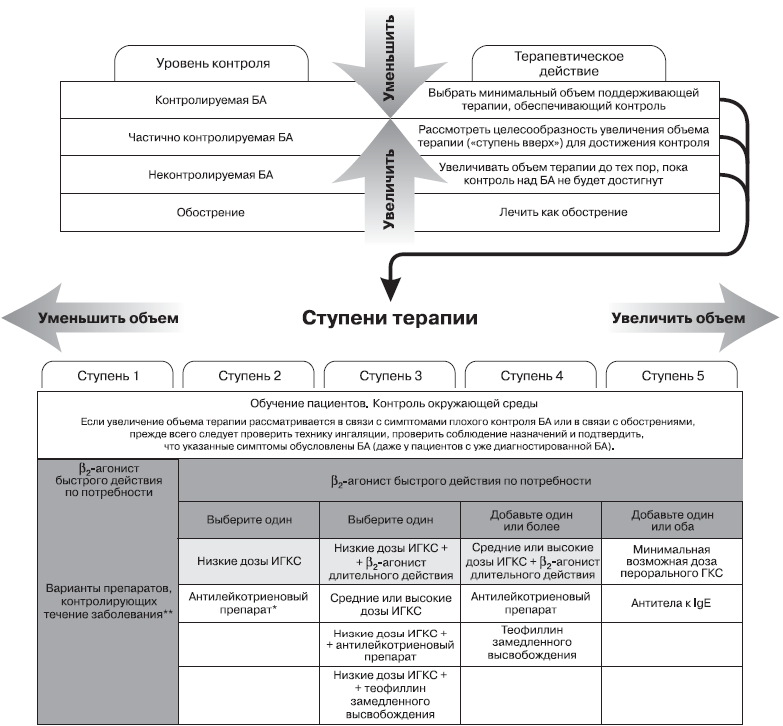
Каждая ступень включает варианты терапии, которые могут служить альтернативами при выборе поддерживающей терапии БА, хотя и не являются одинаковыми по эффективности. Эффективность терапии возрастает от ступени 1 к ступени 5; хотя на ступени 5 выбор лечения зависит также от доступности и безопасности лекарственных препаратов.
У большинства больных с симптомами персистирующей БА, ранее не получавших поддерживающей терапии, следует начинать лечение со ступени 2. Если при первичном осмотре (в случае отсутствии базисной терапии) выявляются выраженные клинические проявления заболевания, то лечение целесообразно, начинать со ступени 3.
На каждой ступени терапии пациенты могут использовать препараты неотложной помощи (β2 агонисты короткого действия). Однако, регулярное использование препаратов неотложной помощи является одним из признаков неконтролируемой БА, и требует изменения объема поддерживающей терапии. Поэтому уменьшение или отсутствие потребности в препаратах неотложной помощи является и важной целью лечения, и критерием его эффективности.
Для ступеней 2–5 имеется множество препаратов, контролирующих течение заболевания.
Ступень 1: препарат неотложной помощи по потребности. Для 1 ступени характерно отсутствие базисной терапии и применение препаратов неотложной помощи по потребности. В случае более частого появления симптомов или эпизодического ухудшения состояния пациентам показана регулярная поддерживающая терапия (ступень 2 или выше) в дополнение к препаратам неотложной помощи по потребности.
Для большинства больных рекомендуемыми препаратами неотложной помощи на ступени 1 являются ингаляционные β2-агонисты быстрого действия. Альтернативными средствами являются ингаляционные антихолинергические препараты, пероральные β2-агонисты короткого действия или теофиллин короткого действия, хотя для этих препаратов характерно более медленное начало действия и более высокий риск побочных эффектов.
Ступень 2: препарат неотложной помощи плюс один препарат для контроля течения заболевания. Ступени 2–5 включают комбинацию препарата неотложной помощи по потребности с регулярной поддерживающей терапией. В качестве начальной поддерживающей терапии БА у больных любого возраста на ступени 2 рекомендуются ИГКС в низкой дозе. Альтернативными средствами для контроля БА являются антилейкотриеновые препараты, в особенности у пациентов, которые не способны или не желают использовать ИГКС, или у пациентов, у которых ИГКС вызывают труднопереносимые побочные эффекты (например, постоянную охриплость голоса), а также у пациентов с сопутствующим аллергическим ринитом.
Ступень 3: препарат неотложной помощи плюс один или два препарата для контроля течения заболевания.
На ступени 3 можно использовать:
· комбинацию низкой дозы ИГКС + ингаляционный β2-агонист длительного действия, прием которой осуществляется с помощью одного ингалятора с фиксированной комбинацией или с помощью разных ингаляторов. Благодаря аддитивному эффекту такой комбинации обычно оказывается достаточно назначения низких доз ИГКС.
· средние или высокие дозы ИГКС
· комбинацию ИГКС в низкой дозе + антилейкотриеновый препарат.
· комбинацию ИГКС в низкой дозе + теофиллин замедленного высвобождения.
Ступень 4: препарат неотложной помощи плюс два или более препаратов для контроля течения заболевания. На ступени 4 используют комбинацию ИГКС в средней или высокой дозе с ингаляционным β2-агонистом длительного действия.
При отсутствии достижения контроля к базисной терапии нужно добавить один или оба из следующих препаратов:
· антилейкотриеновые препараты, особенно у больных с сопутствующим аллергическим ринитом, у курящих пациентов и с ожирением;
· низкие дозы теофиллина замедленного высвобождения, также может повышать эффективность лечения.
Ступень 5: препарат неотложной помощи плюс дополнительные варианты применения средств для контроля течения заболевания. Добавление перорального ГКС к другим препаратам поддерживающей терапии может увеличивать эффект лечения, но сопровождается тяжелыми нежелательными явлениями. Поэтому оно должно рассматриваться как вариант лечения только у больных с тяжелой неконтролируемой БА на фоне терапии, соответствующей ступени 4, при наличии у пациента ежедневных симптомов, ограничивающих активность, и частых обострений.
Показано, что применение антител к иммуноглобулину E (anti-IgE) в дополнение к другим препаратам поддерживающей терапии улучшает контроль над аллергической БА в тех случаях.
Последнее изменение этой страницы: 2016-12-12; Нарушение авторского права страницы
источник
Раздражение и высыпания на коже, затруднение дыхания, зуд – все это явные признаки аллергии. Аллергия – в дословном переводе с латинского «другая реакция» — это ответ организма на поступающие раздражители. Вещество может попасть в тело через кожу, дыхательные пути или с пищей.
«Раздражитель» вызывающий аллергию – это не обязательно вредное вещество, просто организм конкретного человека не может с ним справится. Не смотря на то, что аллергены для каждого человека индивидуальны, опыт многих лет позволил медикам составить список продуктов, на которые во многих случаях происходит отрицательная реакция (повышается иммуноглобулин Е).
В него входят: цитрусовые, экзотические фрукты и овощи, яйца, морская рыба, молоко, мед и пряности, шоколад, пыль, духи и все косметические средства, химические аэрозоли, пыльца деревьев и цветов. Аллергическая реакция также может произойти на некоторые ткани, на животных (особенно тех, у кого много шерсти), обивку мебели и краску.
Долгое время причина появления и механизм аллергической реакции были для ученых вопросом. В середине двадцатого века в медицинской практике впервые употребляется термин – иммуноглобулин Е. Данное вещество постоянно содержится в небольшом количестве в сыворотке крови. У человека, склонного к аллергическим реакциям количество иммуноглобулина Е постоянно повышено.
На данный момент достоверно неизвестен механизм наследования, но, как показывает практика, около 80 процентов детей-аллергиков рождаются у пар с повышенным содержанием в крови иммуноглобулина Е и склонных к аллергии.
Вырабатывается данное вещество в под слизистом слое тканей бета-лимфоцитами – клетками иммунной системы – в ответ на попадание в организм человека чужеродного агента. По своей сути иммуноглобулин Е является белковым веществом. Данные антитела крепятся к наружной клеточной мембране базофилов или тучных клеток, где происходит синтез специализированных биологических активных веществ, отвечающих на попадание чужеродного агента.
Со временем врачи стали дополнительно подразделять иммуноглобулин Е на первый и второй тип. Иммуноглобулин Е 1 типа и появляется в организме во время аллергической реакции немедленного типа. После того, как данное вещество начало контактировать с чужеродным агентом, начинается аллергическая реакция.
Процесс реакции происходит в два этапа: ранний и отсроченный.
В первую очередь повышается проницаемость сосудов, происходят непроизвольные сокращения мускулатуры, возможны даже судороги, ускоряется работа слизистых желез. В этот момент человек начинает чувствовать сильную жажду, может появиться чувство голода.
Затем организм человека мгновенно начинает вырабатывать гормоны — серотонин и гистамин. Эти вещества активизируют выработку противовоспалительных веществ – простагландидов, интерлейкинов и других. Они местно воздействуют на пораженную ткань или орган, не позволяя воспалительному процессу развиваться, или уменьшая его патологические свойства. Благодаря этому и происходят проявления аллергии, такие как сыпь, отек и другие клинические признаки.
Все свойства иммуноглобулина Е на данный момент не изучены, и механизм его действия ясен не до конца. Однако, большинство ученых придерживается мнения, что этот белковый агент обладает противопаразитарным и противопротозойным действием, помогает организму человека справится с непрошенными гостями внутренних органов и нейтрализует их токсическое воздействие.
Анализ крови на иммуноглобулин Е назначается очень часто. Однако, большинство медицинских работников придерживается мнения, что показания одного лишь иммуноглобулина Е на даст полного представления о состоянии иммунной системы и врач не сможет выявить причину отклонения.
Исследование проводится двумя основными методиками: это радиоаллергосорбентный тест и иммуноферментный анализ. Радиоаллергоадсорбентный тест показывает уровень иммуноглобулина при добавлении в кровь определенного аллергена. Если при этом повышается иммуноглобулин Е – анализ положительный, если нет – отрицательный. В анализе крови есть большая погрешность, и он может быть эффективен только при диагностике аллергии. Вторая методика признана значительно более точной и современной.
Иммуноферментный анализ определяет количество иммуноглобулина Е в крови по методу антиген-антитело, что позволяет считать результат исследования максимально достоверным.
Изучение количества иммуноглобулинов в сыворотке крови человека необходимо при диагностике: аллергических реакций и инфекций, подозрении на поражение организма паразитами, бронхиальной астме, поллинозах, аутоиммунных и онкологических заболеваниях, болезнях непонятной этиологии и иммунодефиците. Также обследование будет необходимо произвести при подготовке пациента к хирургическому вмешательству и после операции, после переливания донорской крови и ее компонентов, после перенесения тяжелых заболеваний, а также у новорожденных и детей 1, 3 и 5 лет.
Количество иммуноглобулинов также постоянно проверяется при тестировании новых препаратов и других медицинских разработок. Пациенты, получающие лечение химиотерапией также должны постоянно контролировать содержание иммуноглобулина Е в сыворотке и сдавать кровь не только на общий анализ.
Иммуноглобулин Е впервые синтезируется в организме эмбриона на 10-11 неделе внутриутробного развития и его количество быстро увеличивается вплоть до момента рождения.
Затем темп увеличения снижается, но все же продолжает идти вверх, стабилизируясь в подростковом возрасте 11-14 лет. У пожилых людей старше 55 лет содержание в крови иммуноглобулина Е постепенно снижается, в некоторых случаях прекращает синтезироваться совсем.
Для того, чтобы узнать уровень иммуноглобулина Е, производится лабораторный анализ венозной крови. Сначала отделяется сыворотка, а затем количество иммуноглобулина определяется специальным тестом.
Подготовка к анализу крови на Ig E не требует особых усилий. Существует несколько простых правил:
- Анализы сдаются с утра, до забора крови нельзя употреблять пищу и пить воду.
- За два дня до анализа необходимо исключить из своего рациона жирное, жареное, соленое и острое.
- Исключить аллергены и пряности за сутки до сдачи анализа.
- За сутки до сдачи крови на анализ нельзя употреблять алкоголь, а также курить и использовать наркотические препараты.
- Нельзя употреблять лекарственные препараты, за исключением тех, которые человек принимает постоянно в течение 14 дней до забора крови.
- Нельзя сдавать анализ менее чем за сутки после проведения физиотерапевтических процедур, а также рентгенологического обследования.
- Должно пройти более двух недель после возвращения из другой страны или города.
- Следует отказаться от усиленных физических нагрузок за один-два дня до сдачи анализа.
Иммуноглобулин Е и его норма очень размыта, поэтому для достоверности результата необходимо предупредить лечащего врача или лаборанта о наличие хронических заболеваний, беременности, послеродовом периоде, менструации или периоде грудного вскармливания.Также не лишним будет сдача крови на общий анализ крови.
При расшифровке получившегося результата, следует помнить об индивидуальных особенностях организма, уровне жизни, работе человека и прочих особенностях. Зимой показатель иммуноглобулина Е в крови человека будет в норме ниже, чем летом. Максимальный подъем значений происходит в апреле-мае и в августе-сентябре. Низкий иммуноглобулин Е чаще встречается у жителей северных регионов, чем у жителей южных регионов, при чем у жителей регионов с повышенной влажностью показатель ниже, а с сухим воздухом выше. Однако исследования показывают, если человек всю жизнь прожил в теплом месте, а затем переехал на север, то возможен резкий подъем показателей.
Общий иммуноглобулин Е значительно завышен у работников шахт, пилорамы, фармацевтических и парфюмерных компаний, металлургического и химического производства. Существует еще множество факторов, влияющий на нормальное содержание иммуноглобулина Е, поэтому точную расшифровку анализа может дать только врач.
Норма иммуноглобулина Е у взрослого здорового человека старше 18 лет, живущего в средней полосе, равен от 20 до 100 кЕ/литр у женщин и от 25 до 105 кЕ/литр у мужчин. У беременных женщин нормальный показатель иммуноглобулина Е колеблется от 15 до 125 кЕ/литр. С начала апреля по середину июня и с начала августа по конец сентября нормативы у взрослых могут составлять от 35 до 225 кЕ/литр. У людей старше 55 лет норма иммуноглобулина Е от 15 до 80 кЕ/литр, у людей старше 65 лет от 15 до 70 кЕ/литр, у людей старше 75 лет от 10 до 50 кЕ/литр.
Каждая лаборатория имеет свои маркеры, которые устанавливаются на основании проводимых методов исследования, точности приборов и разницы реагентов. В связи с этим максимально точные нормы анализа может дать только лаборатория, его принимающая.
| Возраст ребенка. | Содержание иммуноглобулина в сыворотке крови. |
| Новорожденный | 0-1 кЕ/литр |
| 1 — 2 месяца | 0-2 кЕ/литр |
| 3 — 6 месяцев | 3-10 кЕ/литр |
| 7 — 12 месяцев | 8-15 кЕ/литр |
| 1 — 2 года | 10-20 кЕ/литр |
| 2 — 5 лет | 10-50 кЕ/литр |
| 5 — 12 лет | 15-50 кЕ/литр |
| 12 — 15 лет (девочки) | 30-90 кЕ/литр |
| 12 — 15 лет (мальчики) | 25-80 кЕ/литр |
| 15 — 18 лет | 20-100 кЕ/литр |
Следует отметить, что анализ на иммуноглобулин Е у детей первого года жизни находящихся на искусственном вскармливании в норме на 2 единицы выше, чем у их сверстников, получающих грудное молоко. Нужно иметь в виду, что каждый раз при введение нового продукта в рацион грудного ребенка происходит выброс антител – уровень иммуноглобулина Е сначала повышается, а затем снова приходит в норму. У детей, рожденных недоношенными или с серьезными родовыми травмами, адекватно оценить нормальный уровень иммуноглобулина Е по возрасту ребенка может только лечащий врач.
Для получения достоверного результата анализа у грудного ребенка его не следует кормить за 3 часа смесью или за 2 часа грудным молоком. Непосредственно перед сдачей анализа крови малышу необходимо дать выпить 20-60 мл теплой кипяченой воды.
Высокие показатели иммуноглобулина в крови человека говорит о развитии какого-то воспалительного или невоспалительного патологического процесса. Основными причинами является: аллергия, пищевое и лекарственное отравление, паразиты (глисты, гельминты, аскариды и другие), доброкачественные и злокачественные опухоли, дерматиты, аутоиммунные заболевания. Для выявления причины болезни пациента одного анализа на иммуногобулин Е бывает недостаточно, следует произвести дополнительные обследования на основании жалоб и сопутствующих симптомов у человека.
Следует отметить, что понижение содержания иммуноглобулина Е в крови человека не является хорошим признаком. Это может являться следствием генетических патологий или онкологических заболеваний. Особенно внимательно нужно относиться к понижению иммуноглобулина Е у детей первых пяти лет жизни.
Алгоритм действия в случае отклонения от нормы иммуноглобулина Е:
- Успокоиться и проанализировать жизнь до анализа. Отметить, не приходилось ли сталкиваться со стрессами или есть экзотическую пищу, возможно, были другие факторы, повлиявшие на результат.
- Пересдать анализ по возможности в другой лаборатории. Следует особенно тщательно отнестись к подготовке.
- Если результат снова оставляет желать лучшего, следует непременно обратиться к врачу-иммунологу для назначения лечения.
Следует понимать, что повышенный показатель иммуноглобулина Е в сыворотке крови – это не заболевание, а симптом заболевания. И лечить следует не повышенный показатель, а избавляться от причины его повышения. Самолечением в данном случае заниматься очень опасно, грамотно лекарства подберет только доктор.
- Если показатели иммуноглобулина Е повышены очень сильно более 300 кЕ/литр) в первую очередь пациенту назначаются капельницы. В качестве растворов чаще всего используют хлорид натрия, хлорид калия и дисоль. Иногда они вводятся совместно с глюкозой и витаминами.
- Для стимулирования и восстановления нормальной работы иммунной системы человека назначаются такие препараты как Арбидол, Виферон, Иммунил.
- Повышенное содержание иммуноглобулина Е зачастую бывает вызвано инфекцией, в этом случае больному назначают специфическое антибактериальное лечение антибиотиками.
- Если было выявлено паразитическое поражение организма, назначаются препараты для лечения – Пирантел, Декарис, Вермокс в зависимости от типа паразитов. Параллельно с этими лекарствами необходимо принимать средства для заселения благоприятной микрофлоры в кишечник – это Линекс, Бифиформ, Биобактон и другие.
- Если повышение иммуноглобулина Е в крови было признаком аллергической реакции, то пациенту назначают антигистаминные препараты. Это Супрастин, Хифенадин, Клемаксин, Димедрол, Зодак и другие.
Обычно одновременно с ними врач назначает кишечные адсорбенты: активированный уголь, Полисорб, Энтеросгель и другие. - Повышение содержания иммуноглобулина Е в крови зачастую вызывает раздражения на коже. Здесь помогут препараты местного воздействия. Нужные препараты: Фенистил гель, Бепантен, Цинковую мазь, Стрептоцид, Эплант. При сильных повреждениях кожи и образовании рубцов может помочь мазь Контрактубекс, Троксевазин и Гепариновую мазь.
Опыт прошлых поколений помог создать множество средств народной медицины для понижения уровня иммуноглобулина Е в крови человека.
- Отвар чеснока. Несколько зубчиков чеснока мелко нарезать или раздробить, добавить в кипяток и варить на медленном огне в течение 15-20 минут. Принимать отвар следует по одному стакану 3-4 раза в день перед едой. Данное средство хорошо помогает в комплексном лечении паразитов.
- Луковая вода. Одну крупную луковицу хорошо помыть (не чистить!), разрезать не несколько частей и положить в кипящую воду. Варить на медленном огне в течение получаса. Принимать отвар следует по одному стакану на ночь. За два часа до приема нельзя ничего употреблять в пищу. Это средство отлично изгоняет из организма паразитов. Можно принимать в комплексе с отваром чеснока.
- Эхинацея. Одну чайную ложку или один фильтр-пакетик залить стаканом горячей, но не кипящей воды. Дать завариться 15-20 минут, принимать 2-3 раза в день. Допустимо добавить в травяной чай сахар. Эхинацея является природным иммуномодулятором и хорошо помогает в комплексе с лечением.
- Лимонная вода. Лимон хорошо промыть и измельчить в блендере или мелко нарезать. Залить крутым кипятком и добавить несколько листьев мяты. Принимать 2 стакана отвара с утра и в течение дня за двадцать минут до приема пищи. Данный отвар хорошо помогает вывести из организма человека шлаки и токсины, может помочь при поражении организма паразитами, а также обладает общеукрепляющим и иммуномодулирующим действием. Однако, следует помнить, что это средство использовать нельзя, если есть подозрение на аллергию.
- Отвар пажитника. Литр молока довести до кипения и кипятить три минуты. Убавить огонь и добавить в молоко 2 столовые ложки семян пажитника. Варить на медленном огне, слегка помешивая, в течение 10 минут. Ни в коем случае не доводить до кипения. Принимать по одному стакану перед принятием пищи по 3-4 раза в день. Это средство народной медицины отлично помогает в комплексном лечении инфекционных заболеваний (за исключением кишечной инфекции). Отвар пажитника может помочь и в комплексной противоаллергической терапии (за исключением случаев, когда у пациента обнаружена аллергия на молочный белок). Данное средство выводит из организма шлаки и токсины, а также обладает иммуномодулирующими свойствами.
- Липовый цвет. Две столовые ложки цветков липы залить горячей, но не кипящей водой. Дать настояться в течение 15-20 минут. Отвар принимать во время еды по 3-5 раз в день. Липовый цвет благотворно влияет на работу иммунной системы, а также хорошо помогает в комплексном лечении инфекционных заболеваний. Данное средство принимать не следует, если у пациента обнаружилась аллергия на липовый цвет или пыльцу.
- Отвар овса. Пять столовых ложек неочищенного овса залить кипятком и варить в течение 15 минут. Отвар залить в термос и оставить на ночь (как минимум, 6-7 часов). Настой должен получиться киселеобразным. Принимать овес с утра по 2 стакана и в течение дня по 1 стакану перед принятием пищи. Данное средство хорошо выводит из организма шлаки и токсины. Вместе с этим отвар овса помогает в комплексной борьбе с паразитами. Он благотворно влияет на кишечник и его функции, помогает восстановить нормальную микрофлору. Также овес обладает противоаллергическими свойствами и может использоваться при лечении аллергии. Аллергия на овес бывает крайне редко.
- Корень одуванчика. Корень одуванчика измельчить и подсушить на сухой сковородке до появления орехового запаха. Затем положить в турку, ковшик или кофеварку и готовить как кофе. Принимать вкусный напиток по 3-4 раза в день во время приема пищи. При отсутствии противопоказаний добавить сахар или любой другой подсластитель. Отвар корней одуванчика обладает противотоксическими свойствами и может использоваться в комплексной борьбе с паразитами. Он общеукрепляюще действует на организм в целом и может помочь справиться с инфекцией скорее. Аллергии на корень одуванчика практически не встречается.
- Чистотел. Траву чистотела залить горячей, но не кипящей водой. Дать настояться отвару с течение получаса. Смочить в растворе ваточку, салфетку или бинт и наносить на пораженную аллергией чистую кожу. Смывать отвар не нужно. Чистотел снимает воспаление, а также смягчает кожу и очищает поры. Использовать средство можно до пяти раз в день.
- Ромашка и зверобой. Взять в равных количествах траву ромашки и зверобоя. Залить горячей, но не кипящей водой. Принимать перед едой по полстакана три раза в день. Помогает при комплексном лечении аллергии и обладает общеукрепляющими свойствами.
- Для кожи. Столовую ложку березовых почек залить стаканом кипятка. Дать настояться в течение 15-20 минут, а затем наносить ваткой на пораженные участки кожи. Это средство быстро снимет отек и воспаление, а также способствует смягчению кожи и скорейшему заживлению ран.
- Для приема внутрь. Пропустить березовые почки через мясорубку или измельчить в блендере. После этого варить в турке или ковшике, как кофе. Принимать вкусный отвар в течение дня три-четыре раза. Это поможет скорее вывести из кишечника незванных гостей-паразитов. Также отвар березовых почек обладает общеукрепляющим действием, благотворно влияет на иммунитет и помогает справиться с внутренними воспалительными процессами и инфекционными заболеваниями. Аллергии на данное средство практически не встречается.
Народные средства являются методом лечения, но для их подбора лучше проконсультироваться со специалистом. Следует помнить, что для скорейшего выздоровления следует вести здоровый образ жизни, принимать не менее 2,5 литров чистой воды каждой день и, конечно, соблюдать рекомендации доктора.
Эти простые условия помогут каждому человеку прожить долгую и счастливую жизнь!
источник