Респираторная вирусная инфекция является одним из основных факторов, способных вызывать обструкцию дыхательных путей, и может быть как триггером обострения бронхиальной астмы (БА), так и этиологическим фактором, формирующим БА у предрасположенных к ней людей.
По данным эпидемиологических исследований, 75–80% обострений БА связаны с острыми респираторными вирусными инфекциями (ОРВИ). В 89% случаев вирусная инфекция у больного астмой вызывает ее обострение [1]. То есть из десяти пациентов с астмой, заболевших респираторной вирусной инфекцией, у девяти усиливаются симптомы астмы. Существует корреляция (особенно выражена у детей) между сезонным подъемом заболеваемости ОРВИ и частотой госпитализаций в связи с обострением БА [2]. Более чем у 40% детей от четырех до 12 лет, страдавших БА, через восемь недель после ОРВИ сохранялась РНК риновируса. Речь идет о детях, у которых приступы астмы носили более тяжелый характер [3]. Кроме того, установлена связь между летальными обострениями астмы и респираторной вирусной инфекцией [4].
На фоне риновирусной инфекции ухудшаются показатели функции внешнего дыхания, повышается уровень эозинофилов в крови и эозинофильная инфильтрация слизистой бронхов [5]. Респираторная вирусная инфекция может способствовать развитию сенсибилизации. В то же время дети и подростки, страдающие аллергическими заболеваниями, склонны к частым острым респираторным заболеваниям. При этом спектр возбудителей ОРВИ у пациентов с аллергической патологией значительно шире и ассоциации вирусов более разнообразны, чем у детей без аллергии [6].
В 2008 г. эксперты Европейской академии аллергологии и клинической иммунологии (European Academy of Allergology and Clinical Immunology – ЕААCI) и Американской академии аллергологии, астмы и иммунологии (American Academy of Allergology, Asthma and Immunology – ААААI) предложили выделять четыре фенотипа БА у детей старше двух лет – аллергениндуцированную, вирусиндуцированную, астму физического напряжения и неопределенную астму. В частности, вирусиндуцированной называют астму, связанную с респираторной вирусной инфекцией. Вместе с тем необходимо понимать, что подобное деление условно, ОРВИ может вызвать обострение при любой форме астмы. В клинической практике нередки ситуации, когда у ребенка с атопией (аллергическим ринитом или атопическим дерматитом либо латентной бытовой сенсибилизацией) первый приступ удушья возникает на фоне вирусной инфекции. Впоследствии, в ближайший год или несколько лет, обострения астмы возникают только на фоне ОРВИ. В таких случаях, особенно когда не проведено аллергологическое обследование, у врача складывается впечатление, что это тип астмы, который ранее называли инфекционно-аллергическим или инфекционно-зависимым. Как следствие – неправильный выбор тактики ведения пациента.
Свистящее дыхание способны вызывать различные вирусы: респираторно-синцитиальный вирус (РСВ), риновирусы, вирусы гриппа А и В, аденовирусы, вирусы парагриппа, коронавирусы, энтеровирусы и др. Как правило, у взрослых и детей старшего возраста причиной бронхиальной обструкции становятся риновирусы – вирусы семейства Picornaviridae [7]. У детей младшего возраста основную роль в возникновении обструкции играет РСВ – РНК-вирус семейства Paramixoviridae [8]. Клинические проявления зависят от возраста, факторов риска и типа респираторного вируса (см. таблицу).
Результаты крупного проспективного исследования [9] показали, что бронхиолит, вызываемый РСВ, является самым существенным фактором риска развития не только астмы, но и атопии у детей в возрасте до трех лет. Обструкция у детей раннего возраста, спровоцированная РСВ, при повторном инфицировании не у всех вызывает свистящие хрипы, тем не менее рассматривается как фактор риска возникновения астмы. Риск максимален при отягощенном аллергологическом семейном анамнезе и генетической предрасположенности к БА. Однако РСВ провоцирует формирование астмы и в отсутствие атопии [10].
В тех случаях, когда БА дебютирует после респираторно-синцитиальной вирусной инфекции, можно выделить дополнительные предрасполагающие факторы: курение матери, наличие у нее БА, повышенный уровень общего иммуноглобулина (Ig) E в сыворотке крови [11].
Эксперты Европейского респираторного общества (European Respiratory Society – ERS) определили наиболее значимые факторы, способствующие развитию вирусиндуцированной БА:
генетические особенности, детерминирующие восприимчивость организма к тяжелым вирусным инфекциям;
нарушения во врожденном и адаптивном иммунном ответе на вирусную инфекцию [12].
В частности, наблюдается дефицит продукции эпителиальными клетками антивирусных интерферонов (ИФН) 1-го типа – ИФН-альфа и ИФН-бета. Клетки астматических пациентов продуцируют в 2,5 раза меньше ИФН-бета. Имеет также место дефицит ИФН 3-го типа – ИФН-лямбда.
Перечислим основные непосредственные механизмы обострения БА на фоне вирусной инфекции:
увеличение гиперреактивности дыхательных путей;
неспецифические и специфические иммунные механизмы. На фоне ОРВИ наблюдается усиление сенсибилизации к ингаляционным неинфекционным аллергенам, а также образование специфических противовирусных IgE. Уровень общего IgE при ОРВИ возрастает у пациентов с атопией и не изменяется у лиц, не страдающих атопическими заболеваниями [13]. В ряде случаев можно выявить только местное повышение концентрации IgE в назофарингеальных смывах и бронхоальвеолярном лаваже. Респираторные вирусные инфекции способны усиливать реакции гиперчувствительности как замедленного, так и немедленного типа в ответ на аллергенную стимуляцию;
нарушение нейрорегуляторных механизмов: повышение активности парасимпатической нервной системы за счет снижения функциональной активности M2-рецепторов и M2-независимых факторов, увеличение высвобождения нейропептидов, снижение уровня нейтральной эндопептидазы, снижение продукции NO;
структурно-механические изменения стенки бронхов (утолщение бронхиальной стенки, заполнение просвета мелких бронхов слизью, клеточным детритом).
Все указанные механизмы в большинстве случаев взаимосвязаны.
Увеличение уровня гиперреактивности бронхов при респираторной вирусной инфекции – основной фактор, приводящий к бронхообструкции. Гиперреактивность обычно развивается и у здоровых людей во время острой инфекции [14] и усиливается не только на фоне непосредственного влияния вируса, но и в результате аллергического воспаления, индуцированного ОРВИ.
В.И. Пыцкий считает, что роль вирусной, особенно респираторно-синцитиальной, инфекции в раннем детском возрасте скорее всего сводится к «отбору» и подготовке к развитию БА у детей c генетически детерминированной гиперреактивностью бронхов. Если не найдется подходящего причинно-значимого фактора или условий для реализации его действия, имеющаяся гиперреактивность будет существовать без прогрессирования в БА [15].
В настоящее время особое значение при формировании сенсибилизации придается гистогематическим барьерам, в частности нарушению барьерной функции слизистых оболочек различного генеза [16]. По мнению И.С. Гущина, состояние гистогематических барьеров, а именно кожи и слизистых оболочек, считается фактором, «делающим ненужным или, напротив, вынуждающим отреагировать аллергическим ответом». В связи с этим роль вирусной инфекции при формировании респираторной сенсибилизации может быть одной из главных. Эпителиальные клетки дыхательных путей – первая мишень респираторной вирусной инфекции. Известно выраженное цитопатическое действие на эпителий, оказываемое вирусами гриппа и РСВ, что приводит к функциональным изменениям как самого эпителия, так и дыхательной мускулатуры.
Кроме того, вследствие повреждения эпителия бронхов обнажаются окончания нервных волокон, которые под действием поллютантов и воспалительных медиаторов выделяют бронхоконстрикторные нейропептиды.
Естественно, роль дыхательного эпителия не сводится только к функции механического барьера. Эти клетки играют центральную роль в вирусной модуляции воспалительного процесса при БА, прежде всего через выход разноообразных цитокинов, хемокинов и факторов роста. В сочетании с аллергеном респираторная вирусная инфекция усиливает степень воспаления дыхательных путей.
В воспалении нижних дыхательных путей, ассоциированном с риновирусной инфекцией, участвуют эозинофилы [15]. У больных астмой эозинофилия, развивающаяся на фоне ОРВИ, сохраняется и в периоде реконвалесценции [14, 17]. Активация эозинофилов респираторным вирусом приводит к значительному выбросу медиаторов, в том числе липооксигеназных метаболитов арахидоновой кислоты – лейкотриенов (LT). Способностью активировать эозинофилы, а также увеличивать уровень LTС4 в назальном секрете больных астмой обладают риновирус и РСВ [18, 19]. В то же время повышение уровня эозинофилов после аллергенной провокации у больных астмой намного существеннее, чем при вирусиндуцированном обострении. Респираторная вирусная инфекция способствует большему притоку в дыхательные пути нейтрофилов и характеризуется нейтрофильной инфильтрацией в сочетании с дегрануляцией эозинофилов [1], то есть приводит к смешанному, эозинофильно-нейтрофильному воспалению.
Лечение вирусиндуцированного обострения БА можно разделить на два основных направления – лечение респираторной вирусной инфекции и противоастматическую терапию.
Специфических противовирусных препаратов, влияющих на респираторные вирусы, таких как ацикловир при герпетической инфекции, в настоящее время нет. Как правило, лечение вирусной инфекции заключается в создании оптимальных условий больному, его иммунной системе для естественного выздоровления. У каждого пациента и врача есть собственный набор домашних средств для лечения ОРВИ (теплое питье, чай с малиной и т.д.). При необходимости используются жаропонижающие средства. Но не следует забывать, что в случае «аспириновой» астмы или при сочетании астмы и полипозного риносинусита прием входящих в набор домашних средств нестероидных противовоспалительных препаратов, равно как и природных салицилатов, противопоказан. Надо также учитывать, что ОРВИ протекает у больного с хронической респираторной патологией (бронхиальной астмой), поэтому в некоторых ситуациях возможно применение противовирусных препаратов, иммуномодуляторов, антибактериальных средств (при развитии вторичной бактериальной инфекции).
Лечение бронхиальной астмы исходя из степени ее тяжести и клинических рекомендаций и стандартов лечения (базисная терапия, бронхолитическая, муколитическая) в большинстве случаев предусматривает повышение дозы базисного препарата (если базисная терапия проводилась до ОРВИ) либо использование более эффективного средства базисной терапии.
В настоящее время самым эффективным средством базисной противовоспалительной терапии, входящим в стандарты лечения БА, признаны глюкокортикостероиды (ГКС). Однако однозначных данных о том, что адекватная базисная терапия способна предотвратить вирусиндуцированное обострение астмы, нет. В Клиническом руководстве по ведению больных с инфекциями нижних отделов дыхательных путей ERS и Европейского общества по клинической микробиологии и инфекционным заболеваниям (European Society of Clinical Microbiology and Infectious Disease – ESCMID) сказано, что не существует доказательств эффективности регулярного приема каких-либо препаратов с целью предотвращения эпизодов вирусной бронхообструкции. Не указано и на то, что лечение обычной ОРВИ антибиотиками или противовирусными препаратами не предотвращает инфекцию нижних дыхательных путей.
Как показали результаты исследований, применение будесонида в основной группе пациентов уменьшало выраженность свистящих хрипов в дневное и ночное время по сравнению с контрольной группой, но различия были незначительны [20]. Терапия будесонидом в течение четырех месяцев не предотвращала развитие эпизодов свистящих хрипов в большей степени, чем плацебо [21].
Аналогичные данные получены для беклометазона дипропионата. По сравнению с плацебо беклометазона дипропионат улучшал легочные показатели, но не показывал клинически значимого преимущества у детей школьного возраста при вирусиндуцированном обострении БА [22].
В другом исследовании беклометазона дипропионат по сравнению с тербуталином у детей дошкольного возраста более существенно снижал выраженность дневных и ночных симптомов. Однако длительность сохранения симптомов и потребность в бронхолитической терапии при назначении беклометазона существенно не изменились [23].
Вместе с тем у некоторых пациентов антилейкотриеновые препараты более эффективны (в отношении улучшения спирометрических показателей и контроля БА), чем ингаляционные ГКС [24].
Кроме того, в 2010 г. эксперты GINA (Global Initiative for Asthma – Глобальная инициатива по лечению и профилактике БА), анализируя недостаточную эффективность ступенчатого подхода к терапии у ряда больных, выделили два основных фенотипа БА – с эозинофильным (ИГКС эффективны) и нейтрофильным (ИГКС менее эффективны) воспалением. Как уже отмечалось, при вирусиндуцированном обострении имеет место нейтрофильный компонент воспаления. По данным исследования in vitro, монтелукаст (блокатор LT-рецепторов) может влиять на нейтрофильное воспаление по механизму, не связанному с блокадой цистеиниловых LT-рецепторов, – за счет неспецифического ингибирования циклических нуклеотидных фосфодиэстераз, результатом которого является цАМФ-зависимое подавление провоспалительной активности нейтрофилов [25].
Все это говорит о том, что в лечении вирусиндуцированной астмы антилейкотриеновые препараты играют существенную роль. Наиболее удобным и часто используемым считается монтелукаст. Его можно использовать как альтернативу ингаляционным ГКС (иГКС) при нетяжелых формах астмы, а также как дополнительное средство базисной терапии к иГКС (такая комбинация позволяет уменьшить необходимую дозу ГКС). Кроме того, монтелукаст показан при стероидофобии. Поскольку препарат принимается перорально, его могут использовать пациенты, не способные пользоваться ингалятором.
Клиническая эффективность препарата Синглон
Дженериком с доказанной биоэквивалентностью оригинальному монтелукасту является Синглон (компания-производитель «Гедеон Рихтер», Венгрия). Препарат используется один раз в сутки: у детей от двух до пяти лет жевательные таблетки в дозе 4 мг, у детей 6–14 лет – также жевательные таблетки в дозе 5 мг, у подростков с 15 лет и у взрослых – в дозе 10 мг.
Эффективность Синглона была изучена в рандомизированном проспективном трехмесячном исследовании у 30 взрослых пациентов со среднетяжелым течением бронхиальной астмы [26]. Пациентам основной группы к стандартной базисной потивоастматической терапии (иГКС + бета-2-агонист длительного действия) добавляли Синглон 10 мг/сут. При сравнении с пациентами контрольной группы (только стандартная базисная терапия) отмечалось уменьшение частоты обострений астмы, увеличение продолжительности межприступного периода, а также снижение суточных колебаний пиковой скорости воздушного потока.
В педиатрической практике клиническая эффективность Синглона исследована у 250 детей с острым обструктивным бронхитом и БА в остром периоде [27]. Основную группу составляли 115 детей, принимавших Синглон. В контрольную группу были включены 135 пациентов, получавших терапию бета-2-агонистами. На фоне применения препарата Синглон в 87% случаев при обструктивном бронхите и в 67% случаев при астме сократилось количество используемых медикаментов. Эффективность Синглона, подтвержденная данными физикального обследования, лабораторными и спирографическими показателями, при БА составила 83%. Отмечалась хорошая переносимость и безопасность препарата (общее количество побочных эффектов менее 2%).
Таким образом, препарат Синглон можно рекомендовать в составе терапии БА у детей и взрослых.
источник
Аденовирусная инфекция — острая патология, вызываемая аденовирусом. Заболевание проявляется общей интоксикацией организма, воспалением носоглотки, признаками кератоконъюнктивита, тонзиллофарингита и мезаденита.
Аденовирусная инфекция имеет широкое распространение. На нее приходится около 10% всех патологий вирусной этиологии. Наиболее высокие показатели заболеваемости отмечаются в осенне-зимний период из-за снижения системного иммунного статуса.
Регистрируются как спорадические случаи патологии, так и вспышки эпидемий.
Виды поражения аденовирусом:
- Геморрагический конъюнктивит развивается после перенесенной респираторной инфекции или в результате заражения в воде бассейнов или поверхностных водоемов;
- ОРВИ – во вновь образованных детских и взрослых коллективах;
- Кератоконъюнктивит у новорожденных;
- Менингоэнцефалит — редкая форма, развивающаяся у детей и взрослых;
- Внутрибольничное инфицирование — результат лечебных манипуляций.
Возбудителем заболевания является аденовирус, который был выделен впервые из аденоидов и миндалин больных детей. Он состоит из ДНК, покрытой капсидом, благодаря которому вирус сохраняет свои патогенные свойства и является устойчивым к холоду, высушиванию, воздействию щелочей, эфира.
Резервуар инфекции – больной или вирусоноситель.
Механизмами передачи возбудителя являются:
- Аэрозольный или капельный, который реализуется воздушно-капельным путем,
- Фекально-оральный, реализуемый алиментарным, водным и контактно-бытовым путем.
Вирусы паразитируют в эпителиальных клетках дыхательных путей и тонкого кишечника. Капилляры слизистой расширяются, подслизистый слой гипертрофируется, происходит его инфильтрация лейкоцитами, появляются точечные геморрагии. Клинически эти процессы проявляются воспалением глотки, миндалин, конъюнктивы, кишечника.
Вирусы с током лимфы проникают в лимфоузлы, накапливаются там, что приводит к развитию периферической лимфаденопатии и мезаденита. Подавляется активность макрофагального звена иммунитета, поражается эндотелий сосудов, развивается вирусемия.
Возбудители гематогенным путем попадают в различные органы. Часто вирусы фиксируются в печени и селезенке с развитием гепатоспленомегалии.
Существует несколько классификаций заболевания по группам:
- По тяжести — легкая, среднетяжелая и тяжелая;
- По течению — гладкое, осложненное;
- По типу — типичная и атипичная;
- По выраженности клинической симптоматики — с преобладанием симптомов интоксикации или с преобладанием местных изменений.
Инкубационный период длится 2 недели и характеризуется проникновением аденовирусов в клетки и их последующей гибелью.
Продрома – стадия предвестников болезни, которая наблюдается от первых проявлений до развернутой клинической картины. Она длится 10-15 дней и проявляется слабостью, усталость, разбитостью.
Характерная особенность заболевания — поражение органов и систем в строгой последовательности: от носа и роговицы глаз до кишечника.
У взрослых аденовирусная инфекция проявляется следующими признаками:
- Симптомами интоксикации — лихорадкой, головной, мышечной, суставной болью.
- Нарушением носового дыхания и обильными слизистыми выделениями из него;
- Воспалением миндалин: они отечные, рыхлые, красные с беловатым точечным налетом;
- Лимфаденитом.
Лимфаденит и воспаление миндалин – признаки аденовирусной инфекции
Инфекция спускается вниз и поражает глотку, трахеи и бронхи. Развивается ларингит, фарингит или трахеит с дальнейшим присоединением бронхита. Симптомами патологий являются:
- Охриплость;
- Сухой мучительный кашель, который постепенно становится влажным;
- Боль в горле;
- Одышка.
Кератоконъюнктивит – воспаление конъюнктивы и роговицы глаз, проявляющееся ощущением песка в глазах, их покраснением, инъецированием склер, болью, образованием корочек на ресницах и пленок на конъюнктивальной оболочке. На роговице появляются белесоватые точки, которые сливаются, что приводит к помутнению роговицы.
При одновременном развитии конъюнктивита и фарингита возникает фарингоконъюнктивальная лихорадка.
Поражение кишечника сопровождается мезаденитом — воспалением лимфоузлов брыжейки, которое сопровождается приступообразной болью в животе, интоксикацией и дисфункцией кишечника. Для мезентериального лимфаденита характерна клиника «острого живота».
Осложнениями заболевания у взрослых являются следующие патологии: фронтит, гайморит, евстахиит, гнойный средний отит, вторичная бактериальная пневмония, бронхообструкция, заболевания почек.
Аденовирусная инфекция у детей проявляется следующими признаками:
- Интоксикационный синдром. Ребенок часто капризничает, становится беспокойным, плохо спит, часто срыгивает,
у него ухудшается аппетит, возникает кишечная колика и диарея.
- Дыхание носом затрудняется, развивается фарингит, трахеит, тонзиллит. Вначале заболевания отделяемое носа имеет серозный характер, а затем сгущается и становится слизисто-гнойным.
- Симптомы фарингита — боль и першение в горле, покашливание. Миндалины гипертрофируются и выходят за небные дужки, которые краснеют и отекают. На гиперемированной задней стенке глотки появляются очаги ярко-красного цвета, покрытые слизью или белесоватыми наложениями.
- Бронхит развивается при присоединении бактериальной инфекции. Он проявляется сухим, навязчивым кашлем, который сильно беспокоит малыша. Спустя некоторое время кашель увлажняется, и появляется мокрота.
- Конъюнктивит — частый признак заболевания, который появляется к 5 дню недомогания. Детей беспокоят резь и жжение в глазах, боль, слезоточивость, ощущение помехи, зуд. Слизистая глаз краснеет и отекает, ресницы слипаются, на них появляются корочки, представляющие собой засохшее отделяемое воспаленной конъюнктивы.
- Возможно развитие гастроэнтерита, а также распространение инфекции на мочевыводящие пути, что проявляется жжением при мочеиспускании и появлением крови в моче.
Больной ребенок имеет типичный внешний вид: пастозное лицо, отечные и гиперемированные веки, суженная глазная щель. При пальпации обнаруживаются подвижные и увеличенные лимфоузлы. Для маленьких детей характерно нарушение стула — диарея.
У грудничков заболевание развивается крайне редко, что связано с наличием пассивного иммунитета. Если инфицирование все же произошло, то заболевание протекает тяжело, особенно у детей с перинатальной патологией. У больных после присоединения бактериальной инфекции появляются признаки дыхательной недостаточности. Это может привести к летальному исходу.
По степени тяжести выделяют три формы аденовирусной инфекции:
- Легкая — с температурой менее 38,5°С и интоксикацией.
- Среднетяжелая – с температурой до 40°С без интоксикации.
- Тяжелая — с развитием осложнений: воспаления бронхов или легких, кератоконъюнктивита.
Осложнения патологии у детей — воспаление среднего уха, круп, бронхит, пневмония, энцефалит, дисфункция сердечно-сосудистой системы, пятнисто-папулезная сыпь на коже.
Диагностика патологии включает изучение эпидемиологической ситуации, сбор жалоб и анамнеза болезни, серодиагностику и вирусологическое исследование отделяемого носоглотки.
Признаки аденовирусной инфекции:
- Характерный эпидемиологический анамнез;
- Сочетание интоксикации, симптомов воспаления носоглотки и слизистой глаз;
- Волнообразное течение;
- Экссудативное воспаление;
- Полиаденит;
- Гепатолиенальный синдром.
Большое значение для диагностики патологии имеет последовательность возникновения симптомов.
Дифференциальную диагностику аденовирусной инфекции следует проводить с гриппом. Отличительной чертой последнего является преобладание симптомов интоксикации над катаральными явлениями. При гриппе также отсутствует гепатоспленомегалия, лимфаденит, нарушение носового дыхания. Точно определить этиологию заболевания можно только с помощью лабораторной диагностики.
Лабораторные методы исследования позволяют подтвердить диагноз. К ним относятся:
- Иммуноферментный анализ – обнаружение в пораженных клетках эпителия аденовирусного антигена;
- Вирусологический метод заключается в выявлении в смывах с носоглотки, крови или фекалиях аденовирусов;
- Серодиагностика — реакция нейтрализации, реакция связывания комплимента.
Лечение аденовирусной инфекции заключается в использовании противовирусных препаратов, иммуномодуляторов и иммуностимуляторов, антибиотиков общего и местного действия, препаратов для снятия симптомов.
- Противовирусную терапию начинают с применения
широкоспекторных вироцидных препаратов. К ним относятся: «Арбидол», «Зовиракс», «Оксолиновая мазь».
- Иммуномодуляторы – природные интерфероны: «Гриппферон», «Кипферон», «Виферон» и синтетические интерфероны: «Полиоксидоний», «Амиксин».
- Иммуностимуляторы – «Кагоцел», «Изопринозин», «Имудон», «Имунорикс».
- Антибактериальную терапию начинают после появления симптомов вторичной бактериальной инфекции и развития осложнений. Местные антибактериальные средства – «Граммидин», «Биопарокс», «Стопангин». Антибиотики общего действия – «Амоксиклав», «Сумамед», «Супракс», «Цефотаксим».
- Симптоматическое лечение заключается в снятии отека со слизистой оболочки с помощью сосудосуживающих капель, промывании носа физраствором или «Аквамарисом», проведении противокашлевой терапии с помощью противокашлевых средств «Синекод», «Гиделикс», отхаркивающих и муколитических препаратов «АЦЦ», «Амбробене».
- Больным детям показан постельный режим, обильное теплое питье и щадящее питание.
- Если температура у ребенка выше 38,5°С, следует воспользоваться жаропонижающими средствами в соответствии с возрастом – «Нурофен», «Панадол». Хорошо снижают температуру у детей уксусные обтирания тела.
- Этиотропное лечение заключается в применении «Интерферона», «Виферона».
- Теплое молоко с содой помогает справиться с сухим кашлем. Таким же действием обладает подогретая щелочная минеральная вода. Борьбу с влажным кашлем проводят путем использования отхаркивающих средств – «Амброксол», «Бромгексин».
- Лечение конъюнктивитау ребенка заключается в промывании глаз слабым раствором перманганата калия или некрепким чаем, а затем закапывании глаз раствором «Сульфацил натрия» или «Левимицитина».
- При появлении симптомов ринита больным закапывают в нос «Пиносол», «Називин», «Тизин» после очищения слизистой физраствором или «Аквамарисом».
- Общеукрепляющая терапия — поливитамины.
Основные профилактические мероприятия направлены на повышение общей резистентности детского организма и изоляцию больных детей из организованного коллектива.
- Оздоровительные процедуры — закаливание, правильное питание;
- Прием растительных адаптогенов — настойки элеутерококка, лимонника, эхинацеи;
- Периодический прием витаминно-минеральных комплексов, а в осенне-зимний период — иммуномодулирующих и иммуностимулирующих препаратов.
- Хлорирование воды в бассейнах.
- Профилактика сквозняков и переохлаждений, одежда по погоде.
- Уменьшение контактов в эпидемический сезон, исключение посещения массового скопления людей.
После изоляции больного ребенка из детского коллектива в помещении проводят заключительную дезинфекцию. Окружающие предметы обрабатывают хлорсодержащими растворами — хлорамином или сульфохлорантином. Экстренная профилактика проводится в очаге путем назначения контактным детям иммуностимуляторов.
Если произошла эпидемическая вспышка заболевания, необходимо объявить карантин для предотвращения распространения инфекции. В эпидемическом очаге медицинский персонал должен носить маски и менять их через каждые три часа.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Инфекции дыхательных путей играют важную роль в патогенезе бронхиальной астмы, ухудшая мукоцилиарный клиренс, нарушая нейрогенную регуляцию тонуса гладкой мускулатуры бронхов, приводя к повреждению эпителия дыхательных путей и повышению сосудистой проницаемости, усилению продукции IgE и т. д. Формирующаяся в результате этого гиперреактивность бронхов обусловливает развитие и обострение бронхиальной астмы.
Respiratory infections play an important role in the pathogenesis of bronchial asthma by deteriorating the mucociliary neurogenic regulation of bronchial smooth muscle tone, resulting in respiratory epithelial damage and increasing vascular permeability, enhancing IgE production, etc. Associated bronchial hyperreactivity leads to the development and exacerbation of bronchial asthma.
Е.О. Балкарова — НИИ Пульмонологии МЗ РФ, Москва
А.Г. Чучалин — академик, директор НИИ Пульмонологии МЗ РФ, Москва
Ye.O. Balkarova — Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
A.G. Chuchalin — Academician, Director, Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
С овременное определение бронхиальной астмы (БА), предложенное в Международном соглашении по БА (GINA, 1995), трактует астму как хронический воспалительный процесс нижних дыхательных путей (ДП). Эта концепция отражает важное патогенетическое значение инфекционного звена в формировании БА [1, 2]. Показано, что одним из факторов, способствующих развитию БА и вызывающих ее обострение, является респираторная вирусная инфекция [1, 3 – 8].
В основу современной классификации вирусов заложены тип нуклеиновой кислоты, наличие или отсутствие суперкапсида (внешней оболочки), позитивность или негативность генома, механизм репликации. Вирусы человека и животных включают 17 семейств, причем 8 из них составляют патогенные респираторные вирусы, способные вызывать патологию ДП (табл. 1) .
Наиболее значимыми в отношении патологии ДП у пациентов с БА являются вирусы гриппа, парагриппа типов 1, 2, 3, РС-вирус, риновирусы и аденовирусы.
Заболевания, вызываемые вирусами, известны с древнейших времен. Так, грипп был описан как “итальянская лихорадка” еще в VI – X веках до н.э. Впервые достоверное описание гриппа (от фр. “la grippe” – охватывать) сделал французский исследователь Паскье в 1403 г.
В 1957 г. Chanock и Finberg (США) выделили РС-вирус у детей с поражениями нижних ДП. РС-вирусная патология широко распространена в мире и считается ведущей в патологии нижних ДП человека.
Риновирусная инфекция (заразный насморк-common cold) была известна еще 60 лет назад. Более полно эта инфекция была изучена в начале 60-х годов, когда Tyrell и соавт. выделили цитопатогенные вирусы, вызывающие болезнь. Риновирус имеет глобальное распространение.
Изучение группы аденовирусных болезней началось с 1953 г. Rowe и соавт. впервые выделили штаммы нового вируса из удаленных у детей аденоматозных полипов и миндалин и культивировали их по методу Enders на тканях, в которых они вызывали дегенерацию, в связи с чем эти вирусы получили название “adenoid degeneration”. Термин “аденовирусы” был предложен Enders и соавт. в 1956 г. Распространены они повсеместно и циркулируют круглогодично.
Таблица 1. Респираторные вирусы, способные вызывать патологию ДП
b- herpesviridae
Gammaherpesviridae
Cytomegalovirus
Lymphocruptovirus
Таблица 2. Респираторные вирусы, приводящие к обострению БА в различных возрастных группах
Рис. 1. Факторы, способствующие изменению реактивности ДП после РВИ [9].
В 1956 г. Chanock описал вирус СА (croup associated), который затем был назван вирусом парагриппа, поскольку имеет много общего с вирусом гриппа. Он также широко распространен.
Биологические свойства вирусов, так же как и особенности макроорганизма, определяют поражение того или иного отдела респираторного тракта и, следовательно, клинические проявления заболевания. Возраст пациентов до некоторой степени обусловливает восприимчивость к различным группам вирусов [8], способствующих обострению и развитию БА (табл. 2) .
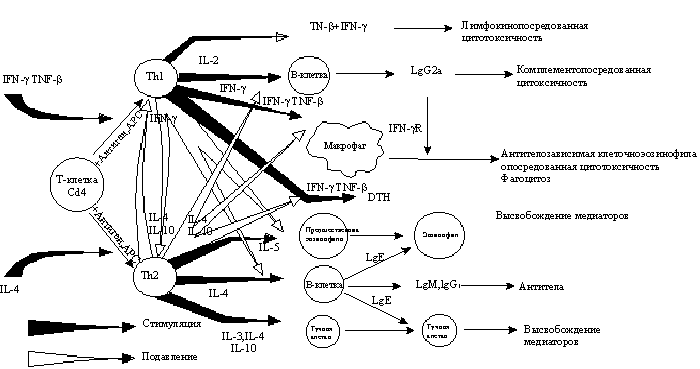
Рис. 2. Регуляция взаимодействия клеток и развитие аллергической реакции [24].
В современной литературе важное значение в формировании БА придается хроническим респираторно-вирусным инфекциям (РВИ) [9]. Известно,что продуктивный тип взаимодействия вируса с клеткой может приводить к длительной персистенции вируса, в то время как интегративный тип обусловливает латентное течение заболевания и вирусоносительство. Особенностью данного типа взаимодействия является и то, что под действием ряда физических и химических факторов репродукция вируса может повторяться и этот процесс может иметь длительное, иногда пожизненное течение [10].
Таблица 3. Сезонность распространения респираторных вирусов, ассоциированных с обострением БА
Острые РВИ возникают в виде эпидемических вспышек, при этом патогенные свойства вирусов изменяются в зависимости от времени года (табл. 3) , что необходимо учитывать при профилактике обострений у пациентов с БА .
Рис. 3. Механизмы развития эпизодической и хронической астмы на фоне аллергического воспаления.
Один из важных компонентов патогенного воздействия РВИ – ухудшение мукоцилиарного клиренса и облегчение продвижения бактерий в нижние отделы ДП, а также подавление фагоцитарной активности альвеолярных макрофагов с блокадой внутриклеточных бактерицидных процессов [6, 11, 12]. В результате этого создаются условия для присоединения бактериальной инфекции и формирования вирусно-бактериальных ассоциаций [13, 14]. Микст-инфекция приводит к более тяжелому течению обострений и изменению клинической картины заболевания [6, 7]. Чаще всего при РВИ выявляется инфицирование Mycoplasma pneumonia, что приводит к более тяжелому течению обострения БА. Смешанная гриппозно-аденовирусная инфекция регистрируется в 10 – 15 % случаев во время эпидемии гриппа. В межэпидемическое время сочетание парагриппа и аденовирусной инфекции отмечается в 2,5 – 4% случаев. Особенностями клинической картины обострения БА на фоне этой инфекции являются выраженный интоксикационный синдром, увеличение лихорадочного периода, преобладание признаков воспаления верхних ДП. Сочетание РС-вирусной инфекции с какой-либо другой вирусной или бактериальной инфекцией чаще приводит к обострению хронических заболеваний респираторного тракта.
Таблица 4. Противовирусные препараты
Активность в отношении РВН
Основные побочные реакции
(профилактика)
2 раза в сутки
(мазь, капли)
РВИ провоцирует обострения БА, очевидно также участие РВИ в формировании гиперреактивности бронхов (ГРБ) у здоровых. Механизмы этого воздействия изучены не полностью, однако известно, что при РВИ выявляются функциональные и патоморфологические изменения ДП: изменение нейрогенной регуляции тонуса гладкой мускулатуры бронхов, повреждение эпителия ДП, повышение сосудистой проницаемости, продукции Ig E, развитие поздних аллергических реакций. Все эти механизмы участвуют в формировании ГРБ, обусловливающей развитие и обострение БА [12, 13]. Подробнее каждый из перечисленных механизмов будет рассмотрен ниже.
Нейрогенные механизмы — одно из важных звеньев в патогенезе ГРБ. РВИ является одним из факторов, приводящих к нарушениям нейрогенной регуляции тонуса гладкой мускулатуры бронхов [15]. Исследования последних лет продемонстрировали роль дисбаланса между возбуждающими и тормозящими путями адренергической, холинергической иннерваций, а также, так называемой неадренергической нехолинергической системы (НАНХ). Факторы развития синдрома ГРБ при вирусной инфекции представлены на рис. 1.
Воздействие вирусного агента, приводя к десквамации эпителиальных клеток ДП, активизирует ирритантные рецепторы, что проявляется гипервосприимчивостью к ингаляционным патогенам, холодному воздуху, поллютантам окружающей среды. В совокупности с повышенной чувствительностью вагусных окончаний этот процесс может вызывать бронхиальную обструкцию.
Определенное значение в нарушении регуляции тонуса гладкой мускулатуры ДП придается степени адренергического дисбаланса (снижению b — и возрастанию a -адренергической активности), возникающего при РВИ [8, 15].
Особый интерес представляет автономная НАНХ-система. Медиаторы этой системы – нейропептиды, образующиеся в эндокринно-активных клетках слизистой оболочки ДП, – включают регуляторные пептиды с бронходилатирующим (гистидин-метионин, вазоактивный интестинальный пептид) и бронхоконстрикторным (субстанция Р, тахикинин, галанин, нейропептид U, кальциеподобный пептид) действием. Ряд исследователей подтверждает важное значение субстанции Р как активного медиатора воспаления. Вирусная инфекция, вызывая снижение активности нейтральной пептидазы, усиливает действие субстанции Р [16]. Регуляторные пептиды имеют важное значение в развитии ГРБ при вирусной инфекции.
Острое катаральное воспаление, развивающееся под действием респираторных вирусов, приводит к десквамации эпителия ДП [1]. В зависимости от рода вируса повреждающее действие затрагивает разные уровни респираторного тракта (см. табл. 1).
Патогенное действие РВИ определяется несколькими механизмами. Во-первых, это непосредственное повреждающее действие вирусной частицы на цилиндрический мерцательный эпителий, вследствие чего облегчается доступ патологических агентов (антигенов) и макромолекул к подслизистому слою. Это подтверждено экспериментально: механическое удаление эпителия усиливает констрикторный эффект спазмогенов [17]. Во-вторых, поврежденные клетки эпителия высвобождают медиаторы воспаления, воздействующие на субэпителиальные чувствительные рецепторы и нервные окончания, приводя к активации нервно-рефлекторных механизмов. Кроме того, РВИ приводит к снижению функциональной активности мерцательного эпителия с последующей атрофией ресничек и “параличом” цилиарного аппарата. В результате этого повышается вязкость бронхиального секрета и создаются условия для продвижения инфекционного агента в нижние отделы респираторного тракта. Определенное значение придается также назовагусному рефлексу, посредством которого респираторный вирус может способствовать формированию ГРБ и бронхообструкции.
Формирование ГРБ в ответ на альтерацию эпителия подтверждено в ряде экспериментов. Так, при изучении свойств трахеи человека, инкубировавшейся с вирусом гриппа, были отмечены выраженная десквамация эпителиальных клеток, усиление ответа на воздействие субстанции Р и снижение активности нейтральной эндопептидазы – энзима, ингибирующего субстанцию Р [18].
Следующим этапом в патогенезе ГРБ является изменение клеточного аппарата эпителия ДП и вовлечение в процесс эффекторных клеток воспаления. После контакта с вирусным агентом (чаще РС-вирусом, риновирусом и вирусом парагриппа типа 3) развивается ранняя астматическая реакция [19 – 21], результатом которой являются IgE-опосредованная дегрануляция тучных клеток [9], выброс хемотаксического фактора эозинофилов и нейтрофилов, гистамина, лейкотриенов (ЛТС 4 , ЛТД 4 , ЛТЕ 4 ) и фактора активации тромбоцитов (ФАТ), обладающих бронхосуживающим свойством [19,21]. Кроме того, высвобождается простагландин ПГД 2 , вызывающий констрикцию ДП человека. ПГД 2 потенцирует также бронхоконстрикторную реакцию на гистамин и холинергические агонисты у больных БА.
Показано, что эозинофильная инфильтрация ДП – характерный дифференциально-диагностический критерий астмы [1, 11]. Активация эозинофилов респираторным вирусом приводит к значительному выбросу медиаторов – ЛТС 4 , ЛТВ 4 , тромбоксана А 2 , ФАТ, кислородных радикалов, основных белков [1, 22], что в свою очередь вызывает альтерацию эпителия. Важную роль играет ФАТ, селективно притягивающий эозинофилы. что влечет за собой эозинофильную инфильтрацию ДП, а также высвобождение эозинофильной пероксидазы. Эти процессы приводят к длительному повышению бронхиальной реактивности.
РВИ посредством выработки IgE повышает активность альвеолярных макрофагов, результатом чего является выработка таких медиаторов воспаления, как тромбоксан, ПГ, ФАТ, отвечающих за развитие поздней фазы аллергических реакций [9, 23]. Так, на фоне экспериментальной риновирусной инфекции было отмечено значимое повышение уровня гистамина как в острой фазе, так и в течение 4 нед после заражения. Отмечались признаки бронхообструкции, снижение эффективности бронходилататоров, развитие отсроченных аллергических реакций, изменения дыхательного паттерна [12]. Это подтверждает значение РВИ в формировании поздней фазы аллергических реакций [19, 21].
Следовательно, РВИ, потенцируя выработку эффекторными клетками множества сильнодействующих хемотаксических факторов, обусловливает повышение бронхиальной реактивности у здоровых людей и клинические проявления обострений у пациентов с БА. Воздействие гистамина, ПГ, ЛТ прямо приводит к сокращению гладкой мускулатуры бронхов, увеличению секреции слизи в ДП, повышению проницаемости сосудов и активации вторичных эффекторных клеток.
Повышение сосудистой проницаемости
РВИ, вызывая и поддерживая воспалительные изменения слизистой оболочки ДП, приводит к повышению сосудистой проницаемости [13, 24]. Это влечет за собой пропотевание альбумина и повышение вязкости бронхиального секрета с образованием слизистых пробок и развитием обтурации периферических ДП, что приводит к угнетению мукоцилиарного клириенса и задержке выведения воспалительного секрета [11].
Под действием респираторных вирусов, преимущественно РС-вируса, аденовируса, вируса парагриппа типа 3, происходит выработка медиаторов воспаления (гистамина, брадикинина, ЛТ, ФАТ). Вследствие этого стимулируются капсаицинчувствительные первичные афферентные нервные окончания, что приводит к высвобождению нейропептидов, в частности субстанции Р [22]. В результате повышается сосудистая проницаемость, развивается отек слизистой оболочки, сужается просвет бронхов. Все это вкупе с мышечным компонентом приводит к повышению реактивности ДП. Усиление отека слизистой оболочки усугубляет предсуществующую альтерацию эпителиальных клеток, замыкая порочный круг.
РВИ и изменения иммунной реактивности
Исследования последних лет подтверждают роль РВИ в развитии атопии [12, 24]. Одним из возможных механизмов формирования аллергических реакций является выработка IgE-антител на антигены вирусов [25]. Известно, что выработка IgЕ стимулируется интерлейкином-4 (ИЛ-4) и g- интерфероном [20, 21]. Основными эффекторными клетками в продукции IgE являются Т-хелперы (рис. 2).
Вирусная инфекция способствует активации Т-клеток и запуску процесса выработки IgE, что показано в эксперименте. При исследовании бронхоальвеолярного лаважа и участков бронхов, подвергавшихся воздействию риновируса, были отмечены клеточная инфильтрация и значительный приток эозинофилов в ДП. В эксперименте инкубация препарированных лимфоцитов и моноцитов с риновирусом 16 (RV 16) через 2 2 ч привела к увеличению концентрации СД3 и СД69. Поскольку СД69 является индикатором активации Т-клеток, можно заключить, что риновирусная инфекция в данном случае привела к развитию аллергического воспаления ДП [19].
Welliver и соавт. описали атопический процесс и развитие атопической предрасположенности у пациентов, ранее не страдавших заболеваниями органов дыхания, после РС-вирусной инфекции. Было показано, что выработка IgE, опосредованная повышенной продукцией ИЛ-4, приводила к снижению образования неоптерина (ингибирующего фактора аллергической реакции).
Были выявлены и другие механизмы повышения выработки IgE при РВИ [25]. Sakamoto и соавт. исследовали аллергическую сенситизацию к аэрозольному овальбумину у мышей с привнесенным вирусом гриппа. Отмечены усиление продукции IgE, значительная десквамация эпителия с повышением уровня пероксидазы. Возможно, это один из альтернативных вариантов Т-клеточной стимуляции продукции IgE при вирусной инфекции.
РВИ способствует вовлечению и других клеток в воспалительный и иммунный ответ (рис. 3). >, кинины, гистамин выявлено при изучении ГРБ во время РВИ (J. Barnett и соавт.) При инкубации препарированных лейкоцитов человека с вирусами гриппа А, парагриппа, РС-вирусом, парамиксовирусом выявлено значительное усиление высвобождения гистамина базофилами [18].
Выработка вирусспецифических IgE и их взаимодействие с эффекторными клетками ведут к мощному выбросу медиаторов воспаления, определяя формирование сенсибилизации и развитие аллергической реакции.
Основные принципы терапии вирусиндуцированной БА
Принципы лечения астмы, ассоциированной с РВИ, определяются особенностями воздействия вирусной инфекции на организм. С одной стороны, это супрессивное действие на иммунную систему, способствующее присоединению бактериальной флоры, с другой – снижение резистентности организма в целом, а также проявление аллергических реакций и симптомов бронхоконстрикции. В связи с этим в комплексную терапию необходимо включать противовирусные препараты, иммуномодуляторы, антибактериальные средства, одновременно проводя терапию БА в соответствии со степенью ее тяжести (адекватные дозы глюкокортикостероидов, препараты кромогликата натрия, бронхолитические, отхаркивающие, антигистаминные средства). Подробнее будут рассмотрены группы противовирусных и иммуномодулирующих препаратов.
В настоящее время противовирусная терапия остается все еще недостаточно успешной. Это связано с тем, что жизнедеятельность вирусов происходит внутри клетки, что затрудняет воздействие. Сложность состоит также в том, что клинические проявления РВИ развиваются уже после того, как произошла репликация с образованием вирусного потомства. Следовательно, более эффективны профилактика РВИ во время эпидемических вспышек и лечение контактеров в инкубационном периоде болезни. Механизмы действия, дозировки основных современных противовирусных препаратов представлены в табл. 4 .
Целью ее проведения является как восстановление факторов естественной защиты ДП, так и выработка специфического иммунитета к наиболее распространенным респираторным вирусным агентам. Использование поликомпонентных вакцин – мощное средство профилактики РВИ. Существуют противовирусные и противобактериальные вакцины. Их использование у пациентов с БА позволяет снизить вероятность формирования вирусно-бактериальных ассоциаций и уменьшить тяжесть обострений БА.
Биомунил Гранулт состоит из рибосом клебсиеллы, пневмококка, пиогенного стрептококка группы А, гемофильной палочки, протеогликана из клебсиеллы. Применяют по 3 таблетки или 1 дозу гранулята в течение 3 нед по 4 дня в неделю. Препарат можно комбинировать с антибиотиками, что особенно важно в случаях присоединения бактериальной флоры.
Бронховаксон содержит высушенные экстракты гемофильной палочки, пневмококка, K. pneumoniae и ozaenae, золотистого стафилококка, моракселлы, пиогенного и зеленящего стрептококка. Применяют по 1 капсуле. Более продолжительный курс лечения составляет 3 мес: в течение 1 мес по 1 капсуле в день, последующие 2 мес – 10 дней по 1 капсуле 2 раза в день. Препарат высокоэффективен у пациентов с вирусной инфекцией верхних и нижних ДП, особенно на фоне обструктивных заболеваний ДП.
Рибомунил – рибосомальная фракция из наиболее часто встречающихся рибосомальных патогенов (клебсиелла, пневмококк, пиогенный стрептококк группы А, гемофильная палочка и протеогликан из клебсиеллы). Показанием к применению служат повторяющиеся и острые инфекции респираторного тракта, в том числе при БА. Назначают по 3 таблетки утром 4 дня в неделю на протяжении 3 нед, затем 4 дня в месяц еще 5 мес. Подкожно препарат вводят по схеме.
ИРС 19 – раствор для ингаляций в виде спрея. Содержит лизаты пневмококка, гемофильной палочки, S. pyogenes и faecalis, золотистый стафилококк, M. catarrhalis, N.flava и perflava, Gatnya tetragena. Применяют ежедневно в каждый носовой ход при острых респираторных заболеваниях в течение 8-10 дней, при хронических респираторных инфекциях в течение 4 нед.
Луивак – таблетки, содержащие 3 мг лизата S. auerus и S.mitis, пиогенный стрептококк, пневмококк, клебсиеллу, моракселлу, гемофильную палочку. Показан при инфекциях верхних и нижних ДП по 1 таблетке каждые 28 дней.
Иммуноглобулины делятся на две группы: широкого спектра и направленного действия. Целью данной терапии является создание пассивного иммунитета.
Левамизол восстанавливает функцию Т-лимфоцитов и фагоцитов, усиливает реакцию клеточного иммунитета. Применяется при хронических и рецидивирующих инфекциях, хронических обструктивных болезнях легких. Суточная доза 150 мг.
Тималин регулирует количество Т- и b- лимфоцитов, стимулирует реакцию клеточного иммунитета, усиливает активность фагоцитов. Широко применяется при РВИ. Вводят внутримышечно по схеме.
Натрия нуклеинат – стимулирует миграцию и кооперацию Т- и b- лимфоцитов, повышает фагоцитарную активность макрофагов. Применяется при заболеваниях вирусной этиологии. Назначается внутрь по 0,25 – 0,5 – 1,0 г на прием.
Продигиозан активирует Т-систему иммунитета и функцию коры надпочечников. Применяется при хронических инфекциях ДП. Вводят внутримышечно по схеме.
1.Barnes PJ. New concepts in the pathogenesis of bronchial responsiveness and asthma. J Allergy Clin Immunol 1989;83:1013–26.
2. Hogg JC. Persistent and latent viral inf ections in the pathology of asthma. Am Rev Respir Dis 1992;145:S7.
3. Бронхиальная астма. Глобальная стратегия. Пульмонология. – 1996. – Прил.: С. 2 – 6.
4. Федосеев Г.Б. Механизмы обструкции бронхов. Спб.: Мед.информ. – 1995. – С. 333.
5. Чучалин А.Г. Бронхиальная астма. М.: “Агар”. – Том 2. – С. 90–102.
6. Busse WW, Godard P, Howarth P, et al. Role and contribution of viral respiratory infections to asthma. Eur J Allergy Clin Immunol 1993;48(Suppl. 17):57–61.
7. Сapcar D, Busse WW. Role of viral infections in ashtma. Immunol. Allergy Clin North Am 1993;13(4):745–67.
8. Empey DW, et al. Mechanisms of bronchial hyperreactivity in normal subjects after upper respiratory tract infection. Am Rev Respir Dis 1976;113:131.
9. Hall WJ, Hall CB. Bacteria and viruses in etiology and treatment. 564–73.
10. Покровский В.И., Лобан К.М. Руководство по инфекционным болезням. М.: Медицина. – 1986. – С. 306–27.
11. Чучалин А.Г. Бронхиальная астма. М.: “Агар”. – Том 1. – С. 343–56.
12. Busse WW. The role of respiratory infections in airway hyperresponsiveness and asthma. Am J Respir Crit Care Med 1994;150:S77–S79.
13. Busse WW. Mechanisms of persistent airway inflammation in asthma. Am J Respir Crit Care Med 1995;152:388–93.
14. Djukanovic R, et al. Mucosal inflammation in asthma. Am Rev Respir Dis 1990;142:434.
15. Springer TA. Adhesion receptors of the immune system. Nature 1990;346:425–34.
16. Jacoby DB, et al. Influenza infection causes airway hyperresponsiveness by decreasing enkephalinase. J Appl Physiol 1988;64:2653–8.
17. Saban R, et al. Enhancement by parainfluenza 3 infection of contractile responses to substance P and capsaicin in airway smooth muscle from the guinea pig. Am Rev Respir Dis 1987;136:586–91.
18. Clementsen P, et al. Influenza A virus enhances basophilic histamine release and the enhancement is abolished by carbohydrates. Allergy 1990;45(6):471–6.
19. Calhoun WJ, et al. Experimental rhinovirus-16 infection potentiates histamine release after antigen bronchoprovocation in allergic subjects. Am Rev Respir Dis 1991;144:1267–73.
20. Einarsson O, et al. Asthma- associated viruses specifically induce lung stromal cells to produce interleukin-11, a mediator of airway hyperreactivity. Chest 1995;107( Suppl.3): S132–S133.
21. Einarsson O, et al. Interleukin-11: stimulation in vivo and in vitro by respiratory viruses and induction of airways hyperresponsiveness. J Clin Invest 1996;97(4): 915–24.
22. Barnes PJ. Neuropeptides and asthma. Am Rev Respir Dis 1991;143(Suppl.):S28.
23. Holgate ST, et al. The pathogenesis and significance of bronchial hyperresponsiveness in airways disease. Clin Sei 1987;73:561–72.
24. Busse WW. Viral infections in humans. Am J Respir Crit Care Med 1995;151:1675–77.
25. Robinson DS, et al. Predominant TH2-like bronchoalveolar T-lymphocyte population in atopic asthma. N Engl J Med 1992;326:298–304.
Автор статьи и редакция “Русского медицинского журнала” выражают признательность московскому представительству фирмы “Glaxo Wellcome” за обеспечение всесторонней информационной поддержки, оказанной автору при подготовке данной публикации.
источник
Аденовирусная инфекция — это острое заболевание, относящееся к вирусным инфекциям. Это заболевание передается воздушно-капельным путем. Во время протекания этой болезни поражаются верхние отделы респираторного тракта, преимущественно носоглотка, ротоглотка, глаза, лимфатические узлы. Если протекает не осложненная форма заболевания, то обычно температура тела достигает 38°С и сохраняется такой на протяжении 6-14 дней. Наиболее подвержены этому заболеванию дети и лица пожилого возраста.
Как показывает статистика, аденовирусная инфекция — довольно распространенное заболевание. Оно составляет примерно 10% всех вирусных заболеваний. Вероятность заболеть увеличивается в холодное время года (осенью, зимой, ранней весной).
При аденовирусной инфекции повышается температура тела, появляется слабость, чувство недомогания. Обычно первым симптомом является появление боли в горле и в ротоглотке. Боль в горле напоминает жжение, при глотании боль усиливается. Как правило, начинается отек или гиперемия задних и передних стенок глотки и язычка. Появляются гнойные, слизистые выделения из носа, может появиться сухой кашель. Инкубационный период обычно длится от 5 до 14 дней со дня попадания вируса в организм.
Аденовирусная инфекция может переходить на другие органы, особенно, в легкие, в область бронхов и альвеол. Важно чтобы этого не произошло, потому что из-за этого может развиться пневмония. Так же вирус может поразить органы кишечника. Это происходит в случае попадания вируса через воду или пищу. Существуют и внешние симптомы, такие как воспаление фолликул. Они подвергаются значительной гипертрофии. Так же на фолликулах может образоваться белый налет, но не надо пугаться, обычно, он легко удаляется.
Аденовирусная инфекция сильнее других заболеваний, таких как ОРВИ, оно чаще поражает миндалины. Они воспаляются, покрываются белым налетом, увеличиваются в размерах. Белый налет похож на налет при ангине. Встречаются случаи, когда появляется желеобразный экссудат. Обычно он белого или серого цвета. Это свидетельствует о том, что поражены лакуны.
Когда заболевание прогрессирует, воспалительный процесс охватывает носоглотку, гортань, бронхи и трахею. Могут развиться сопровождающие заболевания, например, ларингит с трахеитом, фарингит, тонзиллит. Ларинготрахеит возникает вследствие аденовируса. Продолжительность ларинготрахеита от 3 до 7 дней. Именно ларинготрахеит показывает, что аденовирусная инфекция продолжается и переходит на следующую стадию. Появляется тяжелый болезненный, влажный кашель. Потом кашель становится более глубоким и носит длительный характер. Так же может увеличиться, в своих размерах, печень или селезенка, вследствие этого появляется лихорадка. В редких случаях заболевание сопровождается рвотой.
Именно детский организм наиболее часто подвергается аденовирусной инфекцией. Как показывает статистика, самый большой процент заболевания у детей происходит в период от 6 месяцев до 5 лет. Следующие в зоне риска — это дети до 14 лет. Часто это заболевание может поражать только что образованный коллектив, например, группу в детском саду. В этом случае необходимо заранее повышать иммунитет ребенка, потому что незащищенный иммунитетом организм — благоприятная среда для развития данного заболевания.
Если аденовирусная инфекция уже поразила детский организм, то нередко, проявляются такие симптомы как: увеличение печени или селезенки, жидкий или учащенный стул, или сильные боли в животе.
Помимо повышенной температуры (37,5 °С), которая держится 6-14 дней, у детей всегда проявляется глубокий грубый кашель и затрудненное дыхание, садится голос.
Современная классическая медицина подразумевает лечение аденовирусной инфекции таким же способом, как и любое другое респираторное вирусное заболевание. Но так как аденовирусы повреждают и поражают слизистую оболочку бронхов, глотки и всех дыхательных путей, при образовании некрозов, повторного наслоения микробной флоры, встречающейся на всех этапах данного заболевания, особенно при тяжелой и среднетяжелой степени заболевания.
В нашей клинике «ЛОР-Астма» наши врачи-специалисты для лечения аденовирусных инфекций применяют методы УЗИС, при помощи которого устраняется отёк с воспалением, происходит очищение слизистой оболочки от инфекций и аллергенов, а также грибков, имеющих патологическое отделяемое как мокроту и гной. Благодаря использованию данного метода лечения аденовирусной инфекции происходит процесс восстановления (регенерации) тканей. Уже спустя пару процедур происходит восстановление проходимости полости носа и носоглотки, бронхов и трахеи. Исчезает сухость и заживляется эрозия и изъязвление слизистой оболочки.
Также наши врачи-специалисты для успешного лечения аденовирусных инфекций применяют озоно-ультрафиолетовую санацию, после очищённой и открытой полости носа и носоглотки методом УЗИС. Носовые пазухи насыщаются озоном и освещаются ультрафиолетом. Благодаря этому происходит тщательная санация очагов от инфекций.
Закрепляется достигнутый эффект лазеротерапией, уничтожением бактерий и вирусов. Происходит форсирование регенерации тканей, а также усиление циркуляции крови и лимфотока.
Александр Пурясев,
доктор медицинских наук, главный врач клиники:Мне понятна ваша ситуация. Она не простая. Но я вам готов все разъяснить и, главное, смогу помочь! Но вы должны прийти ко мне на прием, т.к. у меня не хватит пальцев все это описывать в письме. Обращайтесь. помогу!
Александр Пурясев,
доктор медицинских наук, главный врач клиники:Сухой кашель может возникать по разным причинам! Вначале нужно определить причину и поставить диагноз, потом давать советы и заниматься лечением
Александр Пурясев,
доктор медицинских наук, главный врач клиники:Аллергологи во всех бедах винят аллергию, хоть вы с поносом придете, аллерголог и в этом узреет ”коварную” аллергию! Кстати, за рубежом нет такой врачебной специальности, как аллерголог. На фоне АСИТ аденоиды НИ КОГДА не уменьшатся — гарантирую! Это все сказки. Не ломайте голову, аденоиды ваши от хронической инфекции, которую нужно правильно просанировать, грамотно поднять иммунитет, после чего аденоиды уменьшаться, они начнут активно работать как иммунный орган, болеть будете реже, аллергия уйдет. Но для этого вам нужно обратиться в нашу клинику. Кроме нас аденоиды лечить ни кто не умеет.
Александр Пурясев,
доктор медицинских наук, главный врач клиники:Добрый день. Нужно видеть ребенка, рентген пазух носа и носоглотки, мазок из зева и носа, анализы крови, IgE. Анализ кала на дисбактериоз очень показателен в этих случаях (нужно искать инфекцию в кишечнике).
Александр Пурясев,
доктор медицинских наук, главный врач клиники:Потому что у ребенка хронический тонзиллит, его и надо активно лечить!
Акция направлена на профилактику острых и хронических заболеваний органов дыхания: аденоиды, хронический тонзиллит, гайморит (синусит), полипы носа, бронхит, бронхиальная астма. Впереди ненастье, холодная и сырая погода, и, как следствие, обострение хронических недугов органов дыхания. Именно поэтому, из-за хорошей погоды сейчас самое время заняться профилактикой. Лечебно-профилактические процедуры очистят и оздоровят слизистые дыхательных путей, а теплая и сухая погода будет способствовать восстановлению и укреплению слизистых дыхательного тракта. Впереди сырость и холод, а ты здоров — к зиме готов!
Условия акции в период с 01.09.19 — 15.10.19:
- Как при первичном так и повторном обращении — 20% скидка на весь перечень процедур (подробности у администраторов клиник)
Лицензия на медицинскую деятельность № ЛО-01-001424
- О возможных противопоказаниях необходимо проконсультироваться с врачом.
- Перепечатка информации возможна при наличии согласия администрации сайта и прямой ссылки на источник.
- Оставляя свой email или контактный телефон на cайте клиники, вы подтверждаете своё согласие на хранение, обработку и использование указанной Вами информации, в том числе для отправки срочных уведомлений
Написать руководителю
источник

 у него ухудшается аппетит, возникает кишечная колика и диарея.
у него ухудшается аппетит, возникает кишечная колика и диарея. широкоспекторных вироцидных препаратов. К ним относятся: «Арбидол», «Зовиракс», «Оксолиновая мазь».
широкоспекторных вироцидных препаратов. К ним относятся: «Арбидол», «Зовиракс», «Оксолиновая мазь».