Анкета для опроса пациентов с бронхиальной астмой позволяет эффективно, дешево, а главное, быстро собрать и адекватно оценить информацию, особенно это важно для врача, когда речь идет о приеме больных в поликлинике.
Времени, чтобы определить тяжесть болезни и внести поправки в лечение, мало, а человек с этим заболеванием требует особого внимания для предотвращения опасных осложнений и даже инвалидизации и смерти.
По данным эпидемиологических исследований, количество больных с диагностированной бронхиальной астмой растет год от года. Современная медицина достигла больших успехов в изучении процессов возникновения этого заболевания, в раннем выявлении первых симптомов, в применении современных эффективных лекарственных средств и профилактических методов, но смертность от него увеличивается. Это связано со следующими причинами:
- неадекватная оценка пациентами тяжести своего заболевания;
- нерегулярность приема препаратов;
- частичное или полное невыполнение рекомендаций лечащего врача;
- неправильная техника использования ингаляционных лекарств.
Но астму можно успешно лечить и полностью контролировать, т.е. практически не испытывать неприятные симптомы ни днем, ни ночью, не принимать быстродействующие препараты для снятия приступа и даже жить полноценно, без ограничений, как люди со здоровой дыхательной системой.
Другими словами, контроль – это конечная цель терапии, когда в результате кропотливого труда врача и пациента удается достичь хорошего самочувствия при минимальном количестве препаратов.
На протяжении жизни одного человека симптомы астмы могут исчезать и появляться снова, поэтому разработан ступенчатый подход к лечению, при котором по мере нарастания тяжести заболевания увеличивается интенсивность приема лекарств.
Астматик должен всегда принимать базисный препарат, как правило, это гормональные препараты с противовоспалительным действием (ингаляционные глюкокортикостероиды). При ухудшении дозу лекарств увеличивают, добавляют препараты с другим механизмом действия, при улучшении – убирают. Цель лечения – достижение контроля течения бронхиальной астмы.
Но понятие контроля многоплановое, и долгое время не было единого объективного метода его оценки. Это привело к разработке множества диагностических систем, которые учитывают симптомы бронхиальной астмы, ночные приступы и их количество, историю развития заболевания (анкеты, вопросники), оценку результатов лабораторных исследований и показателей функции дыхания, полученных при пикфлоуметрии, спирометрии.
Аппаратными методами оценки функционирования дыхательной системы пользуются преимущественно для диагностики астмы, для ежедневного контроля они не подходят, так как сложны в исполнении, недоступны для детей до 5 лет. Их показатели могут искажаться на фоне приема бронхорасширяющих лекарств.
Анкета по бронхиальной астме стала более перспективным вариантом, и с 2008 г. публиковалось их большое количество. Наибольшее применение получили тест по контролю АСТ (Astma Control Test) и вопросник ACQ-5 (Asthma Control Questionnaire). Они имеют небольшие различия.
ACQ-5 не содержит вопросов о применении быстродействующих препаратов, снимающих спазм бронхов, поэтому его результаты могут быть несколько завышены. Его преимуществом над АСТ является возможность предсказать количество обострений у пациента в ближайший год и изменить лечение заранее.
Для оценки уровня контроля удобен простой тест АСТ, который больной может пройти сам и адекватно оценить свой статус. Его удобно проводить в любое время суток, на работе, дома или в поликлинике. Он представлен двумя формами: для взрослых и для детей. Ведущие пульмонологические центры одобрили АСТ для использования в медицинской практике.
Анкета по бронхиальной астме доказала свою достоверность: результаты теста совпадают с оцененным специалистом-пульмонологом состоянием пациента и с данными спирометрии. И если она покажет, что состояние пациента неудовлетворительное, то необходима консультация доктора для своевременной коррекции терапии.
С диагностическими целями врачом могут быть заданы дополнительные вопросы. Так в докладе рабочей группой GINA (Глобальная инициатива по бронхиальной астме) было предложено простое исследование. Необходимо задать вопросы больному астмой о состоянии его здоровья в течение последнего месяца:
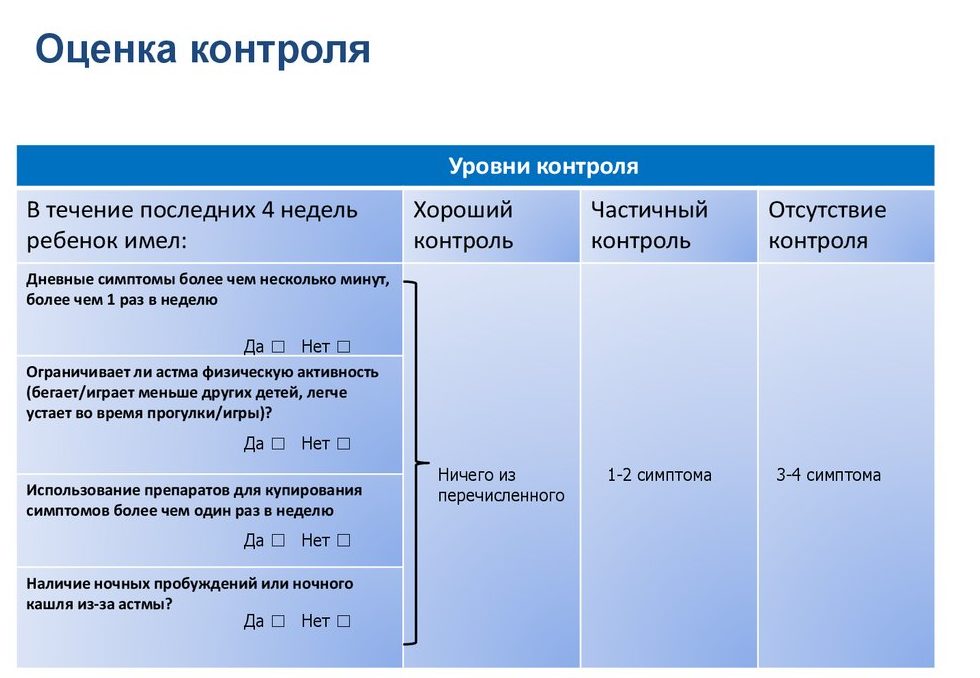
- Дневные приступы астмы чаще, чем 2 раза в неделю?
- Были ли ночные приступы астмы?
- Принимали ли вы препараты быстрого действия чаще двух раз в неделю?
- Испытываете ли вы ограничение физической активности?
Результаты трактуются так:
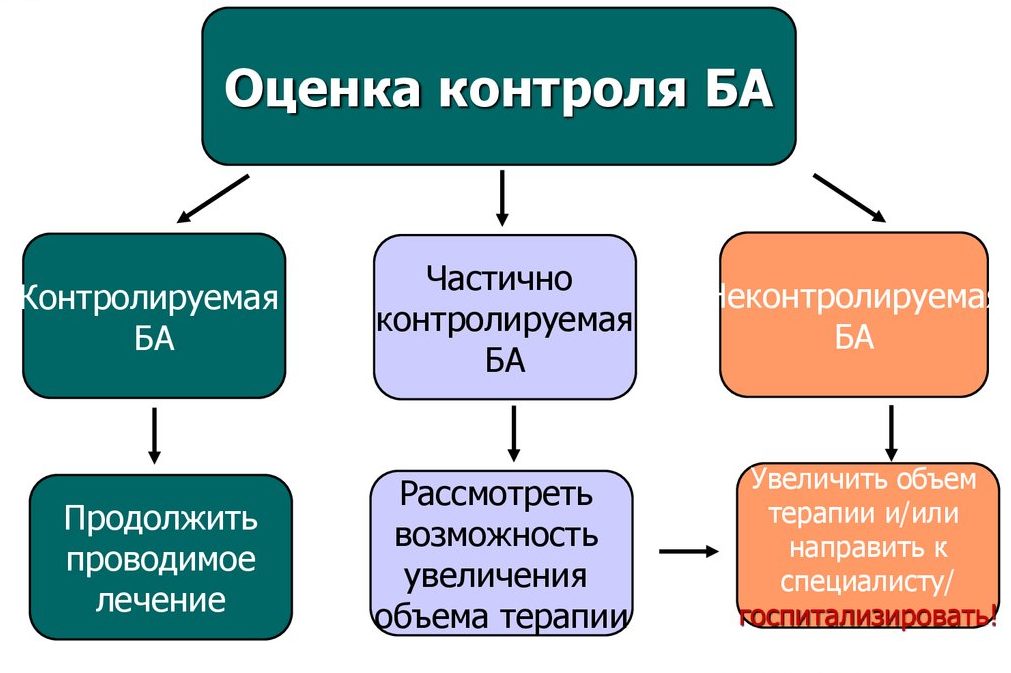
- контролируемая бронхиальная астма, если ответ «нет» на все вопросы. Лечение остается прежним;
- частично контролируемая, если ответ «да» на 1-2 вопроса. Возможно внесение некоторых изменений в схему приема или дозировку лекарственных препаратов;
- неконтролируемая, если положительные ответы на 3-4 вопроса. Требуется срочная коррекция базисной терапии, возможна госпитализация пациента.
Если вы сомневаетесь, под контролем ли ваша бронхиальная астма, ответьте на вопросы анкеты АСТ самостоятельно. Тест легко можно найти в Интернете или получить у лечащего врача. Есть отдельные варианты для детей и для взрослых. Методика проведения теста проста и понятна.
Опросник состоит из 5 вопросов, на каждый из которых нужно выбрать один из предложенных вариантов ответа. За ответы начисляются баллы от 1 до 5, которые в итоге суммируются. По набранному количеству баллов можно оценить данные о течении заболевания за последние 4 недели.
- 25 баллов – астма полностью контролируется.
- 20-24 балла – хорошо контролируется.
- Менее 20 баллов – астма контролируется неудовлетворительно, надо обратиться к медицинскому специалисту для изменения схемы лечения и предотвращения развития возможных осложнений.
Бронхиальная астма неизлечима, но с ней можно жить полноценно, без приступов удушья и затруднения дыхания, если контролировать свою болезнь. Анкетирование астматиков позволяет своевременно выявить обострение бронхиальной астмы, предотвратить развитие опасных осложнений.
Успех лечения будет зависеть не только от выполнения врачебных рекомендаций и приема препаратов, но и от уровня осведомленности об особенностях болезни. Получать полезную информацию нужно из надежных источников (медицинская литература, специализированные веб-сайты).
источник
Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Тест по контролю над астмой у детей — надёжный инструмент для оценки эффективности лечения при бронхиальной астме.
В связи с тем что главная цель лечения больных бронхиальной астмой — достижение и длительное поддержание контроля над заболеванием, терапию необходимо начинать с оценки текущего контроля над астмой, а объём лечения регулярно пересматривать, чтобы обеспечить контроль.
Сложность и трудоёмкость оценки контроля астмы как интегрального показателя в условиях реальной практики обусловливает необходимость внедрения и использования адекватных и эффективных инструментов. В процессе разработки методов совокупного определения контроля появилось несколько инструментов оценки, в том числе вопросники — ACQ (Asthma Control Questionnaire). RCP (Royal College of Physicians), Rules of Two и др. для детей старшего возраста. Один из наиболее простых методов, показавших высокую достоверность оценки контроля астмы в реальной клинической практике, — вопросник «Тест по контролю над астмой (Asthma Control Test)». Его применение рекомендовано GINA, 2006. До начала 2007 г. «Тест по контролю над астмой» был доступен только для взрослых и детей старше 12 лет, но в 2006 г. предложена его детская версия, которая на сегодняшний день служит единственным инструментом оценки контроля над астмой у детей в возрасте 4-11 лет.
Тест по контролю астмы у детей (Childhood Asthma Control Test) состоит из семи вопросов, причём вопросы 1-4 предназначены для ребёнка (4-балльная оценочная шкала ответов: от 0 до 3 баллов), а вопросы 5-7 — для родителей (6-балльная шкала: от 0 до 5 баллов). Результат теста — сумма оценок за все ответы в баллах (максимальная оценка — 27 баллов), от величины которой будут зависеть рекомендации по дальнейшему лечению пациентов. Оценка за Тест по контролю над астмой у детей 20 баллов и выше соответствует контролируемой астме, 19 баллов и ниже означает, что астма контролирована недостаточно эффективно; пациенту рекомендуют воспользоваться помощью врача для пересмотра плана лечения. В этом случае необходимо также расспросить ребёнка и его родителей о препаратах для ежедневного применения, чтобы убедиться в правильности техники ингаляций и соблюдении режима лечения.
Цели использования Теста по контролю над астмой:
- проведение скрининга пациентов и выявление больных с неконтролируемой астмой;
- внесение изменений в лечение для достижения лучшего контроля;
- повышение эффективности внедрения клинических рекомендаций;
- выявление факторов риска неконтролируемой астмы;
- мониторирирование степени контроля астмы как клиницистами, так и пациентами в любой обстановке.
Концептуально вопросник соответствует совокупности целей лечения астмы в обновлённом руководстве GINA (2006), так как ориентирован на достижение максимального результата для каждого больного астмой. Он позволяет оценить разные аспекты состояния пациентов и проводимого лечения, удобен для использования в амбулаторных или стационарных условиях и чувствителен к изменению состояния больного. Вопросник прост в применении для медицинского персонала и пациентов. Наконец, результат легко интерпретировать, он максимально объективен и позволяет оценивать контроль астмы в динамике. Данный тест рекомендован к применению основным международным руководством по диагностике и лечению бронхиальной астмы — GINA (2006).
В национальной программе «Бронхиальная астма у детей. Стратегия лечения и профилактика» большое значение придают регулярному диспансерному наблюдению и обучению родителей и детей методам самоконтроля. С этой целью используют пикфлоуметрию с системой цветовых зон (по аналогии с сигналом светофора).
Зеленая зона: состояние ребенка стабильное, симптомы отсутствуют или минимальны. Пиковая объемная скорость выдоха более 80% нормы. Ребенок Может вести обычный образ жизни, не принимать лекарственные средства или продолжать без изменений терапию, назначенную врачом.
Желтая зона: появляются умеренно выраженные симптомы астмы — эпизоды кашля и свистящего дыхания, нарушение самочувствия, пиковая объемная Скорость выдоха менее 80% возрастной нормы.
В этом случае необходимо увеличить объем лечения, дополнительно принять лекарства, рекомендованные врачом. Если состояние не улучшается в течение 24 ч, необходима консультация врача.
Красная зона: самочувствие плохое, появляются приступы кашля, удушья, в том числе ночные приступы. Пиковая объемная скорость менее 50%. Все это — показание для срочной консультации врача. Если ранее больной принимал гормональные препараты, необходимо немедленно дать больному преднизолон внутрь в рекомендованной врачом дозе и срочно госпитализировать больного.
Первая помощь на амбулаторном этапе при легком и среднетяжелом течении бронхиальной астмы в случаях обострения: применяются ингаляции бета-агонистов короткого действия (1 вдох каждые 15-30 сек — до 10 ингаляций) через небулайзер. При необходимости ингаляции повторяют с интервалом 20 мин 3 раза в течение часа.
При обострении бронхиальной астмы тяжелого течения назначаются бронхоспазмолитики через небулайзер, усиливает эффект бета-агонистов назначение ипратропиума бромида через небулайзер по 0,25 мг каждые 6 часов. У больных с тяжелой бронхиальной астмы, получавших ранее кортикостероиды или находящихся на терапии ИГКС, назначаются системные кортикостероидами коротким курсом в таблетках или в/в через каждые 6 часов. Хороший эффект для купирования обострения оказывают ингаляции через небулайзер будесонида (пульмикорт) в дозе 0,5-1 мг/сут.
Первая помощь при остром приступе: обеспечить доступ свежего воздуха; придать ребенку удобное положение; установить причину приступа и по возможности устранить ее; дать теплое питье; провести ингаляцию бронхолитика с использованием небулайзера; при сохраняющемся затруднении дыхания повторить процедуру через 20 мин; при отсутствии эффекта от ингаляции бронхолитика ввести в/в эуфиллин, глюкокортикостероиды. При неэффективности указанных мероприятий в течение 1-2 ч необходима госпитализация больного.

источник
Таблица 2-2. Оценка контроля БА у взрослых, подростков и детей в возрасте 6–11 лет, разработанная GINA
Уровень контроля симптомов БА
За последние 4 нед у пациента наблюдались:
Симптомы БА в дневное время
возникают чаще чем дважды в
неотложной помощи для купирования
симптомов* возникает чаще чем
Любое ограничение активности,
Б. Факторы риска неблагоприятных исходов при БА
Оценивать факторы риска на этапе установления диагноза, а также время от времени, особенно это касается пациентов, у которых наблюдаются обострения Проводить измерение ОФВ 1 в начале лечения, через 3–6 мес лечения с использованием терапии, направленной на
контроль заболевания, для регистрации самого лучшего личного показателя функции легких у пациента, затем время от времени для продолжения оценки рисков
Независимые модифицируемые факторы риска возникновения приступов (обострений)
• Симптомы неконтролируемой БА [68]
• Чрезмерное использование КДБА (>1 × 200-дозного аэрозольного баллончика в месяц) [69]
• Использование ИГКС, не отвечающее требованиям: ИГКС не назначен; неудовлетворительное
соблюдение предписанного режима терапии [70]; неправильная техника ингаляции [71]
• Низкий ОФВ 1 , особенно если он составляет • Значительные психологические или социально-экономические проблемы [74]
• Воздействия: курение [73]; воздействие аллергена при сенсибилизации [73]
• Сопутствующие заболевания: ожирение [75]; риносинусит [76]; подтвержденная пищевая аллергия [77]
• Эозинофилия мокроты или крови [78, 79]
Другие значимые в отношении приступов (обострений) независимые факторы риска
• Случаи интубации или попадания в отделение интенсивной терапии и реанимации в связи с БА [81]
• ≥1 тяжелого обострения за последние 12 мес [82]
Наличие одного или более таких факторов риска повышает риск обострений, даже если симптомы хорошо контролируются
Факторы риска развития фиксированного ограничения скорости воздушного потока
• Недостаточность терапии ИГКС [83]
• Воздействия: курение табака [84]; вредные химические соединения; профессиональные воздействия [28]
• Низкий исходный ОФВ 1 [85]; хроническая гиперсекреция слизи [84, 85]; эозинофилия мокроты или крови [85]
Факторы риска развития побочных эффектов, связанных с приемом лекарственных средств
• Системные : частое применение ПГКС; высокодозированный и/или сильнодействующий ИГКС, его долгосрочное применение; а также применение ингибиторов P450 [86]
• Местные : высокодозированные и сильнодействующие ИГКС [86, 87]; неправильная техника ингаляции [88]
* Не включает прием препаратов неотложной помощи перед физической нагрузкой. В случае детей в возрасте 6–11 лет также обратитесь к табл. 2-3. Чтобы ознакомиться со специальными стратегиями по снижению риска, см. табл. 3-6.
Примечание. Эта основанная на консенсусе экспертов классификация видов контроля, разработанная GINA, соответствует таковой от GINA за 2010–2012 годы, за исключением того, что сейчас показатели функции легких учитываются только при оценке «возможного риска в будущем». «Текущий клинический контроль» был переименован в «контроль симптомов», чтобы подчеркнуть, что эти параметры недостаточны для оценки контроля заболевания – также необходимо проводить и оценку риска неблагоприятных исходов в будущем. «Независимые» факторы риска представляют собой те факторы, которые остаются значимыми после корректировки уровня контроля симптомов. Показатели неудовлетворительного контроля симптомов и риска возникновения обострений не должны просто суммироваться, так как они могут иметь различные причины и требовать различных стратегий лечения.
Обозначения: ингибиторы P450 – ингибиторы цитохрома P450, такие как ритонавир, кетоконазол, итраконазол. Здесь и в табл. 2-3: ПГКС – пероральный ГКС.
2. Оценка бронхиальной астмы
Категорийные методики контроля симптомов : примеры включают основанный на консенсусе экспертов метод контроля симптомов, разработанный GINA (см. табл. 2-2, часть A). Для принятий решений по назначению лечения (см. рис. 3-2) эта классификация способов контроля симптомов может использоваться наряду с оценкой риска (см. табл. 2-2, часть Б). Данная классификация коррелирует с результатами оценки, полученными при использовании балльной оценки контроля БА [55, 56].
Методики численной оценки «контроля БА» : в этих методиках предлагаются баллы и разделительные точки для выявления различий между уровнями контроля симптомов; эти методики валидизированы на основе оценок «контроля БА», полученных в лечебных учреждениях. Доступно много переводов таких методик. Эти результаты могут быть полезны при оценке прогресса, достигнутого у пациента; они широко используются в клинических исследованиях, но могут быть объектом авторского права.
В сравнении с категорийными методиками методики балльной оценки контроля БА более чувствительны к изменению контроля симптомов [55]. Примеры:
• вопросник по контролю астмы (Asthma Control Questionnaire (ACQ)) [57, 58]. Результаты варьируют в диапазоне от 0 до 6 баллов (чем выше, тем хуже). Результат 0–0,75 балла классифицируется как хорошо контролируемая БА; 0,75–1,50 балла – как «серая зона» и >1,5 балла – как плохо контролируемая БА. Сумма баллов согласно ACQ вычисляется как среднее по вопросам 5, 6 или 7: все версии ACQ включают вопросы по пяти симптомам; ACQ-6 включает информацию об использовании препаратов неотложной
помощи; в ACQ-7 сумма баллов для ОФВ 1 перед введением бронхолитика представляет собой среднее значение баллов, полученных по вопросам, посвященным симптомам и препаратам неотложной помощи. Минимальное клинически значимое различие составляет 0,5 [59];
• тест по контролю астмы (Asthma Control Test (ACT)) [56, 60, 61]. Результаты варьируют в диапазоне от 5 до 25 баллов (чем выше, тем лучше). Результат 20–25 баллов классифицируется как хорошо контролируемая БА, 16–20 баллов – как не очень хорошо контролируемая БА и 5–15 баллов – как очень плохо контролируемая БА. ACT включает четыре вопроса по симптомам/препаратам неотложной помощи, а также самостоятельную оценку пациентом уровня контроля. Минимальное клинически значимое различие составляет 3 пункта [61].
При использовании различных систем для оценки контроля симптомов БА полученные результаты в целом коррелируют друг с другом, но не идентичны. Респираторные симптомы могут быть неспецифическими, таким образом, при проведении оценки изменений в контроле симптомов важно уточнить, что симптомы обусловлены БА.
Методики оценки контроля симптомов бронхиальной астмы у детей в возрасте 6–11 лет
У детей, как и у взрослых, оценка контроля симптомов БА основана на симптомах, ограничении активности и использовании лекарственных средств для неотложной помощи. Очень важна тщательная оценка влияния БА на дневную активность ребенка, которая включает занятия спортом, игры и участие в общественной жизни. Многие дети с плохо контролируемой БА избегают интенсивной физической нагрузки, в связи с чем БА может казаться хорошо контролируемой. Это может приводить к плохой физической форме и повышенному риску ожирения.
У разных детей степень ограничения скорости воздушного потока, наблюдаемая перед тем, как они начинают жаловаться на одышку или использовать назначенные им препараты неотложной помощи, может значительно различаться. Часто, прежде чем родители заметят какие-либо изменения в поведении ребенка, снижение показателей функции легких уже становится выраженным. Основными проблемами, которые могут отмечать родители у ребенка с неконтролируемой БА, являются возбудимость, утомляемость и изменчивость настроения. Поскольку у родителей период памяти несколько длиннее, чем у детей, которые могут вспомнить информацию только за последние несколько дней, при проведении оценки уровня контроля симптомов важно включать информацию, полученную как от родителей, так и от ребенка.
Разработано несколько систем балльной оценки контроля БА для детей. Они включают:
• тест по контролю астмы у детей (Childhood Asthma Control Test (c-ACT)) [62] с отдельными разделами для заполнения родителем и ребенком;
• вопросник по контролю астмы (Asthma Control Questionnaire (ACQ)) [63].
Некоторые системы оценки контроля БА у детей наряду с симптомами учитывают и обострения. К ним относятся:
• тест для контроля респираторных симптомов и БА у детей (Test for Respiratory and Asthma Control in Kids (TRACK)) [64–66];
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Для цитирования. Лещенко И.В., Эсаулова Н.А. Бронхиальная астма: современные вопросы базисной терапии (в помощь практическому врачу) // РМЖ. 2015. № 18. С. 1074–1079.
В настоящее время имеются многочисленные отечественные и зарубежные публикации, посвященные бронхиальной астме (БА), оценке тяжести заболевания и медикаментозной терапии.
БА можно успешно лечить, поэтому почти все больные могут:
– предотвратить беспокоящие симптомы заболевания;
– предотвратить серьезные обострения;
– использовать редко или совсем не использовать средства скорой медицинской помощи;
– вести полноценную, физически активную жизнь;
– иметь нормальную (или почти нормальную) функцию легких.
Основополагающими документами, в которых изложено, как проводить диагностику, лечение и профилактику заболевания, являются современные международные руководства и Федеральные клинические рекомендации по диагностике и лечению БА [1, 2]. В соответствии с рекомендациями Global Initiative for Asthma (GINA) [1], объем базисной терапии БА зависит прежде всего от уровня контроля заболевания. Критерии контроля БА довольно просты для понимания и врачом, и пациентом и включают:
– выраженность хронических симптомов, в т. ч. ночных минимальных (в идеале – симптомы отсутствуют);
– обострения минимальны (редки);
– потребность в неотложной помощи отсутствует;
– использование b2-агонистов короткого действия «по потребности» – минимальное (в идеале – отсутствует);
– ограничения активности, в т. ч. физической, нет.
Даже одного признака степени тяжести достаточно для того, чтобы отнести пациента с БА к группе с частичным контролем или его отсутствием (табл. 1).
Опрос с использованием балльной оценки симптомов по опросникам Asthma Control Test (ACT) и Asthma Control Questionnaire (ACQ) является более чувствительным при оценке изменения уровня контроля симптомов БА [3, 4]. Весьма полезным для практического врача является опросник по контролю симптомов БА и риска обострений (ACQ), который представлен в таблицах 2 и 3 [4].
Цели лечения БА заключаются в достижении контроля заболевания, предотвращении обострений и побочных эффектов действия лекарственной терапии, улучшении качества жизни.
Факторы риска (триггеры) обострений или приступов БА:
– аллергены;
– табачный дым;
– вирусные инфекции;
– поллютанты;
– пищевые добавки;
– профессиональные вредности;
– физическая нагрузка;
– смех;
– холодный воздух;
– лекарственные препараты.
К независимым от триггерных влияний факторам риска обострений БА относятся анамнестические данные о госпитализации в отделение реанимации и интенсивной терапии или интубация в связи с острой дыхательной недостаточностью на фоне обострения БА, а также одно или в более тяжелой форме обострение за 12 мес. [5, 6].
С целью предотвращения обострений БА особое внимание следует обратить на факторы риска, влияние которых можно уменьшить в результате врачебного вмешательства. К ним относят:
– неконтролируемые симптомы БА [7];
– прием более 200 доз (один ингалятор) короткодействующего бронходилататора (КДБД) в месяц, т. е. частое использование средств скорой помощи [8];
– применение неадекватных доз ингаляционных глюкокортикоидов (ИГК), например, в случае если пациенту они ранее не назначались или были рекомендованы в необоснованно низких дозах [9];
– недостаточный объем терапии ИГК из-за низкой приверженности к лечению [9];
– нарушение техники ингаляций [10];
– уменьшение объема форсированного выдоха в 1 с (ОФВ1), особенно до 60% от должных показателей [11];
– серьезные психологические или социально-экономические проблемы [11];
– воздействие внешних факторов (например, табачный дым [11]);
– контакт с аллергенами при наличии сенсибилизации [11];
– сопутствующие заболевания, такие как ожирение, риносинусит, подтвержденная непереносимость компонентов пищи;
– эозинофилия в крови или мокроте [9, 12];
– беременность [13].
При неправильном выборе терапии или недостаточной комплаентности больного возможно развитие побочных местных и системных эффектов от приема следующих препаратов [14], таких как:
– бронходилататоры, которые при бесконтрольном использовании могут вызывать тремор, тахикардию [15]. Их применение в превышенных дозах, особенно при гипоксемии, приводит к риску аритмических осложнений, нарушению обмена глюкозы, снижению уровня калия в сыворотке крови [15, 16], десенситизации b2–рецепторов, повышению риска внезапной смерти [1];
– ИГК, применение которых в высокой суточной дозе, а также неправильная техника ингаляций могут привести к локальным нежелательным явлениям (НЯ);
– системные глюкокортикоиды (СГК), которые при частом применении (один и более курсов в течение года) увеличивают риск формирования остеопороза [5], генерализации вирусных инфекций, асептического некроза головки бедренной кости, приводят к нарушению обмена глюкозы, повышают вероятность увеличения массы тела (ожирения) и образования пептических язв [5].
Назначение базисной терапии в соответствии с уровнем контроля БА способствует:
– уменьшению частоты обострений этого заболевания;
– минимизации побочных эффектов действия лекарств;
– сокращению потребности пациентов с БА в экстренной помощи;
– числа обращений к врачу и госпитализаций;
– прямых расходов на БА.
Выбор препаратов для базисной терапии БА осуществляется на основании доказательных данных об эффективности и безопасности препаратов, а также с учетом доступности и стоимости лечения. При недостаточном контроле БА необходимо выявить причины, из-за которых он отсутствует, и, при необходимости, изменить базисную терапию (ступень вверх) с учетом индивидуальных потребностей пациента.
Одной из важнейших задач, которая стоит перед врачом, является определение объема стартовой базисной терапии и объема лекарственной терапии у больных БА, получающих базисную терапию.
При назначении стартовой базисной терапии больным БА рекомендуется руководствоваться следующими принципами:
• Пациент не нуждается в базисной терапии, если он отмечает симптомы БА или потребность в КДБД реже 2 р./мес., у него отсутствуют факторы риска обострений заболевания или само обострение БА в течение последнего года (уровень доказательности D).
• Низкие дозы ИГК показаны пациентам с нечастыми симптомами БА (реже 2 р./мес.) при наличии одного или более факторов риска обострений БА (уровень доказательности D).
• Низкие дозы ИГК назначаются, если симптомы астмы или потребность в КДБД возникают реже 2 р./нед., но чаще 2 р./мес. или если пациент просыпается в ночные часы более 1 р./мес. из-за симптомов астмы (уровень доказательности B).
• Средние или высокие дозы ИГК либо комбинация низких доз ИГК с длительно действующими бронходилататорами (ДДБД) рекомендуются пациентам с симптомами астмы (которые беспокоят их большую часть недели) или с частыми пробуждениями ночью из-за астмы (1 и более р./нед.), особенно при наличии факторов риска обострений (уровень доказательности А).
Объем лекарственной терапии у больных БА, получающих базисную терапию, определяется в зависимости от уровня контроля заболевания. При этом следует руководствоваться следующими принципами:
• Ретроспективно (в течение последних 3–6 мес.) оценивается тяжесть БА в зависимости от объема базисной терапии, которая требуется для полного контроля заболевания и предотвращения его обострений [17–19]. Степень тяжести астмы не является постоянной характеристикой и может измениться через несколько месяцев или лет.
• Определяются показатели функции внешнего дыхания (ФВД), в частности, величина ОФВ1. Установлено, что показатели ФВД не имеют сильной корреляционной связи с симптомами БА у взрослых, они не всегда имеют решающее значение, однако низкая величина ОФВ1 является независимым предиктором риска обострений БА, даже при нечастых симптомах заболевания [20, 21].
Оценку эффективности базисной терапии и показатели ФВД, в частности уровень ОФВ1, целесообразно оценивать при определении объема стартовой терапии через 3–6 мес. после начала лечения пациента. При наличии полного контроля заболевания в это время необходимо сделать попытку уменьшить объем базисной терапии на одну ступень для определения минимально эффективного объема принимаемых лекарственных средств.
Безусловно, первоочередными препаратами для базисной терапии БА являются ИГК. При выборе ИГК важно учесть эффективность и безопасность препарата.
Пациенты с респираторной патологией относятся к группе повышенного риска развития активного туберкулеза, и данный риск увеличивается при использовании высоких доз ИГК. Несмотря на низкую системную биодоступность, ИГК все же обладают системными эффектами, и одним из них является повышенный риск развития сахарного диабета или его прогрессирования, особенно при использовании высоких доз ИГК [22]. Говоря о безопасности ИГК, необходимо подчеркнуть, что при анализе случаев глаукомы, требующей терапии, не было отмечено повышенного риска развития и прогрессирования данного заболевания на фоне терапии ИГК даже в случае длительного применения препаратов в высоких дозах [22]. При применении ИГК даже в высоких дозах во время беременности, по данным публикаций, не было продемонстрировано нарушения функции надпочечников у плода [23].
Заслуживают внимания предпочтения пациента в выборе лекарственного препарата для базисной терапии, который обладает максимальным эффектом. Поскольку в настоящее время существует множество ингаляционных устройств для базисной терапии, действенность лечения зависит от технических характеристик ингалятора и способности пациента правильно пользоваться ингаляционными устройствами. Кроме того, следует убедиться, что пациент ориентирован на регулярный прием базисных препаратов, особенно при недостаточном уровне контроля заболевания. Эквипотентные суточные дозы ИГК для взрослых и детей старше 12 лет приведены в таблице 4.
ИГК применяются в качестве монотерапии в низких дозах при лечении больных с легкой персистирующей астмой (2-я ступень) и в средних/высоких дозах при лечении больных со среднетяжелой БА (3-я ступень) [1, 2]. В таблице 5 представлена схема базисной терапии БА в соответствии с уровнями доказательств, отражающая ступенчатый подход [1].
В тех случаях, когда речь идет о монотерапии ИГК больных БА, одна из задач, стоящих перед лечащим врачом, заключается в выборе ИГК в качестве монотерапии или в сочетании ИГК с ДДБД.
Изучение эффективности и безопасности различных ИГК проведено в многочисленных клинических многоцентровых плацебо-контролируемых исследованиях на большой популяции больных БА легкой и средней тяжести.
Так, например, ретроспективная оценка эффективности предотвращения обострений, требующих госпитализации, у 1273 больных с персистирующей БА легкой степени показала достоверное преимущество мометазона фуроата (МФ) по сравнению с беклометазоном дипропионатом (БДП) (отношение шансов 0,51; р=0,0191) [24].
Сравнение эффективности и безопасности МФ дозированного порошкового ингалятора (МФ-ДПИ) и будесонида в 12-недельном многоцентровом слепом исследовании (57 клинических центров, 17 стран) с участием 730 больных со среднетяжелой БА показало [25]:
• МФ-ДПИ (200 мкг 2 р./сут и 400 мкг 2 р./сут) достоверно улучшал показатели ОФВ1 по сравнению с будесонидом (400 мкг 2 р./сут) начиная со 2-й нед. терапии.
• Различие в эффективности нарастало по мере продолжения лечения вплоть до 12-й нед., и в целом увеличение значений ОФВ1 со временем при приеме будесонида 400 мкг 2 р./сут было менее выражено, чем для всех режимов лечения МФ-ДПИ.
• Дополнительно терапия МФ-ДПИ (400 мкг/сут) приводила к достоверно более выраженному снижению ежедневной потребности в КДБА по сравнению с будесонидом.
• Отмечена хорошая переносимость терапии сравниваемыми препаратами; серьезных НЯ, связанных с лечением, не было ни в одной группе; влияния на уровень кортизола не наблюдалось; НЯ, такие как головная боль (4–8%), фарингит (4–5%), дисфония (2–5%), зарегистрированы с одинаковой частотой в обеих группах.
Авторы делают вывод о том, что МФ-ДПИ в средней суточной дозе 400 мкг/сут обеспечивает значимо большее улучшение показателей ФВД по сравнению с таковым при применении будесонида 800 мкг/сут у пациентов со среднетяжелой БА и хорошо переносится [25].
В метаанализе 6 рандомизированных контролируемых клинических исследований представлена сравнительная оценка эффективности и безопасности МФ и других ИГК в эквипотентных дозах при лечении 1354 пациентов со среднетяжелой/тяжелой БА, получавших прежде терапию каким-либо ИГК [26]. Продолжительность исследований составляла 4 нед. и более.
Результаты исследований показали превосходство МФ по сравнению с другими ИГК в отношении следующих показателей ФВД:
– ОФВ1;
– пиковая скорость выдоха;
– форсированная жизненная емкость легких;
– мгновенная объемная скорость выдоха на уровне 25–75%.
МФ оказался эффективнее других ИГК в отношении уменьшения потребления короткодействующих и b2-агонистов (КДБА) и утренних симптомов астмы. Частота НЯ, в т. ч. серьезных, была сопоставима во всех группах больных, в т. ч. лечившихся МФ.
Высокая эффективность МФ связана с его более высокой аффинностью к глюкокортикостероидному рецептору, чем у наиболее часто применяемых ИГК (рис. 1) [27, 28]. Кроме того, МФ характеризуется наименьшей системной биодоступностью среди сравниваемых ИГК, обеспечивая его высокую безопасность (рис. 2) [28].
Рекомендованные дозы МФ-ДПИ для лечения больных БА взрослых и подростков от 12 лет и старше представлены в таблице 6 [29].
Конечно, основная роль в базисной терапии в достижении контролируемого течения БА принадлежит комбинированной терапии ИГК и длительно действующим b2-агонистам (ДДБА). Комбинированные препараты назначаются больным БА в соответствии с необходимой суточной дозой ИГК для достижения контролируемого течения этой болезни. В таблице 7 даны схемы лечения ингаляционными комбинированными лекарственными средствами, назначаемыми в качестве базисной терапии больным БА средней и тяжелой степени в зависимости от необходимой суточной дозы ИГК для достижения контролируемого течения БА. Все препараты, названные в таблице 7, зарегистрированы в РФ.
Представленные в таблице 7 схемы лечения ИГК и ДДБА дают возможность лечащему врачу назначить различные комбинированные препараты в соответствии с эквипотентной дозой ИГК и в зависимости от уровня контроля астмы, т. е. выраженности симптомов БА и частоты обострений.
Одной из задач, стоящих перед практикующим врачом, является выбор ингаляционного комбинированного лекарственного препарата для базисной терапии. Одним из них является МФ/формотерола фумарат (МФ/Ф). Рекомендуемые дозы МФ/Ф приведены в таблице 8.
В ряде публикаций, в т. ч. в отечественной литературе, ранее представлены материалы, посвященные фармакологическим свойствам МФ/Ф, входящим в состав комбинированного препарата МФ и Ф, сравнительным клиническим исследованиям, в которых изучались эффективность МФ/Ф в отношении уменьшения частоты тяжелых обострений, увеличения ОФВ1 и безопасность по сравнению с монотерапией составляющих его лекарственных средств и плацебо [30, 31]. Сравнение показателей ФВД в рандомизированном многоцентровом исследовании в параллельных группах у больных БА при назначении МФ/Ф 100 мкг / 5 мкг – 2 дозы 2 р./сут (n=141) и 250 мкг / 25 мкг флутиказона/салметерола (ФЛ/САЛ) – 1 доза 2 р./сут (n=68) показало более быстрое начало действия (через 5 мин) при применении МФ/Ф по сравнению с ФЛ/САЛ, выражающееся в приросте ОФВ1 (8,5% против 4,3% соответственно, р
источник
Бронхиальная астма (БА) является гетерогенным заболеванием, как правило, характеризующимся хроническим воспалением дыхательных путей и наличием таких симптомов, как свистящее дыхание, одышка, чувство сжимания в грудной клетке и кашель, с переменной частотой и интенсивностью, связанных с различным по степени нарушением экспираторного потока воздуха через дыхательные пути. Ограничение потока воздуха вызвано: спазмом гладких мышц и отеком слизистой оболочки бронхов, формированием слизистых пробок, а с течением времени, также с перестройкой стенки бронха. БА с точки зрения этиологии делится на аллергическую (чаще всего начинается в детском возрасте, часто сопутствуют другие атопические заболевания, обычно эозинофилия индуцированной мокроты и хороший ответ на ингаляционные ГКС) и неаллергическую (обычно у взрослых лиц, часто худший ответ на ингаляционные ГКС). Кроме того, выделяют фенотипы БА:
2) с постоянной бронхиальной обструкцией;
3) сопровождающейся ожирением.
При аллергической астме связывание аллергена со специфическими антителами IgE на поверхности тучных клеток высвобождает медиаторы (в том числе гистамин, протеолитические энзимы, цистеиновые лейкотриены), которые вызывают бронхиальную обструкцию. В некоторых случаях спустя 6–8 часов после ранней фазы аллергической реакции наступает поздняя фаза, в которой тучные клетки, базофилы и другие клетки высвобождают цитокины и хемокины, многократно усиливающие приток воспалительных клеток, в частности, эозинофилов, в бронхи. Патомеханизм неаллергической астмы до конца не исследован, но гистопатологическая картина похожа на аллергическую астму. Повреждение эпителия бронхов стимулирует процессы репарации, результатом чего является перестройка стенки бронхов, которая приводит к тому, что в особенно тяжелых случаях обструкция становится необратимой.
Факторы, вызывающие приступы и обострения БА или провоцирующие их персистирование: аллергены, инфекции дыхательных путей (в основном вирусные), загрязнение воздуха (в том числе табачный дым, аэрозоли, используемые в домашнем хозяйстве, пары красок и т. д.), физическая нагрузка, сильные эмоции, изменения погоды, ЛС (β-блокаторы, НПВП), еда и пищевые добавки.
Факторы, повышающие риск обострений БА: неконтролируемые симптомы БА (в т. ч., чрезмерное потребление β 2 -агонистов короткого действия (ежемесячно >1 упаковки, содержащей 200 доз), неправильное использование ингаляционных ГКС (несоблюдение приема назначенного пациенту препарата, неправильная техника ингаляции), низкий ОФВ 1 (особенно
Факторы риска фиксации бронхиальной обструкции: неиспользование ингаляционных ГКС, воздействие табачного дыма или других вредных веществ (в том числе на рабочем месте), низкий исходный ОФВ 1 , хроническая чрезмерная продукция секрета в дыхательных путях, эозинофилия мокроты или крови.
КЛИНИЧЕСКАЯ КАРТИНА И ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ наверх
1. Субъективные симптомы : пароксизмальная одышка, в основном экспираторная (иногда ощущаемая как сжимание в грудной клетке), которая проходит спонтанно или под влиянием лечения; свистящее дыхание; сухой, приступообразный кашель (сопровождающий одышку или как единственный симптом [так называемый кашлевой вариант астмы]; изолированный кашель у взрослых редко является симптомом БА). У больных с аллергической БА сопутствуют симптомы других аллергических заболеваний, наиболее часто аллергического ринита. Субъективные и объективные симптомы имеют изменчивый характер и могут не проявляться за исключением эпизодов приступов и обострений БА.
2. Объективные симптомы : диффузные, двусторонние свистящие хрипы (в основном экспираторные) и сухие хрипы, удлиненный выдох (иногда симптомы, которые выслушиваются только при форсированном выдохе); во время обострений работа вспомогательных мышц и тахикардия. При очень тяжелом обострении аускультативные симптомы могут не наблюдаться (так называемое «немое легкое»).
3. Естественное течение : БА может возникнуть в любом возрасте. Если она начинается в зрелом возрасте, то чаще является неаллергической и имеет более тяжелое течение. В течение БА происходят обострения, которые развиваются внезапно (в течение нескольких минут или часов) или постепенно (в течение нескольких часов или дней) и без применения лечения могут привести к смерти. Многолетняя неконтролируемая БА приводит к прогрессирующей, необратимой обструкции дыхательных путей.
Дополнительные методы исследования
1. Спирометрия: у большинства пациентов результат базовой спирометрии находится в пределах нормы. Для БА характерна обструкция, в особенности с изменчивой интенсивностью (существенные колебания между очередными исследованиями, или под влиянием лечения); при бронходилатационной пробе — существенное улучшение ОФВ 1 и/или ФЖЕЛ (≥200 мл и ≥12 % от должного) и часто даже устранение обструкции (при тяжелой БА или при БА с ремоделированием бронхов обструкция может быть необратимой), а также гиперреактивность бронхов при провокационной пробе с метахолином или гистамином. В особых случаях диагноз можно подтвердить с помощью специфических провокационных проб с аллергеном, ацетилсалициловой кислотой, присутствующими на рабочем месте факторами, физической нагрузкой.
2. Пиковая скорость выдоха (ПСВ): характерной является средняя (в течение 2 нед. измерений) суточная вариабельность ПСВ ([ПСВ макс – ПСВ мин ] / ПСВ средн ) >10 %; измерения используются для подтверждения диагноза, мониторинга заболевания (следует рассмотреть целесообразность у больных с тяжелой формой бронхиальной астмы или со слабым восприятием симптомов) и определения факторов, провоцирующих симптомы (напр. профессиональные факторы).
3. РГ грудной клетки: обычно в норме, при обострении могут присутствовать признаки гиперпневматизации легких (воздушные ловушки) и осложнения обострения (напр. пневмоторакс).
4. Пульсоксиметрия и газометрия артериальной крови: используйте с целью оценки тяжести и мониторинга течения обострений →см. ниже.
5. Исследования, определяющие IgE -опосредованную аллергию: кожные пробы, концентрация общего и специфического IgE — может определить сенсибилизирующий аллерген у пациента с аллергической астмой.
6. Исследование индуцированной мокроты на эозинофилию: в центрах, имеющих опыт, может использоваться для изменения лечения у пациентов с умеренной или тяжелой БА.
7. Исследование концентрации окиси азота в выдыхаемом воздухе ( FE NO ): в качестве дополнительного исследования при дифференциальной диагностике с ХОБЛ →табл. 3.8-1. У ранее не получавших лечение пациентов повышенный показатель (>50 ppb) коррелирует с хорошим ответом на лечение ингаляционными ГКС.
Для постановки диагноза БА (согласно GINA) требуется наличие симптомов заболевания, а также изменение выраженности бронхиальной обструкции при функциональных исследованиях →табл. 3.9-1. Необходимо оценивать степень тяжести заболевания.